主動脈瓣鈣化患者基因表達與microRNA調(diào)控研究
邵晗琪 劉玉琴
主動脈瓣鈣化(calcific aortic valve disease, CAVD)是最常見的老年人的瓣膜性心臟病,在中國的發(fā)生率不斷增加[1]。CAVD患者通常會出現(xiàn)胸悶、疼痛、呼吸困難和暈厥,可能導(dǎo)致充血性心力衰竭和心源性猝死[2]。目前,CAVD唯一可治愈的方法是侵入性治療,包括外科主動脈瓣置換術(shù)和經(jīng)導(dǎo)管主動脈瓣植入術(shù)[3,4]。然而,這種治療措施存在一定的局限性,如主動脈的血流動力學(xué)不能完全恢復(fù),主動脈竇的解剖學(xué)結(jié)構(gòu)不能完全重建,且生物人工瓣膜仍然有鈣化和成骨的風(fēng)險。另外,即使成功的侵入性治療也可能導(dǎo)致嚴重的心腦血管不良事件,并產(chǎn)生更多的創(chuàng)傷和醫(yī)療費用[5]。因此,對CAVD進行早期診斷并提供有效的藥物治療仍是巨大的挑戰(zhàn)。
miRNA通過RNA誘導(dǎo)沉默復(fù)合體導(dǎo)致mRNA的降解和翻譯的抑制,因此miRNA失調(diào)可能參與CAVD發(fā)生。有研究表明,miRNA參與CAVD的調(diào)控過程,如miR-92a可作為急性CAVD的潛在分子標志物,miR-34a可通過抑制Notch1-Runx2信號通路緩解CAVD[6,7]。然而,目前通過多組學(xué)的手段對CAVD患者樣本進行聯(lián)合分析的研究較少。
因此,本研究在GEO數(shù)據(jù)庫上收集了CAVD相關(guān)的基因表達及miRNA芯片數(shù)據(jù),采用更嚴格的統(tǒng)計分析方法篩選差異基因與miRNA,并進行了miRNA-差異基因的生物信息學(xué)聯(lián)合分析,同時檢索了不同病因相關(guān)基因的差異表達情況,旨在尋找潛在藥物干預(yù)靶點,為探究有效的治療方式提供新思路。
資料與方法
1. 數(shù)據(jù)收集:以“calcific aortic valve”、“Homo sapiens”為關(guān)鍵詞,在GEO數(shù)據(jù)庫(https:∥www.ncbi.nlm.nih.gov/geo/)找到2組轉(zhuǎn)錄組測序數(shù)據(jù)(GSE55492、GSE76718)、1組基因芯片數(shù)據(jù)(GSE51472)及1組miRNA芯片數(shù)據(jù)(GSE87885)。GSE55492與GSE76718分別包括10例健康人及9例CAVD患者、8例健康人及9例CAVD患者的主動脈瓣樣本。GSE51472包括5例健康人及5例CAVD患者的主動脈瓣樣本。GSE87885包括3例健康人及2例CAVD患者的主動脈瓣樣本。研究的分析流程詳見圖1。

圖1 研究分析流程圖
2.基因差異表達分析:對于轉(zhuǎn)錄組測序數(shù)據(jù),使用軟件Bowtie2(2.1.0)和HISAT2(2.1.0)將RNA-Seq讀序與人類基因組數(shù)據(jù)庫(UCSC hg19)進行比對,并使用HTSeq(0.11.2)進行基因注釋并統(tǒng)計每個基因的讀序數(shù),最后通過R語言中的DESeq2程序包對差異基因進行統(tǒng)計分析。對于基因芯片數(shù)據(jù),利用R語言中GEOquery程序包獲得基因表達矩陣,并使用limma分析獲得差異基因。定義每個數(shù)據(jù)集中利用Benjamini-Hochberg(B-H)法校正后的P<0.05,且|log2(變化倍數(shù))|>1的基因為差異基因,并對2個及以上的數(shù)據(jù)集中的差異基因進行后續(xù)分析。
3.主成分分析(principal component analysis,PCA):利用R中的mixOmics包,對3個數(shù)據(jù)集中的差異基因進行多變量分析并進行可視化展示。
4.差異基因聚類:利用MetaCore數(shù)據(jù)庫(Clarivate Analytics, https:∥portal.genego.com/)對差異基因進行聚類分析,并定義錯誤發(fā)現(xiàn)率(false discovery rate, FDR)<0.05的生物學(xué)過程/通路為顯著性富集。利用Cytoscape的Enrichment map對排名前300的生物學(xué)過程進行了可視化分析。
5.miRNA差異表達分析:3例健康者miRNA豐度的平均值作為對照,利用R中的DEGSeq包分別將2例患者的miRNA豐度與對照比較,并定義B-H法校正后的P<0.1的miRNA為差異表達的miRNA,隨后對2例患者的差異miRNA取交集。
6.miRNA與差異基因調(diào)控網(wǎng)絡(luò):在miRTarBase網(wǎng)站(http:∥mirtarbase.cuhk.edu.cn/php/index.php)上檢索miRNA與基因的靶向關(guān)系,利用Cytoscape對miRNA-基因調(diào)控網(wǎng)絡(luò)進行可視化分析。
結(jié) 果
1. 差異基因篩選及PCA分析:研究分析了3個基因表達數(shù)據(jù)集中,CAVD與健康組比較顯著差異表達的基因(圖2A~C),并用PCA進行降維分析,以比較CAVD與健康組之間基因表達的差異,3個數(shù)據(jù)集中,CAVD組與健康組之間差異明顯(圖2D~F)。
2.差異基因聚類:為進一步探尋差異基因的功能,研究進行了Gene Ontology的生物學(xué)過程與分子通路聚類分析。從生物學(xué)過程網(wǎng)絡(luò)中可以看出,上下調(diào)基因均可集中在對外界刺激的反應(yīng)上(圖3A和B),另外,上調(diào)基因還集中于生物高分子代謝、免疫細胞激活(圖3A),而下調(diào)基因集中于心肌細胞發(fā)育及離子穩(wěn)態(tài)(圖3B)。分子通路聚類顯示,上調(diào)基因(表1)可聚類到類風(fēng)濕關(guān)節(jié)炎、前列腺癌骨轉(zhuǎn)移、T細胞共信號受體、腫瘤浸潤B細胞在抗腫瘤免疫中的作用以及肥胖、2型糖尿病和X型代謝綜合征的脂肪組織和肝臟炎癥中的趨化因子通路,下調(diào)基因(表2)可聚類到褐色脂肪細胞分化中的β腎上腺素能受體、環(huán)-AMP介導(dǎo)的β腎上腺素能受體信號、心肌肥厚中的NF-AT信號、心肌細胞中內(nèi)皮型一氧化氮合酶(eNOS)活性調(diào)節(jié)及AVP在調(diào)節(jié)水通道蛋白2和腎臟水重吸收中的作用通路,其中β腎上腺素能受體通路為β1腎上腺素能受體(ADRA2C)相關(guān)通路。值得注意的是,多個MHC Ⅱ類分子相關(guān)基因(HLA-DOB、HLA-DRA、HLA-DQB1、HLA-DRB1、HLA-DRB5)表達升高,與之前研究相一致。而肌腱蛋白相關(guān)基因(TNN、TNNC1)、肌鈣蛋白(TNNT2)及肌球蛋白(MYH7、MYH11、MYH14)表達降低。
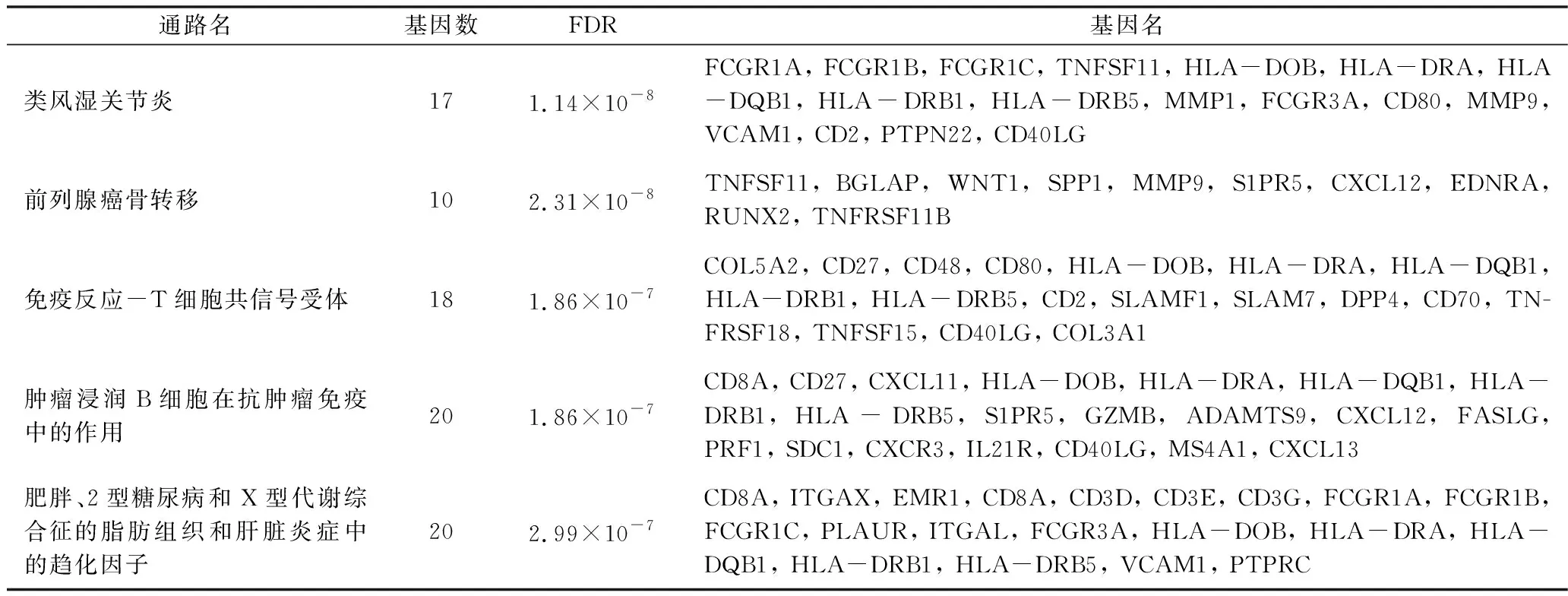
表1 上調(diào)基因聚類的分子通路
3. miRNA-差異基因調(diào)控網(wǎng)絡(luò):通過對3例健康人和2例CAVD患者的miRNA芯片進行差異分析,得到了87條下調(diào)和23條上調(diào)的miRNA。研究分析了miRNA與表1及表2中顯著富集基因的相互作用,并分為下調(diào)miRNA-上調(diào)基因與上調(diào)miRNA-下調(diào)基因兩種相互作用模式(圖4)。在下調(diào)miRNA-上調(diào)基因模式中,HLA-DRB1和HLA-DRB5可被3個miRNA (hsa-miR-1250-3p、hsa-miR-141-5p、hsa-miR-211-5p)調(diào)控,而VCAM1可被5個miRNA (hsa-miR-4677-5p、hsa-miR-506-5p、hsa-miR-548ah-3p、hsa-miR-6511a-5p、hsa-miR-4683)調(diào)控。在上調(diào)miRNA-下調(diào)基因模式中,HAND2與hsa-miR-6081、ACTC1與hsa-miR-4793-5p存在相互作用。

表2 下調(diào)基因聚類的分子通路
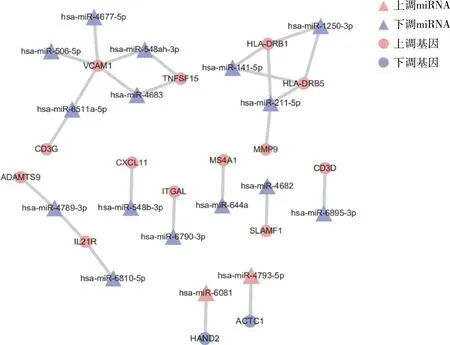
圖4 CAVD miRNA與靶基因相互作用網(wǎng)絡(luò)圖
4.CAVD相關(guān)原因分析:為探究不同病因引起CAVD之間的聯(lián)系,檢索了多種病因相關(guān)基因的變化,發(fā)現(xiàn)與計算出的DEGs存在交集(表3)。

表3 CAVD病因的相關(guān)基因變化[8~11]
討 論
關(guān)于CAVD的研究存在一定局限性,如單個數(shù)據(jù)集的樣本量小、整合多個數(shù)據(jù)集時方法不正確以及缺少miRNA-mRNA的相關(guān)性研究。本研究在GEO數(shù)據(jù)庫上挖掘了CAVD相關(guān)的基因表達及miRNA芯片數(shù)據(jù)。由于基因表達不同平臺、不同批次之間存在差異,筆者采用在不同數(shù)據(jù)集中分別計算差異基因并取交集的方式,找到了475個上調(diào)基因和400個下調(diào)基因,以及87條下調(diào)的miRNA和23條上調(diào)的miRNA。
通過對差異基因進行聚類分析,筆者發(fā)現(xiàn)在CAVD患者中,細胞對外界刺激的應(yīng)答發(fā)生紊亂,而與生物高分子代謝及免疫應(yīng)答過程相關(guān)的基因顯著上調(diào),與心肌細胞發(fā)育及離子穩(wěn)態(tài)相關(guān)的基因顯著下調(diào)。分子通路的聚類結(jié)果與生物學(xué)過程一致,上調(diào)基因聚類排名前5的通路均與免疫過程有關(guān),5個MHC Ⅱ類分子相關(guān)基因(HLA-DOB、HLA-DRA、HLA-DQB1、HLA-DRB1、HLA-DRB5)參與了其中4個分子通路。先前的研究表明,CAVD的發(fā)生與發(fā)展過程中會出現(xiàn)炎性反應(yīng),而T細胞與巨噬細胞則參與了早期的主動脈損傷[12~14]。這證明了本研究分析的準確性。另外在CAVD患者中,β1腎上腺素能受體通路及NF-AT、eNOS信號通路相關(guān)基因表達下降,其中,β1腎上腺素能受體通路對心肌功能產(chǎn)生正性作用,可使心臟射血速度加快、心率上升,其表達下調(diào)可能是CAVD患者心臟功能受損的原因之一。NF-AT信號通路功能的損傷可能對CAVD的疾病進程起正性作用[15]。eNOS已被證明是CAVD的分子標志物[16]。在eNOS信號通路中,eNOS上游的抑制基因CAV3的下調(diào),是導(dǎo)致eNOS水平上升的原因之一。另外,肌腱蛋白、肌鈣蛋白及肌球蛋白基因均發(fā)生顯著下調(diào),其中肌腱蛋白是一種在胚胎形成和器官發(fā)育過程中高度表達的細胞外基質(zhì)糖蛋白,而肌鈣蛋白和肌球蛋白都參與心肌細胞的收縮過程,這些關(guān)鍵基因的下調(diào)可能是CAVD的致病機制之一。
為探究CAVD中miRNA與基因表達之間的關(guān)系,筆者在miRTarBase上查找了差異miRNA與差異基因的靶向關(guān)系,分為下調(diào)miRNA-上調(diào)基因與上調(diào)miRNA-下調(diào)基因兩種相互作用模式。在下調(diào)miRNA-上調(diào)基因作用模式中,hsa-miR-1250-3p、hsa-miR-141-5p及hsa-miR-211-5p可以靶向HLA-DRB1和HLA-DRB5,這3條miRNA表達量的降低可能是兩種MHC Ⅱ類分子表達量升高的原因之一。而VCAM1可同時被hsa-miR-4677-5p、hsa-miR-506-5p、hsa-miR-548ah-3p、hsa-miR-6511a-5p及hsa-miR-4683靶向調(diào)控。研究表明,VCAM1高表達會導(dǎo)致主動脈瓣上皮細胞的鈣化,并參與白細胞的趨附[17,18]。這5條miRNA表達的紊亂可能促進CAVD的發(fā)生。在上調(diào)miRNA-下調(diào)基因作用模式中,hsa-miR-6081可靶向HAND2,先前研究表明,HAND2功能損傷會導(dǎo)致先天性心臟缺陷[19]。另外,hsa-miR-4793-5p可靶向ACTC1,ACTC1表達降低可能通過誘導(dǎo)心肌細胞凋亡導(dǎo)致先天性心臟病[20]。目前尚無研究表明這些miRNA的變化與CAVD的關(guān)系,通過有效手段干預(yù)miRNA的作用或表達,可能是預(yù)防及治療CAVD的有效措施之一。
CAVD病因復(fù)雜,常見病因有主動脈瓣狹窄、風(fēng)濕性瓣膜病、二瓣畸形以及動脈粥樣硬化等。研究從差異基因的角度分析了不同病因引起CAVD的聯(lián)系,發(fā)現(xiàn)多種病因的相關(guān)基因均發(fā)生了顯著變化。因此,對于不同病因引起的CAVD,都有可能通過干預(yù)差異基因或差異miRNA的方式改善患者的臨床癥狀,這需要進一步的實驗研究。
綜上所述,本研究采用更嚴格的統(tǒng)計學(xué)分析方法,闡釋了CAVD的基因表達譜及miRNA表達譜,找到了關(guān)鍵的生物學(xué)過程、分子通路及相關(guān)基因,并進一步闡明了miRNA-基因表達的相互作用網(wǎng)絡(luò)。本研究利用生物信息學(xué)的方法,為CAVD的分子機制提供了補充,并為干預(yù)和治療方法提供了新的方向。未來還需要擴大患者的樣本量,并進行進一步的實驗驗證。

