單增李斯特菌內化素家族蛋白的研究進展
藍 瑩,陳綿綿,程昌勇,宋厚輝
(浙江農林大學 動物科技學院 動物醫學院 浙江省畜禽綠色生態健康養殖應用技術研究重點實驗室 動物健康互聯網檢測技術浙江省工程實驗室,浙江 杭州 311300)
1 單增李斯特菌概述
單核細胞增多性李斯特菌(Listeriamonocytogenes),簡稱單增李斯特菌,是一種重要的食源性病原微生物,廣泛分布于自然界中,包括土壤和水源等環境[1]。單增李斯特菌可以穿過胃腸道屏障進入血液,引起胃腸炎、敗血癥和腦膜炎等病癥,孕婦感染時,單增李斯特菌可以穿過胎盤屏障從而導致流產、早產以及胎兒畸形[2-3]。全世界范圍內多次發生人感染單增李斯特菌而死亡的案例,該菌感染后死亡率可以達到30%[4]。近10年來,在我國22個省份的759個案例中死亡率達到18%,在新生兒中的致死率更高達73%[5]。因此,單增李斯特菌致病機制的研究對于該病原的防制具有重要意義。
2 單增李斯特菌感染機制
單增李斯特菌能夠感染多種宿主,包括人、小鼠、兔子和鳥類等多種生物[6]。單增李斯特菌能夠感染吞噬細胞和非吞噬細胞,并在細胞內增殖。單增李斯特菌感染吞噬細胞時,吞噬細胞被激活,而后通過“Trojan horse”效應將細菌送到不同的組織和器官[7-8]。單增李斯特菌感染宿主非吞噬細胞時,毒力主要受PrfA調控,也會受到SigB調控的影響[9]。單增李斯特菌主要毒力基因(prfA-plcA-hly-ActA-plcB)組成的毒力島(LIPI-I)[10]和內化素A、內化素B(InlA、InlB)感染宿主非吞噬細胞時發揮著主要作用[11]。單增李斯特菌利用其表面蛋白InlA和InlB分別與宿主細胞表面的E-鈣黏蛋白(E-cadherin)和肝細胞生長因子(Met)黏附結合后通過胞吞方式侵入宿主細胞[12]。進入宿主細胞的細菌被細胞膜包裹形成吞噬體,此時細菌分泌溶血素LLO,并協同磷脂酶A(PlcA)和磷脂酶B(PlcB)溶解吞噬泡,成功逃逸到細胞質[13]。單增李斯特菌在胞質內利用細胞營養進行增殖,同時表面蛋白ActA募集肌動蛋白絲actin形成“彗星狀”尾部[14],在細胞質內運動并在細胞膜上形成突起,這使單增李斯特菌完美逃脫先天免疫從而引起鄰近細胞的持續性感染[15]。
3 內化素家族蛋白分類
內化素家族蛋白在單增李斯特菌侵襲宿主非吞噬細胞的過程中發揮重要的作用[16]。除了InlA、InlB、InlC、InlP和InlK外,大部分內化素蛋白的功能尚不清楚(表1)[17]。單增李斯特菌內化素家族蛋白是一組富含亮氨酸重復區域(LRR),N端含有信號肽的蛋白質[16]。LRR是蛋白互作的多功能結合基序,存在于各種參與信號轉導和細胞黏附過程的蛋白[18]。根據內化素蛋白的C末端一級結構的不同可將其分為3類:含有LPXTG結構的內化素、含有GW/WxL結構的內化素和分泌型內化素[19]。
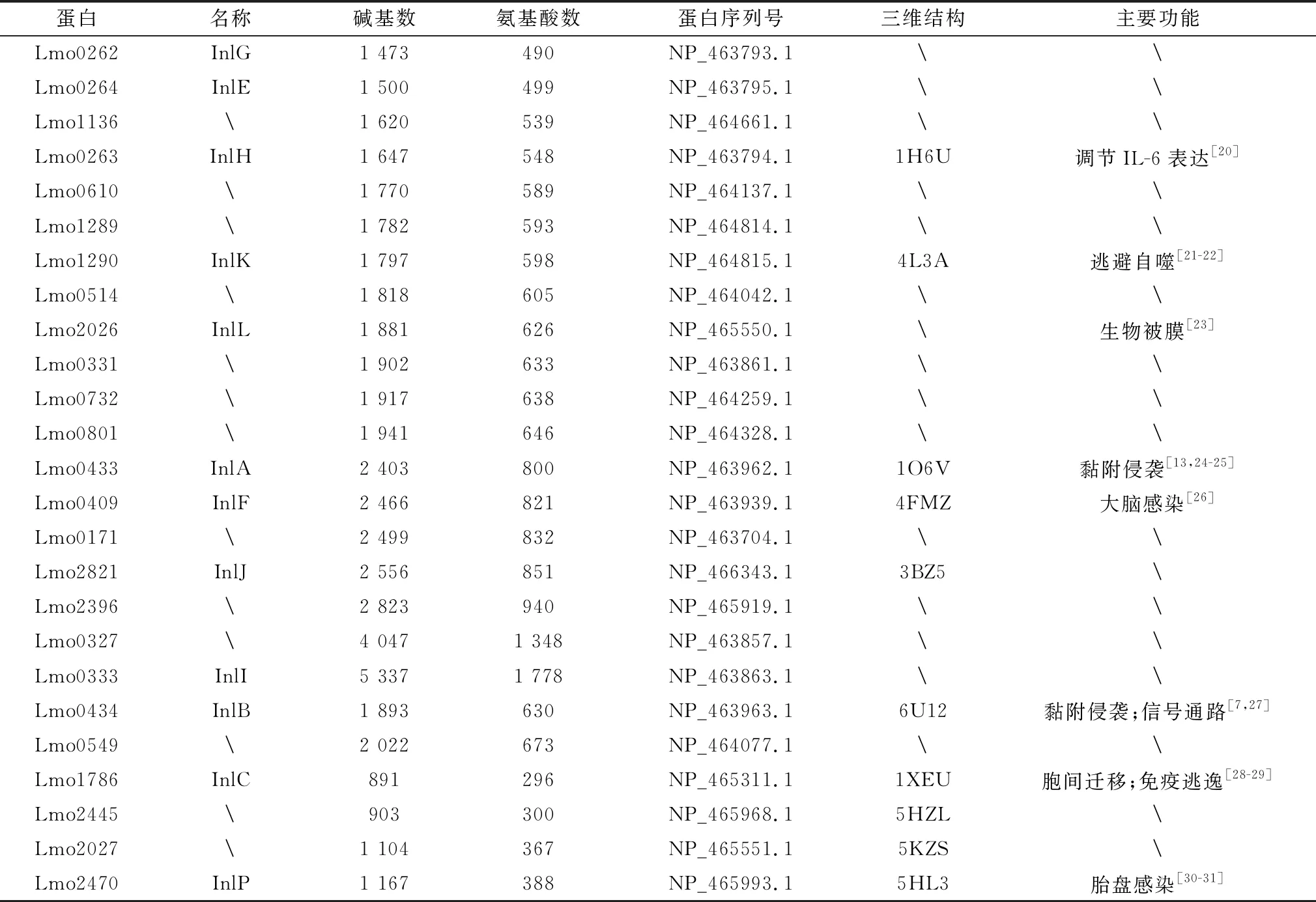
表1 內化素家族蛋白研究進展
3.1 含有LPXTG結構的內化素含有LPXTG結構的內化素蛋白一共有19種,包括InlA、InlK、InlE、InlF、InlG、InlH、InlI、InlJ、InlL、Lmo1136、Lm-o0610、Lmo1289、Lmo0514、Lmo0331、Lmo0732、Lmo0801、Lmo0171、Lmo2396和Lmo0327(圖1)。這類內化素C末端由LPXTG結構、疏水基團和帶正電荷的尾部組成分選信號[16]。單增李斯特菌有2種分選酶:SrtA和SrtB,與InlA的LPXTG基序發揮作用的主要是SrtA,SrtA識別并裂解含有LPXTG基序的蛋白底物的分選信號,裂解產生的蘇氨酸羧基與肽聚糖的前體脂質Ⅱ連接,再通過生物合成機制連接在細菌表面[32]。InlH/J/K也可以被StrA識別,并以共價鍵的形式結合于肽聚糖上,其他含有LPXTG結構的內化素目前還不清楚具體是通過什么方式固定在細胞壁上[33]。
3.2 含有GW/WxL結構的內化素含有GW/WxL結構的內化素有2種:InlB和Lmo0549(圖1),這2種內化素都通過非共價鍵的形式結合在細菌細胞壁[34-35]。InlB有3個以甘氨酸和色氨酸為起始的含80個氨基酸重復序列的GW結構[35],GW結構與磷壁酸結合,并且磷壁酸的糖基化作用將蛋白更好地錨定于細菌細胞壁表面[36]。除了InlB,單增李斯特菌還有其他8個包含有GW結構的蛋白,其中自溶素Ami和Auto也是與細胞黏附侵襲相關的蛋白[35,37]。Lmo0549蛋白是含有WxL結構的內化素[38]。WxL結構屬于Csc家族,單增李斯特菌基因組中有2組Csc基因簇,含有WxL結構的蛋白有4個,但只有Lmo0549含有LRR區并被認為是內化素家族蛋白[39]。含有WxL結構的蛋白通過與肽聚糖相互作用結合在革蘭陽性菌的細胞壁上[38]。其他菌種,如糞腸球菌中,缺失含有WxL結構的內化素家族蛋白ElrA能使細菌在巨噬細胞以及小鼠模型中的定殖能力顯著下降[40]。但是目前Lmo0549結構和功能尚不清楚,含有WxL結構蛋白的共性及特性還需要繼續研究。
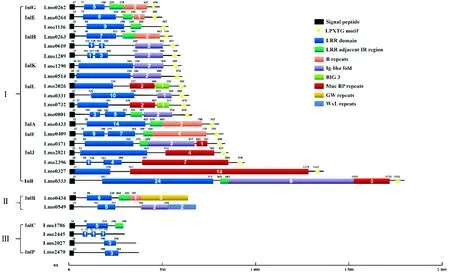
Ⅰ.含有LPXTG結構的內化素蛋白;Ⅱ.含有GW/WxL結構的內化素蛋白;Ⅲ.分泌型內化素蛋白
3.3 分泌型內化素InlC在細胞上無法錨定,是分泌型內化素的一種,其對細菌的黏附侵襲來說不是必要的,但是能夠促進單增李斯特菌侵襲鄰近細胞時細胞膜突起的形成以及幫助細菌逃避宿主先天免疫反應[28,41]。InlP、Lmo2027和Lmo2445也被認為是分泌型內化素(圖1)。最近報道InlP對促進單增李斯特菌進入胎盤屏障有重要作用[31]。
4 內化素家族蛋白的功能
4.1 內化素家族蛋白在黏附侵襲中的作用InlA蛋白是內化素家族的重要成員,在李斯特菌黏附侵襲進入細胞過程中起著重要的作用[42],InlA是第1個被發現含有LRR序列和LPXTG結構的表面蛋白[43]。當前體蛋白在細胞質中合成之后,N端在信號肽的作用下分泌出胞外,然后信號肽被切除,而C端由于有疏水區域和帶正電荷的尾部而被留在細胞膜中,這時分選基序LPXTG被分選酶共價結合到細胞壁上[44],LRR序列與宿主細胞的受體E-鈣黏蛋白胞外結構域中的第16位脯氨酸特異性結合,介導細菌進入上皮細胞的內化作用(圖2)[19,24-45]。E-鈣黏蛋白主要在胃腸道上皮細胞中存在,比如杯狀細胞[25,46]。其他鈣黏蛋白,如N-鈣黏蛋白被發現在許多惡性腫瘤中異常表達,對癌癥的靶向治療的提供新的認識[47]。E-鈣黏蛋白作為細胞受體與InlA結合,然后脂質筏使E-鈣黏蛋白聚集,胞質中E-鈣黏蛋白尾部被宿主激酶Src磷酸化和泛素連接酶Hakai泛素化,從而調節肌動蛋白成核劑Arp2/3招募肌動蛋白使細胞細胞膜結構改變[48-49]。這種“觸發機制”引起的吞噬泡促使單增李斯特菌通過胃腸道屏障甚至胎盤屏障[50]。研究發現李斯特菌黏附蛋白LAP能夠介導細菌侵入腸道屏障,并且這可能給InlA介導細菌侵入腸道屏障的提供一個重要條件[51]。
GW型內化素InlB在單增李斯特菌的感染中也發揮著重要作用,能夠幫助單增李斯特菌侵入大部分細胞,包括肝細胞和非上皮細胞[44]。GW基序以非共價鍵的形式作用于細菌的細胞壁從而將InlB錨定在細胞壁上。InlB能夠與宿主細胞表面的糖胺聚糖(GAGs)、補體成分Clq受體(gClqR)和Met等結合并介導李斯特菌入侵宿主細胞[52-54]。InlB通過LRR區域的凹面與Met結合,引起Met瞬時磷酸化[55],招募并磷酸化接頭蛋白Cbl、Gab1、Shc和CrkⅡ,然后激活PI3激酶(PI3K)[56]。接頭蛋白Cbl也顯示泛素連接酶活性,可促進Met泛素化,從而調節Arp2/3、肌動蛋白解聚因子cofilin、LIM激酶以及GTPase Rac1參與InlB依賴途徑所需的細胞骨架重排,進而促進InlB依賴的單增李斯特菌進入靶細胞[57-58]。InlB從細菌表面脫離后,其C端GW結構與受體GAGs和gClqR相互作用,N端LRR與Met互作并導致細胞質中Met的尾部被泛素化修飾(圖2),展示了細胞入侵過程中InlB的氨基和羧基末端結構域之間的協同作用[7,59]。
胎盤滋養層細胞能夠表達E-鈣黏蛋白和Met,因此認為InlA和InlB對細菌跨過胎盤的屏障發揮作用[60]。在胎盤組織中,PI3K不能自主激活,而InlA介導的內化作用需要PI3K活性,所以InlA需要InlB激活PI3K使單增李斯特菌進入并感染胎盤[60],但是InlA/B對細菌通過胎盤屏障的作用一直存在爭議[61]。InlA能夠介導單增李斯特菌入侵BeWo細胞系和人胎盤原代滋養細胞(PHTs),但是在懷孕的豚鼠和能夠正常表達E-鈣黏蛋白的轉基因小鼠中InlA/B介導細菌侵入胎盤作用不顯著[62-63]。E-鈣黏蛋白在人胎盤合胞滋養細胞頂端層表面表達水平低,且母體血液對細菌有高度的抵抗力,所以細菌不能通過浸泡于母體血液的合胞滋養細胞侵入胎盤屏障[64]。而絨毛外滋養細胞能夠大量表達E-鈣黏蛋白,是感染的主要突破口,細菌從絨毛外滋養細胞突破,隨后感染胎盤[65]。
近來發現InlF在單增李斯特菌感染細胞、組織特別是通過血腦屏障發揮關鍵作用。Rho-相關蛋白激酶(ROCKs)抑制劑被發現能增強細菌對細胞系的黏附侵襲和組織定殖能力,在inlF缺失情況下,其介導侵襲小鼠細胞系和小鼠器官的定殖能力下降;并且感染了不表達InlF蛋白突變菌的小鼠,其大腦定殖的細菌數量比野生菌要顯著減少,但在其他臟器中無顯著變化,說明InlF對細菌定殖在大腦具有特殊作用[26,66]。波形蛋白在間充質細胞和各種腦細胞表面中廣泛表達,能夠調節細胞黏附、細胞外遷移和細胞信號傳導[67-68]。InlF能與波形蛋白互作,介導單增李斯特菌與大腦內皮細胞的黏附,給細菌感染大腦提供了必要條件,在波形蛋白缺失情況下,單增李斯特菌在大腦定殖能力顯著受損[26]。這表明細胞表面波形蛋白與InlF互作對細菌在大腦定殖的重要性。除了InlF,InlA和InlB在侵入血腦屏障時也可能發揮作用,在感染人上皮脈絡叢乳頭狀瘤(HIBCPP)和腦微血管內皮細胞系(HBMEC)時,inlA和inlB缺失株黏附侵襲能力顯著下降;然而有一些內化素基因表現出相反的作用,當inlGHE基因簇中某一基因缺失時,InlB介導的細菌對HBMEC的黏附侵襲能力增強[69-71]。
4.2 內化素家族蛋白在免疫中的作用InlB與Met相互作用除了在細菌黏附侵襲中起到關鍵作用,還刺激宿主的PI3K、AKT、MAPK(MAP激酶)等多個信號通路的激活[72]。在小鼠巨噬細胞中,PI3K和AKT可通過IKKα激活NF-κB[73-74]。 InlB還可通過其誘導激活的PI3K/AKT通路,通過宿主IPO7(輸入蛋白7)和PPM1A/PPM1B(蛋白磷酸酶1A/1B)在S25(絲氨酸25)處的去磷酸化,使SIRT2(去乙酰化酶Sirtuin 2)與染色質結合并觸發組蛋白H3在賴氨酸18(H3K18)處的特異性去乙酰化(圖2)[75-76]。H3K18去乙酰化使SIRT2在基因啟動子上富集,并引起宿主基因轉錄被抑制,如在調節免疫反應中發揮作用(lef1和cxcl12)[75]。
當單增李斯特菌感染細胞時,細胞膜上TLR(Toll樣受體)識別信號,再通過MyD88(骨髓分化初級響應因子88)、IRAK(IL-1R相關激酶)、TRAF6(TNF受體相關因子6) 和TAK1(TGFβ-活化激酶1)將信號傳播到IκB激酶(IKKα/IKKβ)組成的NEMO(NF-κB基本調制器),激活NF-κB并將其轉移到細胞核,啟動促炎細胞因子和其他基因轉錄參與免疫反應[77]。當單增李斯特菌成功在宿主細胞內定殖時,InlC能夠大量表達,幫助逃逸宿主的先天性免疫[78]。IKKα是IκB激酶復合物的1個亞基,InlC可與IKKα相互作用使IκB磷酸化減弱并延遲其降解,從而削弱NF-κB移動至細胞核和抑制NF-κB調控基因的激活,因此宿主的先天性免疫反應減弱[28](圖2)。InlC第224位的賴氨酸被泛素化修飾后,能夠與警報蛋白S100A9互作,S100A9蛋白是先天性免疫反應和炎癥過程的關鍵蛋白。在小鼠試驗中,接種表達被泛素化修飾的InlC突變菌后中性粒細胞產生的活性氧增加,并限制李斯特菌感染,因此泛素化修飾的InlC和與S100A9蛋白的互作可使宿主免疫應答能力增強[29]。
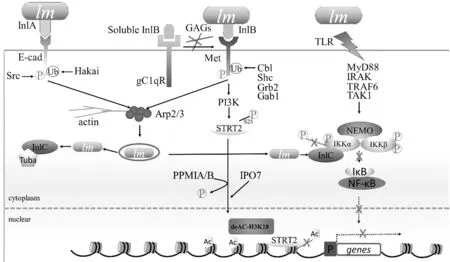
圖2 幾種內化素蛋白的作用示意圖[75-77,82-83]
InlK和InlA一樣是擁有LPXTG結構的表面蛋白,被StrA識別而固定在細胞壁上。在體外培養環境中InlK很少表達,但是當單增李斯特菌在體內環境時,InlK表達上調,并與穹窿蛋白MVP互作[21,79]。已知ActA能夠逃避自噬感染并臨近細胞[80],InlK也能幫助單增李斯特菌逃避宿主自噬,但其方式和ActA不同,在一定程度上,2種逃避自噬的方法存在協同作用[21]。當ActA和InlK在體內同時表達時,雖然InlK先招募MVP于細菌表面,但是Actin會取代MVP并聚集在細胞表面,使李斯特菌發揮ActA介導的逃避自噬作用[80]。但是當ActA蛋白缺失時,InlK和MVP互作,使MVP聚集在細菌表面,幫助細菌逃避自噬[22]。
InlH蛋白受到sigB調控,在外界應激壓力作用下,InlH能在單增李斯特菌表面大量聚集[81]。InlH的失活會增加感染小鼠肝臟和脾臟中IL-6(白介素-6)的產生。但是在體外,InlH不調節巨噬細胞中IL-6的分泌。由此猜測InlH可能在其他分泌IL-6的免疫細胞中發揮作用,通過緩和炎癥反應促進病原體在組織中的生存[20]。
4.3 內化素家族蛋白在細菌遷移中的作用單增李斯特菌通過InlA/B內化作用進入細胞,再以肌動蛋白為基礎在細胞和組織中傳播。InlC可以和哺乳動物接頭蛋白Tuba互作促進單增李斯特菌在細胞間的感染[84]。Tuba是有多功能域的支架蛋白,能與其效應因子N-WASP和CDC42形成張力復合體,InlC競爭性抑制N-WASP和Tuba的羧基末端Src同源性3(SH3)結構域之間的相互作用,因此細胞連接處皮質張力減弱,單增李斯特菌突起的形成能力加強從而促進細菌在細胞間的傳播[85]。InlC還能和Exo70互作,介導Exo70在細菌突起中的聚集[41]。Exo70是宿主細胞外囊復合體的組成蛋白之一,外囊復合體能夠直接促進突起的延長。Exo70能在野生單增李斯特菌突起中大量聚集,但是在inlC缺失菌株的突起中顯著減少,并使細菌細胞間感染能力下降[41]。
近年來發現InlP是胎盤感染的關鍵毒力因子。InlP能夠極大地促進單增李斯特菌感染胎盤,在人原代胎盤器官培養環境和滋養細胞內inlP基因缺失菌株的生長能力減弱[31]。研究發現InlP能夠和afadin相互作用,afadin和能與InlC特異性互作的Tube蛋白都是細胞間連接相關蛋白,但是與InlC促進單增李斯特菌在細胞間單層水平感染不同,InlP與afadin互作引起細菌在胎盤的垂直感染[30]。單增李斯特菌inlP缺失株不能使Actin聚集,在細胞膜上無法形成突起,因此不能感染臨近的細胞,類似的情況在單增李斯特菌缺失掉InlP的LRR5 結構時可以觀察到,說明InlP的LRR5結構為其與afadin相互作用的關鍵位點[30]。這種情況可能是InlP-afadin相互作用調節了宿主細胞基面組織的性質,或者與基底膜相互作用,這種活性促進了細菌在細胞基底膜形成以Actin為基礎的突起,并垂直感染胎盤組織[30]。
4.4 內化素家族蛋白在生物被膜形成中的作用細菌生物被膜是由細菌微生物及其表達產物構成的附著于物體表面的結構,它能夠更好地幫助細菌抵御環境中溫度、pH值和鹽離子濃度等變化帶來的各種壓力[86]。例如,在生物被膜中的單增李斯特菌對消毒劑和食品防腐劑等的耐受能力顯著增強[87]。一些單增李斯特菌蛋白已被證實會對其生物被膜形成產生影響,如鞭毛蛋白、PrfA和InlA/B等部分內化素家族蛋白[88-89];單增李斯特菌中InlL和InlK蛋白不表達也會減弱其生物被膜的形成能力[23,90]。在生物被膜的形成過程中不同內化素發揮不同功能,在生物被膜形成初始階段,InlA/B能夠幫助單增李斯特菌在物體表面的附著,從而促進生物被膜形成[88],而InlC在成熟的生物被膜中大量表達[91]。
4.5 內化素家族蛋白在細菌運動性中的作用單增李斯特菌的運動性能促進其對宿主細胞的侵襲[92],并在小鼠模型中增加其毒力[93]。細菌的運動性由菌體表面鞭毛提供,鞭毛是分布在菌體外表面的絲狀蛋白復合物,鞭毛蛋白結構基因flaA的轉錄與鞭毛蛋白的存在直接相關[7,16,94]。在30℃培養的inlA缺失株入侵Caco-2細胞的能力比37℃時強,說明鞭毛蛋白在侵入宿主細胞時可能起到重要作用;并且inlA/flaA雙基因缺失株比inlA、flaA單基因缺失株在30和37℃時對Caco-2的侵襲能力減弱,說明 InlA和FlaA蛋白在單增李斯特菌侵襲作用中存在顯著的協同作用[95]。
5 展望
單增李斯特菌內化素家族蛋白在單增李斯特菌致病性中發揮著重要的作用,但是除了InlA和InlB的致病機制已經被詳盡報道外,其他內化素家族蛋白成員在單增李斯特菌致病機制中的實際發揮出的作用仍遠未被了解[71]。雖然內化素的主要功能是在幫助單增李斯特菌感染宿主細胞的黏附侵襲過程中發揮作用,例如InlA和InlB;但是內化素在其他功能方面也發揮著不同的作用,比如InlK,其和InlA兩者在結構上同為含有 LPXTG基序的表面蛋白,但是在細菌的致病機制中發揮的功能大不相同,前者的主要作用是幫助細菌逃避自噬,而后者主要功能為黏附侵襲。因此,我們還需要對內化素家族蛋白進行更多的探索,以期進一步了解內化素在單增李斯特菌致病性中的作用。

