小鼠神經細胞中胱硫醚β合成酶催化生成的H2S對腦微血管內皮細胞增殖、遷移的影響及與VEGFR2的關系
陳佳妮,陳志武
(安徽醫科大學基礎醫學院藥理教研室)
血管內皮生長因子(vascular endothelial growth factor,VEGF),是一種重要的血管生成調節因子,可增強內皮細胞有絲分裂、增殖和遷移及側支血管的形成,在生理和病理性的血管生成中發揮著基本作用[1]。VEGF作用是通過其特異的受體血管內皮生長因子受體(vascular endothelial growth factor receptor,VEGFR)來發揮的。VEGFR分為VEGFR1、VEGFR2和VEGFR33個亞型,其中,VEGFR2主要參與內皮細胞有絲分裂的發生,介導了VEGF在內皮細胞中的生物學效應[2]。
缺血后神經損傷修復過程中,腦血管再生直接關系到神經組織損傷的發展和修復。在血管再生過程中,血管內皮細胞的遷移與增殖是十分關鍵的環節[3]。內源性硫化氫(hydrogen sulfide,H2S)是一種氣態信號分子,在機體的生理和病理過程中發揮著重要的作用[4],主要由胱硫醚β合成酶(cystathionine-β-synthetase,CBS)和胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)催化L-半胱氨酸(L-cysteine,L-Cys)來生成。CBS和CSE有組織分布特異性,CBS分布在神經細胞中,而CSE分布在血管組織中[5]。因此,神經細胞主要通過CBS催化產生H2S。腦組織中的H2S參與了海馬長時程增強、神經元保護等功能的調節,發揮了一種非典型神經遞質的作用[6]。但內源性H2S也是一種重要的血管活性物質,參與血管的生理和病理過程。有研究表明H2S可促進人臍靜脈內皮細胞的增殖和遷移[7],并有研究[8]顯示H2S可激活VEGFR2,siRNA介導的VEGFR2基因敲低可抑制H2S誘導的人血管內皮細胞的遷移。但是由腦細胞產生的神經源性H2S是否對腦血管內皮細胞的遷移與增殖產生一定的影響呢?尚未見這方面的研究報道。因此,本文在體外觀察了神經元CBS催化產生的H2S對小鼠腦微血管內皮細胞的增殖、遷移的影響,并初步探討了其作用與VEGFR2的關系。
1 材料與方法
1.1 細胞小鼠海馬神經元(HT22細胞株)、人臍靜脈內皮細胞(HUVEC細胞株),均購自上海名勁生物科技有限公司;小鼠腦微血管細胞(bEnd.3細胞株),購自湖南豐暉生物科技有限公司。
1.2 主要試劑硫氫化鈉NaHS購自美國Sigma公司;司馬沙尼 (semaxinib,SU5416),購自美國MCE公司;重組小鼠血管內皮生長因子VEGFA/VEGF164購自美國Abbkine公司;胎牛血清FBS購自美國Gibco公司;高糖DMEM和RPMI 1640培養基購自美國Hyclone公司;CCK-8檢測試劑盒購自美國Glpbio公司;4%多聚甲醛,0.1%結晶紫水溶液購自Biosharp公司;H2S含量檢測試劑盒購自Solarbio公司;24孔Transwell小室(直徑6.5 mm;孔徑:8 μm;ref.3422)和6孔Transwell小室(直徑24 mm;孔徑:0.4 μm;ref.3450),購自美國Corning公司;L-Cys購自Macklin公司;氨基氧乙酸AOAA購自源葉生物公司;NaHS于使用前用生理鹽溶液PBS溶解配制,并避光保存。
1.3 方法
1.3.1細胞培養 在37 ℃的5% CO2培養箱中,HUVEC細胞用含有10%FBS和1%青霉素-鏈霉素的RPMI 1640培養基培養,bEnd.3細胞和HT22細胞分別用含有10%FBS和1%青霉素-鏈霉素的高糖DMEM培養基培養,待細胞融合度達90%時進行傳代培養,并分別加入測試藥進行試驗。
1.3.2HT22細胞和bEnd.3細胞共培養 在六孔板的Transwell小室的上室接種內皮細胞(bEnd.3細胞),下室接種神經細胞(HT22細胞)置入37 ℃的5% CO2培養箱中進行共培養。實驗分為對照組、AOAA組(1 mmol·L-1)、SU5416組(10 μmol·L-1)、L-Cys組(100 μmol·L-1)、L-Cys+AOAA組、L-Cys+SU5416組,各組分別加入溶媒或相應的測試藥物孵育24 h后,進行各種實驗指標的檢測。
1.3.3CCK-8增殖試劑盒檢測增殖 在培養的HUVEC細胞或bEnd.3細胞培養孔中,分別加入不同濃度的NaHS、SU5416及陽性對照藥VEGF164孵育一定時間后,棄除培養基,各孔細胞中分別加入100 μL新鮮培養基和10 μL的CCK-8測試液繼續在37 ℃下孵育2 h后,用酶標儀讀取各培養孔在450 nm處的吸光度值(A值),計算細胞增殖率:增殖率/%=(給藥后實驗組A值-空白組A值) / (給藥前實驗組A值-空白組A值)×100%。
1.3.4細胞劃痕實驗 將HUVEC細胞、bEnd.3細胞分別接種到24孔板,當細胞達到100%匯合時,使用無菌的200 μL移液器吸頭在各孔單層細胞中心劃一直線“傷口”,并用無菌PBS洗滌兩次以去除死細胞。然后分別加入不同濃度的NaHS或SU5416或VEGF164以及500 μL含2%FBS的新鮮培養基(RPMI 1640和高糖DMEM)繼續孵育24 h。在倒置顯微鏡下,拍照0、24 h細胞劃痕傷口,并用ImageJ圖像軟件測定傷口面積。
1.3.5Transwell細胞遷移實驗 在Transwell上室中接種100 μL無血清細胞懸液(bEnd.3細胞或HUVEC細胞),實驗分為對照組、SU5416組(10 μmol·L-1)、NaHS組(10-3.5mol·L-1)、NaHS+SU5416處理組、VEGF164組(10 ng·mL-1)、VEGF164+SU5416處理組,下室加入含10% FBS的RPMI 1640和高糖DMEM培養基各500 μL;共培養組在上室接種bEnd.3細胞(100 μL無血清細胞懸液),下室接種HT22細胞。在37 ℃下孵育24 h后,將上室膜在室溫下用4% 多聚甲醛固定30 min,使用棉簽除去殘留在上室膜上表面的未遷移細胞,并用0.1 % 結晶紫染色在室溫下放置15 min。拍照,用Image-Pro Plus軟件計數。
1.3.6內源性H2S含量的甲基藍法檢測 將神經細胞和內皮細胞的共培養基取出250 μL置于離心管中,用250 μL 1% 醋酸鋅和10% 三氯乙酸處理,然后與20 μmol·L-1N,N-二甲基-對苯二胺硫酸鹽和30 μmol·L-1氯化鐵在1.2 mol·L-1鹽酸中混合。在室溫下孵育25 min后,用酶標儀在665 nm處檢測吸光度,并使用空白管調零。根據NaHS標準曲線計算H2S含量。
1.3.7細胞內游離Ca2+濃度的鈣熒光成像法檢測 如前所述在神經細胞和內皮細胞共培養中,在Transwell小室的上室中放置一直徑為14 mm的圓形玻璃蓋玻片,將bEnd.3細胞接種在該蓋玻片上。在37 ℃的5% CO2培養箱中培養一定時間后,在細胞中加入4 μmol·L-1Fluo-8 / AM和0.02% Pluronic F-127,繼續孵育30 min。用正常生理溶液 (NPSS:145 mmol·L-1NaCl,3 mmol·L-1KCl,1 mmol·L-1CaCl2,2 mmol·L-1MgCl2,10 mmol·L-1glucose,10 mmol·L-1HEPES,pH 7.4) 洗滌后,將含有細胞的蓋玻片安裝到Ca2+成像系統記錄室中記錄熒光強度(Fluorescence intensity,FT),用波長Ex/Em=490/520 nm來進行檢測,以FT來反映細胞內游離鈣濃度的變化。
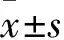
2 結果
2.1 NaHS促進小鼠腦微血管和人臍靜脈內皮細胞的增殖Fig 1A所示,與對照組比較,加入H2S 供體NaHS(1×10-8—1×10-3.5mol·L-1)培養24 h時,小鼠腦微血管內皮細胞bEnd.3細胞和人臍靜脈內皮細胞 HUVEC細胞增殖有明顯的增強(P<0.01)。VEGF164(10 μg·L-1)有類似的增強作用(P<0.01)。結果表明外源性H2S對小鼠腦微血管和人臍靜脈內皮細胞的增殖有明顯的促進作用。Fig 1B與對照組相比,加入1×10-3.5mol·L-1NaHS 1 h時,bEnd.3細胞和HUVEC細胞的增殖作用不明顯,但加入1×10-3.5mol·L-1NaHS 6 h時,bEnd.3細胞和HUVEC細胞增殖作用開始增強,而加入48 h時,NaHS增殖作用進一步增加。

Fig 1 Effects of NaHS on proliferation ability of bEnd.3 and HUVEC
2.2 SU5416對NaHS誘導的小鼠腦微血管和人臍靜脈內皮細胞的增殖的影響如Fig 2所示,在bEnd.3細胞和HUVEC細胞中分別加入VEGFR2阻斷劑SU5416 10 μmol·L-1培養24 h對這兩種細胞的增殖均無明顯的影響,但可明顯地抑制1×10-3.5mol·L-1NaHS引起的bEnd.3細胞和HUVEC細胞的增殖,提示外源性H2S促進小鼠腦微血管和人臍靜脈內皮細胞增殖作用可能與VEGFR2有關。

Fig 2 Effects of SU5416 on NaHS-promoted proliferation of bEnd.3 and HUVEC
2.3 NaHS促進小鼠腦微血管和人臍靜脈內皮細胞遷移及SU5416對其的影響Fig 3結果中,與對照組相比, NaHS(1×10-6—1×10-3.5mol·L-1)加入24 h可明顯并呈濃度依賴性地增加bEnd.3細胞和HUVEC細胞的遷移面積(P<0.01);Fig 4的Transwell實驗結果表明與溶媒對照組相比,加入NaHS 1×10-3.5mol·L-124 h可明顯地增加bEnd.3細胞和HUVEC細胞從Transwell上室膜內遷移到膜外的細胞數(P<0.01)。10 μg·L-1VEGF164對bEnd.3細胞和HUVEC細胞的遷移面積和遷移細胞數有類似的作用(P<0.01)。結果表明外源性H2S可明顯地促進小鼠腦微血管及人臍靜脈內皮細胞的遷移。Fig 4還表明SU5416單獨加入24 h對bEnd.3細胞和HUVEC細胞的遷移細胞數無明顯的影響,但可明顯地減少1×10-3.5mol·L-1NaHS或10 μg·L-1VEGF164引起的bEnd.3細胞和HUVEC細胞的遷移細胞數的增加,提示外源性H2S促進小鼠腦微血管及人臍靜脈內皮細胞的遷移可能與VEGFR2有關。

Fig 3 Influence of NaHS on migration of bEnd.3 and HUVEC cells(×100)

Fig 4 NaHS-promoted migration of bEnd.3 and HUVEC cells and effects of SU5416 on
2.4 神經元CBS催化產生的H2S促進小鼠腦微血管內皮細胞的增殖和遷移結果如Fig 5和Fig 6所示,在小鼠海馬神經元HT22細胞與腦微血管bEnd.3內皮細胞的共培養體系中,H2S合酶CBS底物L-cys(100 μmol·L-1)可明顯地增加bEnd.3細胞增殖和遷移細胞數(P<0.01);CBS抑制劑AOAA(1 mmol·L-1)單獨使用對bEnd.3細胞增殖和遷移細胞數無明顯的影響,但可明顯地減弱L-cys引起的bEnd.3細胞增殖和遷移細胞數的增加。結果提示神經元CBS催化生成H2S可促進小鼠腦微血管內皮細胞的增殖和遷移。

Fig 5 Effect of neuro CBS-derived H2S on proliferation of bEnd.3cells in Transwell co-culture

Fig 6 Effect of neuro CBS-derived H2S on migration of bEnd.3 cells in Transwell co-culture system(×200)
2.5 阻斷VEGFR2對神經元CBS催化產生的H2S促小鼠腦微血管內皮細胞的增殖及遷移的影響如Fig 5和Fig 6所示,VEGFR2阻斷劑SU5416單用對bEnd.3細胞增殖和遷移無明顯的影響,但可明顯地減弱L-Cys促進bEnd.3細胞增殖和遷移作用,提示HT22神經元CBS催化產生的H2S促小鼠腦微血管bEnd.3內皮細胞的增殖和遷移作用可能與VEGFR2有關。
2.6 L-Cys單用及合用AOAA或SU5416對小鼠海馬神經元和內皮細胞共培養中H2S生成的影響
結果如Fig 7所示,CBS底物L-Cys可明顯提高小鼠海馬神經元HT22細胞與腦微血管內皮細胞bEnd.3細胞共培養中的H2S含量(P<0.01);CBS抑制劑AOAA和VEGFR2阻斷劑SU5416單用對共培養中的H2S含量均無明顯影響,但AOAA可明顯地降低L-Cys引起的H2S含量的提高,而SU5416卻無明顯的影響。結果提示,L-Cys可通過海馬神經元CBS催化生成H2S來提高共培養中的H2S含量。

Fig 7 Effect of L-Cys alone or in combination with AOAA or SU5416 on H2S content in co-culture system of bEnd.3 cells and HT22
2.7 L-Cys單用及合用AOAA或SU5416對共培養中小鼠腦微血管內皮細胞的胞內Ca2+熒光強度的影響結果如Fig 8所示,在小鼠海馬神經元HT22細胞與腦微血管內皮細胞bEnd.3細胞共培養中,加入CBS底物L-Cys可明顯提高內皮細胞內Ca2+熒光強度(P<0.01);加入CBS抑制劑AOAA和VEGFR2阻斷劑SU5416單用對內皮細胞內Ca2+熒光強度均無明顯影響,但AOAA 和SU5416能夠降低L-Cys引起的內皮細胞內Ca2+熒光強度的提高。結果提示L-Cys可通過小鼠海馬神經元CBS催化生成H2S來提高共培養中的內皮細胞內游離Ca2+濃度,并可能與VEGFR2有關。

Fig 8 Effect of L-Cys alone or in combination with AOAA or SU5416 on Ca2+ fluorescence intensity in bEnd.3 cells co-cultured with HT22
3 討論
缺血性腦損傷既有神經組織的損傷,也有腦血管的損傷,并且腦血管損傷或堵塞導致的腦血流減少甚至停止,是神經組織損傷的最直接原因[9]。因此,缺血后腦損傷修復中,恢復腦血流供應是至關重要的。缺血后腦血流供應的恢復不僅可通過腦血管的舒張,新的腦血管生成對恢復缺血區的血流供應和促進神經細胞損傷的修復也是非常重要的。
血管生成是指從已經存在的毛細血管或其后靜脈形成新的血管,包括血管內皮基質降解、內皮細胞移行與增殖、內皮細胞管道化形成血管環等極其復雜的過程[10]。其中,血管內皮細胞及其增殖與遷移能力在血管生成中是至關重要的[11]。本研究在人臍靜脈內皮細胞的HUVEC細胞上,觀察到了H2S供體NaHS促進細胞增殖和遷移作用,這與Longchamp等[12]報道的H2S可促進人臍靜脈內皮細胞增殖和遷移是一致的。本研究進一步在小鼠腦微血管內皮細胞的bEnd.3細胞中,首次發現NaHS可明顯地增加bEnd.3細胞的增殖及遷移面積與遷移細胞數,表明H2S可促進小鼠腦微血管內皮細胞的增殖和遷移。
血管內皮細胞遷移和增殖受到多種細胞信號調控[13]。其中,VEGF/VEGFR2信號最為重要[14]。H2S可促進小鼠腦微血管內皮細胞的增殖和遷移可能涉及有VEGFR2機制。有研究[15]表明,siRNA介導的VEGFR2基因敲低可抑制H2S誘導的人血管內皮細胞的遷移。本研究發現,VEGFR2阻斷劑SU5416不僅可以降低H2S對人臍靜脈內皮細胞的增殖和遷移的促進,也可明顯地抑制H2S促進小鼠腦微血管內皮細胞的增殖和遷移。結合文獻研究報道H2S可激活VEGFR2[8],我們的結果提示外源性H2S可能通過激活VEGFR2來促進小鼠腦微血管及人臍靜脈內皮細胞的增殖和遷移。
神經細胞中H2S合酶CBS催化產生的H2S可參與神經系統的生理和病理過程的調節。本研究將小鼠海馬神經元(HT22細胞)與小鼠腦微血管內皮(bEnd.3細胞)進行共培養,發現H2S合酶CBS底物L-cys可明顯地增加bEnd.3細胞增殖、遷移及共培養中的H2S含量,而CBS抑制劑AOAA雖然單獨使用對bEnd.3細胞增殖、遷移無明顯影響,但可明顯地減弱L-Cys引起的bEnd.3細胞增殖、遷移并減少H2S的含量。由于CBS是腦細胞特有的H2S合酶,結果表明小鼠海馬神經元CBS可催化L-Cys生成H2S來促進小鼠腦微血管內皮細胞的增殖和遷移,也即小鼠海馬神經元CBS催化產生的H2S可促進腦微血管內皮細胞的增殖和遷移。
本研究在HT22細胞與bEnd.3細胞共培養中,進一步發現雖然VEGFR2阻斷劑SU5416本身對bEnd.3細胞增殖和遷移無明顯的影響,但可明顯地減弱L-Cys經CBS催化生成H2S引起的bEnd.3細胞增殖和遷移的增加,并且此時共培養中的H2S含量無明顯的變化,結果表明神經元CBS催化生成的H2S增加腦微血管內皮細胞的增殖和遷移作用可能與VEGFR2可能有關。結合上述的外源性H2S可通過激活VEGFR2來促進bEnd.3細胞的細胞增殖和遷移,結果提示神經元CBS催化生成的H2S可激活VEGFR2促進腦血管內皮細胞增殖和遷移,至于H2S如何激活VEGFR2及其詳細機制有待于今后的進一步研究。
Ca2+是參與調節細胞功能的一種重要信使離子,可參與基因轉錄、細胞分泌、細胞增殖及遷移等多種生理功能的調節。有研究[15]表明,抑制鈣庫操縱性鈣內流能夠明顯抑制內皮細胞的增殖、遷移。本研究在小鼠海馬神經元與腦血管內皮細胞共培養模型中,發現CBS底物L-Cys可明顯提高內皮細胞內Ca2+熒光強度,并可被CBS抑制劑AOAA明顯減弱,表明L-Cys可通過神經元CBS催化生成H2S來提高內皮細胞的胞內游離Ca2+濃度。并且進一步觀察到L-Cys引起的提高內皮細胞內Ca2+熒光強度的提高可被VEGFR2阻斷劑明顯減弱,結合上述的VEGFR2在外源性H2S或神經元CBS催化生成的H2S在內皮細胞增殖和遷移中的作用,提示神經元CBS催化生成的H2S可能通過激活VEGFR2,導致腦血管內皮細胞內游離Ca2+濃度升高來促進細胞增殖和遷移。
綜上所述,神經元CBS催化生成的H2S可促進腦血管內皮細胞增殖和遷移,其可能是與激活VEGFR2,升高內皮細胞的胞內游離Ca2+濃度有關。

