Gd-IgA1在過敏性紫癜大鼠模型發病中的機制研究※
張曉強,李孟芳,劉品莉
(1.山西省中醫院,山西 太原 030012;2.山西省太原市迎澤區郝莊中心衛生院,山西 太原 030025)
過敏性紫癜又稱亨諾-許蘭紫癜(henoch-schonlein purpura,HSP),是一種常見的自身免疫參與的血管炎性疾病,臨床表現為皮膚紫癜、關節痛、腹痛及腎臟損害等[1]。過敏性紫癜性腎炎(henoch-schonlein purpura nephritis,HSPN)是其較嚴重的后遺癥[2]。本課題組前期采用中西醫結合方法建立了HSP大鼠模型[3]。近年有學者提出糖基化缺陷Ig A1(Gd-Ig A1)與HSP發病有關,而在HSP的病因中感染占第1位。基于此,筆者對Gd-Ig A1在HSP大鼠模型發病中的可能機制進行了實驗研究。
1 實驗方法
1.1 材料與方法
(1)動物與分組 選取健康SD大鼠60只,清潔級,體質量(180±20)g,6周齡,雌雄各半,由湖南斯萊克景達實驗動物有限公司動物室供應[使用許可證:SCXK(湘)2019-0004,質量合格證:1100111911008834],飼養于云南一同實驗教育科技有限公司中心實驗室動物房。適應喂養1周后將大鼠按隨機數字表法分為對照組和GABHS感染組,每組30只,依據分組不同分別飼養于具有獨立通氣的消毒飼養箱內,室溫恒定,過濾空氣,濕度50%~65%,光照10~12 h/d,自由攝取特殊飼料(標準飼料由湖南斯萊克景達實驗動物有限公司有限公司提供,在標準飼料中加入小麥、花生、奶粉、雞蛋、黃豆、蝦、帶魚、榛子等混合粉)及純凈水(由深圳宏博水處理設備有限公司生產的HBⅡ-C型純水機制備)。注:鏈球菌屬于第4類病原微生物,通常情況下不會引起人類或動物疾病。
(2)主要試劑和藥物 胡椒、干姜、蓽茇中藥配方顆粒劑(批號分別為1908098、1911058、1907020,江陰天江藥業有限公司);A組β型溶血性鏈球菌(GABHS)標準菌株(批號BNCC338425,蘇州北納創聯生物技術有限公司);大鼠Gd-Ig A1酶聯免疫分析試劑盒(貨號:ml059544-1,上海酶聯生物科技有限公司);大鼠C-反應蛋白(CRP)檢測試劑盒(貨號:ml002010-1,上海酶聯生物科技有限公司);ASO檢測試劑盒(多種屬)(貨號:ml059905-1,上海酶聯生物科技有限公司);Anti-Gd-Ig A1免疫組化試劑盒(貨號:ab212330,Abcam);蘇木素伊紅(HE)染色試劑盒(貨號:G1120,Solarbio);山羊血清(貨號:S9070,Solarbio);DAB顯色試劑盒(20x)(貨號:DA1010,Solarbio);其他常規試劑由云南一同實驗教育科技有限公司中心實驗室提供。
1.2 模型建立及方法
(1)血熱證動物模型建立 GABHS感染組大鼠采用熱性藥物灌胃建立血熱證動物模型,熱性藥物濃度為0.15 g/m L(現用現配,每次灌胃稀釋至2 m L),每日2次。對照組給予等量的0.9%氯化鈉注射液灌胃,自由飲食,不做其他處理。共灌胃3周。注:熱性藥物成人(按60 kg計)每日處方量為干姜5 g,蓽茇5 g,胡椒5 g;動物給藥量的換算公式為dB=d A×KB/KA,dB為大鼠每日每kg灌藥量,d A為成人每日每kg用藥量,KB=0.71,KA=0.11,為常數。
(2)GABHS感染及過敏(炎性)反應實驗 血熱證模型建立后,應用在TSB液體培養基恒溫環境中培養好的GABHS菌株液,待其生長至對數生長期,3 500 r/min離心10 min,PBS液洗滌2次,調節細菌濃度為1010CFU,保存在4℃冰箱中。血熱證模型大鼠連續5 d經口、鼻腔滴注GABHS菌株液,0.5 m L/只,觀察14 d。造模的最后3 d,再次應用上述方法激發過敏(炎性)反應。
1.3 模型觀察與指標檢測
(1)一般狀況 在造模前后觀察大鼠一般狀況,包括體溫、精神狀況、進食進水量、毛被、活動量、舌苔、口唇、結膜、耳郭、糞便顏色和硬軟度、尿的顏色和氣味等。
(2)指標和觀察病理變化 ①尿紅細胞計數。造模后兩組大鼠收取12 h尿液,靜置片刻,分別取5 m L放入尿液檢查塑料管中,采用全自動尿沉渣分析儀測定尿紅細胞計數。②血細胞分析、血清免疫相關指標(ASO、CRP)及Gd-Ig A1指標。兩組隨機取20只大鼠,分別于造模前后晨起空腹抽取下腔靜脈血約3 m L,置EDTA抗凝管中,1 h內取20μL,用獸用全自動血細胞分析儀檢測血細胞計數;其余血液在室溫下放置2 h后,4 000 r/min離心15 min,取血清400μL,分裝于3個EP管中,置入-70℃冰箱保存備用。采用酶聯免疫吸附法(ELISA)檢測血清ASO、CRP及Gd-Ig Al水平,操作步驟按照試劑盒說明書進行。③皮膚、腎臟病理檢查。造模后兩組隨機選取20只大鼠,摘取左右后肢皮膚及雙側腎臟,用10%中性福爾馬林溶液固定24 h,梯度乙醇(70%、80%、90%、95%、無水乙醇)脫水,二甲苯透明,石蠟包埋切片,厚度為3μm,分別進行HE染色和免疫組化染色,并在光鏡下觀察并拍片。
1.4 統計學方法 采用SPSS 19.0統計軟件處理數據。計量資料符合正態分布時采用均數±標準差(±s)表示,組內比較采用配對樣本t檢驗,組間比較采用獨立樣本t檢驗;指標之間相關性采用Pearson相關分析。P<0.05為差異具有統計學意義。
2 結果
2.1 一般情況 對照組大鼠精神、攝食均較正常。GABHS感染組大鼠造模后出現不同程度喜飲、煩躁、呼吸頻率增高、搔抓、口唇發干、耳郭赤紅、眼結膜充血、糞便干燥、小便發黃、偶見鼻衄等現象,4只大鼠在實驗期間有皮膚紫癜出現。
2.2 尿紅細胞計數 對照組大鼠在實驗過程均未出現明顯尿紅細胞升高。GABHS感染組大鼠造模后尿紅細胞較造模前明顯升高,且高于對照組(P<0.01)。見表1。
表1 對照組與GABHS感染組大鼠造模前后尿紅細胞計數比較(個/m L,±s)

表1 對照組與GABHS感染組大鼠造模前后尿紅細胞計數比較(個/m L,±s)
注:1.GABHS,A組β型溶血性鏈球菌。2.與本組造模前比較,△P<0.01;與對照組造模后比較,▲P<0.01。
組別 只數 造模前 造模后GABHS感染組 30 4.47±2.22 26.73±9.67△▲對照組 30 4.17±1.76 3.50±1.80
2.3 血液檢查
(1)血細胞分析 對照組大鼠在實驗過程均未出現明顯白細胞計數、N計數升高。造模后,GABHS感染組大鼠白細胞、N計數較造模前及對照組造模后顯著升高(P<0.01)。見表2。
表2 對照組與GABHS感染組大鼠造模前后血白細胞計數、中性粒細胞計數比較(±s)

表2 對照組與GABHS感染組大鼠造模前后血白細胞計數、中性粒細胞計數比較(±s)
注:1.GABHS,A組β型溶血性鏈球菌。2.與本組造模前比較,△P<0.01;與對照組造模后比較,▲P<0.01。
組別 只數白細胞計數(×109/L)中性粒細胞(×109/L)造模前 造模后 造模前 造模后GABHS感染組 20 4.71±0.57 12.81±3.26△▲ 0.46±0.08 0.79±0.06△▲對照組 20 4.92±0.70 4.76±0.64 0.46±0.09 0.46±0.08
(2)血ASO、CRP、Gd-Ig A1水平 對照組大鼠在實驗過程均未出現明顯血ASO、CRP、Gd-Ig A1升高。GABHS感染組大鼠造模前血ASO、CRP、Gd-Ig A1水平基本處于正常范圍,造模后血ASO、CRP、Gd-Ig A水平明顯升高。造模后,GABHS感染組大鼠血ASO、CRP、Gd-Ig A1水平較造模前及對照組造模后顯著增高(P<0.01)。見表3。
表3 對照組與GABHS感染組大鼠造模前后抗鏈球菌溶血素O、C-反應蛋白及糖基化缺陷IgA1水平比較(±s)

表3 對照組與GABHS感染組大鼠造模前后抗鏈球菌溶血素O、C-反應蛋白及糖基化缺陷IgA1水平比較(±s)
注:1.ASO,抗鏈球菌溶血素O;CRP,C-反應蛋白;Gd-Ig Al,糖基化缺陷Ig A1;GABHS,A組β型溶血性鏈球菌。2.與本組造模前比較,△P<0.01;與對照組造模后比較,▲P<0.01。
組別 只數 ASO(IU/m L)CRP(μg/m L)Gd-Ig A1(μg/m L)造模前 造模后 造模前 造模后 造模前 造模后GABHS感染組 20 51.95±25.11 204.20±135.15△▲ 1.73±1.43 43.58±26.70△▲ 4.25±1.01 18.43±5.26△▲對照組 20 51.00±33.21 60.50±34.24 2.07±1.43 1.51±1.23 3.56±1.59 4.21±2.06
2.4 指標相關性分析 經Pearson相關分析后,血白細胞計數與血Gd-Ig A1水平呈正相關(r=0.61,P<0.01),血ASO與Gd-IgA1水平呈正相關(r=0.46,P<0.05)。
2.5 皮膚、腎臟病理檢查
(1)大鼠后肢皮膚HE染色及免疫組化 大鼠后肢皮膚切片HE染色比較:對照組皮膚組織光鏡下觀察可見表皮、真皮與皮下組織分界清晰,未見明顯病理變化(圖1見本期第125頁);GABHS感染組皮膚組織光鏡下觀察可見真皮層小血管擴張,內皮細胞腫脹,紅細胞滲出至血管外組織,血管周圍有較多的中性粒細胞浸潤(圖2見本期第125頁),可見GABHS感染組皮膚存在炎性反應。大鼠后肢皮膚切片Gd-Ig A1免疫組化比較:對照組皮膚組織無Gd-Ig A1的表達(圖3見本期第125頁);GABHS感染組皮膚組織偶可見輕微棕黃色的Gd-Ig A1的表達(圖4見本期第125頁)。

圖1 對照組大鼠后肢皮膚HE染色(×200)
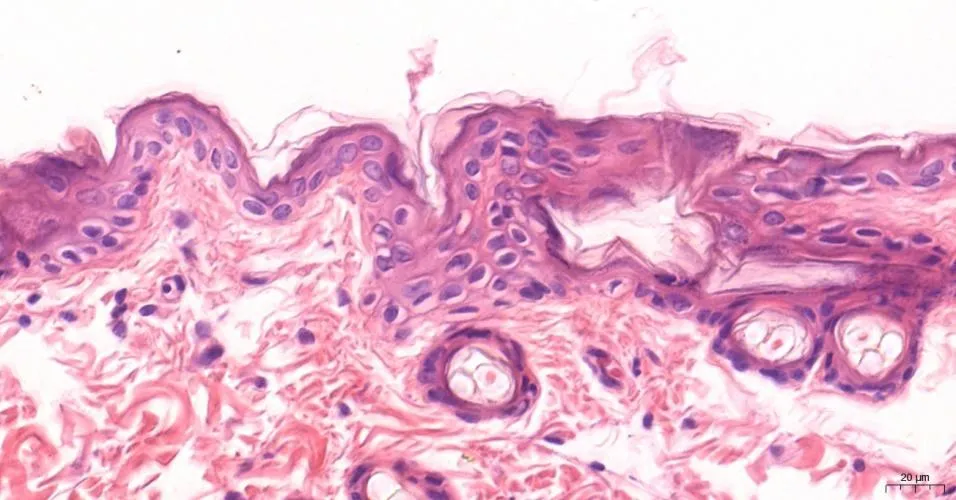
圖2 GABHS感染組大鼠后 肢皮膚HE染色(×200)
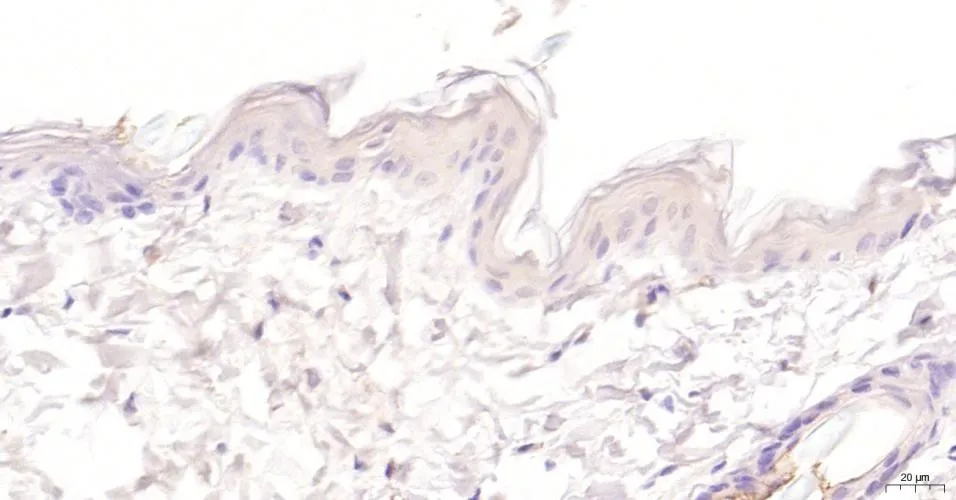
圖3 對照組大鼠后肢皮膚Gd-IgA1免疫組化(×200)
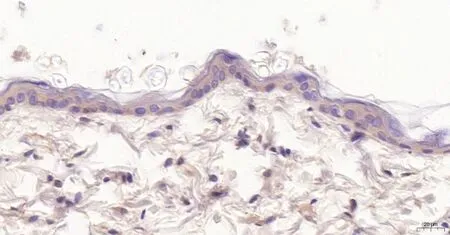
圖4 GABHS感染組大鼠后肢 皮膚Gd-IgA1免疫組化(×200)
(2)大鼠腎臟HE染色及免疫組化 大鼠腎臟HE染色比較:對照組腎組織結構基本正常,未見明顯病理變化(圖5見本期第125頁);GABHS感染組大鼠腎小球內分葉不明顯,系膜區略增寬,呈彌漫的輕中度的系膜細胞數量增多和基質增生,腎小球毛細血管內紅細胞瘀滯,系膜區和間質區有單核細胞和中性粒細胞浸潤(圖6見本期第125頁)。大鼠腎臟Gd-Ig A1免疫組化比較:對照組腎小球系膜區未見明顯Gd-Ig A1的表達(圖7見本期第125頁);GABHS感染組腎小球系膜區有較強的呈棕黃色團塊狀或顆粒狀的Gd-Ig A1的表達,或圍繞血管壁呈環狀沉積(圖8見本期第125頁)。
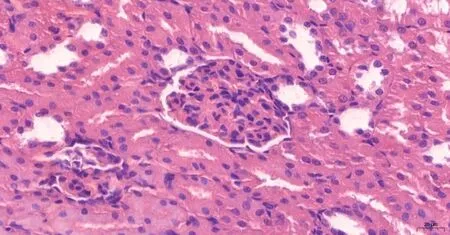
圖5 對照組大鼠腎臟HE染色(×200)
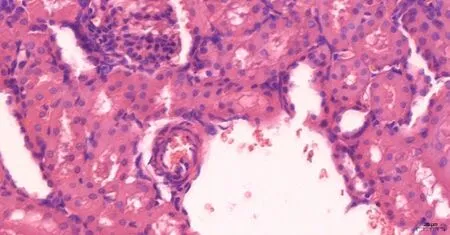
圖6 GABHS感染組大鼠 腎臟HE染色(×200)
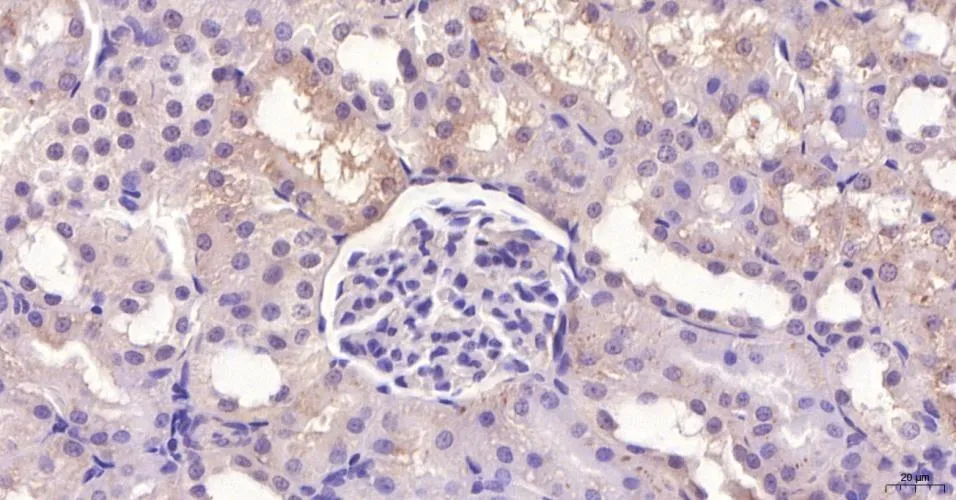
圖7 對照組大鼠腎臟Gd-IgA1免疫組化(×200)
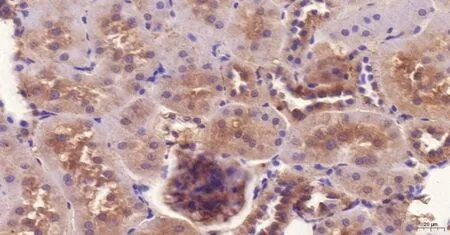
圖8 GABHS感染組大鼠腎臟Gd-IgA1腎臟免疫組化(×200)
3 討論
HSP的發病與感染、食物、環境污染、藥物、疫苗等導致的免疫損傷有關,其中感染占第1位[4]。A族鏈球菌(GAS)特別是GABHS的感染與HSP發病關系密切[5-6],約1/4的HSP患兒腎小球系膜有GABHS抗原沉積[7]。經抗感染治療后,HSP的復發率顯著降低[8]。
GAS是鏈球菌中致病性較強的一種,當人或動物感染GAS后,其菌體及內部結構、代謝產物可刺激B淋巴細胞(BC)產生大量ASO。M蛋白(MP)是GAS的主要致病因子,含MP的鏈球菌具有抵抗吞噬的作用。MP與心肌、腎小球基底膜有共同的抗原,可刺激機體產生特異性抗體。GAS可分泌多種胞外酶,這些酶能與淋巴細胞受體的特定區域結合,導致淋巴細胞增殖;還能與很多血漿蛋白結合,誘導交叉免疫反應;還可破壞吞噬細胞,刺激多形核白細胞黏附于內皮細胞,阻止粒細胞移入,導致血管損傷[1]。本研究發現HSP大鼠造模前ASO水平基本處于正常范圍,造模后ASO水平明顯升高。考慮與GABHS感染后,其菌體及內部結構、M蛋白片段作為抗原和其釋放的多種胞外酶結合或刺激BC產生大量ASO及相關抗體,并產生級聯免疫炎性反應,從而損傷內皮細胞,進而造成血管炎。
CRP是機體受到微生物入侵或組織損傷等炎癥性刺激時肝細胞合成的急性相蛋白。CRP通過與配體(如入侵細菌的磷酰膽堿)結合,激活補體和單核吞噬細胞系統導致炎性反應。本研究發現大鼠造模前CRP水平基本處于正常范圍,GABHS感染造模后CRP水平明顯升高,考慮GABHS感染后,CRP可能與GABHS的磷酰膽堿結合激活補體,進而造成免疫炎癥。
HSP的病理是由Ig A介導的,尤其是以Ig A1為主的自身抗體形成和大量Ig A1免疫復合物(IC)沉積于血管壁造成的小血管炎[9],Ig A1對HSP的發生、發展具有重要的作用[10]。Ig A1一部分是由呼吸道黏膜組織合成,而HSP與呼吸道感染有關[11]。本研究發現GABHS感染組腎小球系膜區有較強的Gd-Ig A1的表達,考慮與GABHS感染后,呼吸道黏膜產生大量的Ig A1相關。
正常情況下Ig A1分子可以正常糖基化,其N-乙酰半乳糖胺(Gal NAc)在N-乙酰半乳糖胺轉移酶(Gal NAc T2)的催化下,與Ig A1分子鉸鏈區絲氨酸或蘇氨酸的羥基相結合構成O-聚糖結構,然后在1,3-半乳糖基轉移酶(C1Gal T1)的催化下,以1,3鍵將半乳糖連接至Gal NAc上。唾液酸在唾液酸轉移酶的催化下,以2,3或2,6鍵與Gal NAc鏈接形成延長的糖鏈,并使O-聚糖帶負電荷。然后通過與肝臟去唾液酸糖蛋白受體(ASGPR)結合而被清除。而一些原因所致的糖基化缺陷的Ig A1(Gd-Ig A1)由于O-聚糖鏈末端的半乳糖缺失,不能被肝細胞識別而被清除。研究發現,GAS表面含有GalNAc結構,這些結構可能模擬了Gd-Ig A1的多糖表位,刺激機體產生相應的抗體,與Gd-Ig A1或GABHS菌體本身交叉反應形成Ig A1-IgG-IC沉積于血管壁,導致免疫復合物性小血管炎,造成體內Gd-Ig A1蓄積,Ig A1-IgG-IC與HSPN的發病密切相關[12]。因此,GABHS感染為上述免疫復合物形成的始動因素[11]。研究證實,HSP血清及毛細血管袢、腎小球系膜區、消化道黏膜組織等沉積的Ig A1均為Gd-Ig A1[11],是引發腎臟免疫炎性反應的重要環節[13]。Ig A1分子的異常糖基化水平高低不同可導致自身抗原暴露程度的差異,決定了自身免疫反應強度[14]。本研究證實GABHS感染組血清Gd-Ig A1水平顯著升高,皮膚及腎臟Gd-Ig A1免疫組化陽性表達,提示Gd-Ig A1參與了HSP發病。
本研究結果顯示,血白細胞計數與血Gd-Ig A1、ASO與Gd-Ig A1水平呈正相關,可推測HSP的感染發病機制如下:①病原體感染機體后,其菌體及內部結構、代謝產物均可使機體產生免疫應答,炎性因子增多,機體處于BC活化狀態。②病原體表面含有的Gal NAc結構可能模擬了Gd-Ig A1的多糖表位,刺激機體產生相應的抗體,與Gd-Ig A1或病原體本身交叉反應形成Ig A1-IgG-IC沉積于血管壁,導致免疫復合物性小血管炎。③上述免疫反應會釋放炎性因子及過敏介質,累及多器官及系統,出現HSP多變的臨床癥狀和并發癥。
綜上所述,Gd-Ig A1參與了HSP發病,感染為上述免疫炎癥形成的始動因素。Gd-Ig A1可作為HSP發病一種重要標志,并可作為一種簡便的臨床檢測指標。血清Gd-Ig A1滴度可隨臨床癥狀的加重(減輕)而升高(降低),而Gd-Ig A1腎臟免疫組化檢測亦能對疑難病例進行確診或病情評估。筆者認為,長期或反復的病原菌感染使機體處于BC活化狀態是HSP發病的體質基礎。臨床上對于有感染征象的HSP患者,應常規進行相關病原體抗體檢查或病原菌培養,針對性地應用抗生素治療,可有效縮短HSP病程,降低復發率,減輕臟器損傷;緩解期主動預防病原菌感染,可對其過敏體質進行調治,實現“體質脫敏”及治未病。

