miR-373靶向VEGFA對糖尿病視網膜病變大鼠的作用
郭 寧,阿依努·努拉厚,卜 倩,瀏 夢,王 雁
0引言
糖尿病視網膜病變(DR)是糖尿病微血管常見并發癥之一,導致患者視力受損。DR的特征是毛細血管周細胞早期丟失和基底膜增厚,導致內皮細胞過度增殖和血管生成,而血管內皮生長因子A(VEGFA)能夠促進血管生成,VEGFA的異常表達水平可加重病理性血管生成和DR的發生[1]。目前DR的主要治療手段有玻璃體腔注射抗VEGF藥物、激光治療、類固醇療法及玻璃體切除術等[2]。但實踐證明這些治療手段僅可預防或暫時緩解視力喪失。因此,亟需探究DR治療的新的治療靶標和方法。微小RNA(miRNA)是一類小的非編碼RNA,通過降解或阻斷信使RNA翻譯,在轉錄后水平調控靶基因的表達。研究表明,miRNA通過抑制炎癥反應、視網膜新生血管形成及神經元凋亡和變性對DR的早期治療具有一定作用[3-4]。另有研究發現miR-373與眼底疾病具有一定的相關性[5-6]。然而,miR-373是否參與DR發生發展目前罕見報道。此外,通過Mirtarbase網站預測到miR-373與VEGFA 3’UTR存在結合位點,因此,本研究主要探討miR-373在DR視網膜組織中的表達及其靶向VEGFA對DR的影響。
1材料和方法
1.1材料
1.1.1動物健康SPF級雄性SD大鼠40只,體質量180~220g,7周齡,購買且飼養于新疆醫科大學北校區動物實驗中心[許可證號:SCXK(新)2018-0002,SYXK(新)2018-0003]。本研究符合動物實驗倫理要求,經倫理委員會審批通過。
1.1.2主要試劑和儀器設備293T細胞購于無錫欣潤生物科技有限公司;RPMI-1640、胎牛血清購于Gibco公司;蘇木精伊紅(HE)染色試劑盒、BCA試劑盒、DAB顯色試劑盒購自北京索萊寶生物科技;miR-373 agomir、agomir-NC、miR-373 mimic、mimic-NC購于上海艾博思生物科技有限公司;突變型VEGFA 3’UTR、野生型VEGFA 3’UTR購于廣州輝駿生物科技股份有限公司;Bcl-2相關X蛋白(Bax)、β肌動蛋白(β-actin)兔抗大鼠單克隆抗體(ab32503、ab115777)、VEGFA、B淋巴細胞瘤-2基因(Bcl-2)兔抗鼠多克隆抗體(ab46154、ab194583)購于美國Abcam公司;磷脂酰肌醇3-激酶(PI3K)、磷酸化-磷脂酰肌醇3-激酶(p-PI3K)、絲蘇氨酸蛋白激酶(AKT)、磷酸化-絲蘇氨酸蛋白激酶(p-AKT)兔抗大鼠多克隆抗體(GTX100462、GTX132597、GTX121937、GTX128414)、山羊抗兔HRP標記二抗(GTX213110-01)購于GeneTex公司;Dual-Luciferase Reporter System購于Promega公司;Lipofectamine 2000、TRIzolTM、SuperScript Ⅳ反轉錄酶、PowerUp SYBR Green預混液購于賽默飛世爾科技(中國)有限公司。主要儀器:血糖儀(上海羅氏制藥有限公司);切片機(上海萊卡儀器有限公司);全自動酶標儀、ABI實時熒光定量PCR儀(美國Thermo Fisher Scientific公司);正立金相顯微鏡(日本Olympus公司)。
1.2方法
1.2.1造模、分組與給藥將40只大鼠隨機分為對照組(10只)和DR組(30只),DR組大鼠腹腔注射60mg/kg鏈脲霉素(STZ,10g/L)誘導糖尿病;對照組注射等量檸檬酸鹽緩沖液。注射STZ 72h后,尾靜脈取血檢測血糖,血糖值≥16.7mmol/L提示糖尿病大鼠建模成功。將造模成功的大鼠隨機分為模型組(10只)、miR-373 agomir組(10只)、agomir-NC組(10只),miR-373 agomir組和agomir-NC組大鼠分別于右眼玻璃體腔注射200μL miR-373 agomir(200nmol)和agomir-NC(200nmol),每周1次,共處理12wk;模型組大鼠右眼采用玻璃體腔注射200μL生理鹽水,每周1次,共處理12wk。每月記錄各組大鼠體質量,并通過血糖儀檢測各組大鼠血糖值。
1.2.2HE染色觀察視網膜病變情況處理12wk后,每組大鼠用30mg/kg戊巴比妥鈉麻醉,摘取右眼眼球,并迅速剝離視網膜組織進行冷凍儲存備用。經固定,常規石蠟包埋,切片,蘇木精伊紅染色,脫水,透明,中性樹脂封固,鏡下觀察。
1.2.3RT-qPCR檢測視網膜組織中相關mRNA表達水平處理12wk后,取每組大鼠視網膜組織100mg加入1mL TRIzolTM試劑,提取總RNA,合成cDNA,進行PCR反應。反應體系:cDNA 200ng;正向引物(10μmol/L) 0.5μl;反向引物(10μmol/L) 0.5μL;10×HA Buffer 2.0μL;2×PowerUp SYBR Green Master Mix 10μL;加入ddH2O至20μL。反應條件:預變性95℃ 5min 1個循環;變性94℃ 15s,退火58℃ 20s,延伸72℃ 1min,共40個循環;補充延伸72℃ 5min 1個循環。以U6和β-actin為內參,采用2-△△Ct進行相對定量分析。引物序列:miR-373上游引物5’-GCCAGAAGTGCTTCGATTTTG-3’,下游引物5’-GTGCAGGGTCCGAGGT-3’;U6上游引物5’-CTCGCTTCGGCAGCACA-3’,下游引物5’-AACGCTTCACGAATTTGCGT-3’;VEGFA上游引物5’-TGGCTCACTGGCTTGCTCTA-3’,下游引物5’-ATCCAACTGCACCGTCACAG-3’;β-actin上游引物5’-CTCCATCCTGGCCTCGCTGT-3’,下游引物5’-ACTAAGTCATAGTCCGCCTAGA-3’。
1.2.4雙熒光素酶實驗驗證miR-373與VEGFA靶向關系將293T細胞接種到24孔板中,并使用Lipofectamine 2000將野生型VEGFA 3’UTR或突變型VEGFA 3’UTR與miR-373 mimic共轉染至293T細胞,同時轉染mimic-NC與野生型VEGFA 3’UTR或突變型VEGFA 3’UTR為對照,轉染48h后,收集各組細胞裂解,并根據雙熒光素酶報告基因檢測試劑盒測量熒光素酶活性。相對熒光素酶活性=海腎熒光素酶活性/螢火蟲熒光素酶活性。
1.2.5Western-blot檢測視網膜組織中相關蛋白表達水平處理12wk后,取各組大鼠視網膜組織100mg,分別加入RIPA裂解液,離心,收集上清,采用BCA試劑盒測定蛋白含量。取50μg蛋白液進行SDS-PAGE電泳,PVDF轉膜,封閉,分別加入一抗VEGFA(1∶500)、Bax(1∶2000)、Bcl-2(1∶2000)、PI3K(1∶2000)、p-PI3K(1∶2000)、AKT(1∶2000)、p-AKT(1∶2000)、β-actin(1∶10000)4℃過夜,加入二抗(1∶10000)室溫孵育1h。ECL曝光成像,凝膠成像系統觀察拍照,以Image J圖像分析系統分析條帶灰度值。以β-actin為內參,目的蛋白相對表達水平=目的蛋白條帶灰度值/β-actin條帶灰度值。
統計學分析:采用GraphPad Prism 7軟件進行數據分析。計量資料采用均數±標準差表示,多組間比較采用單因素方差分析和重復測量數據的方差分析,兩組間比較采用獨立樣本t檢驗,多組間或組內兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2結果
2.1DR大鼠模型評價造模前后,兩組大鼠體質量和血糖濃度比較,差異均有統計學意義(體質量:F時間=56.147,P時間<0.001;F組間=1385.833,P組間<0.001;F交互=81.619,P交互<0.001;血糖濃度:F時間=99.852,P時間<0.001;F組間=760.987,P組間<0.001;F交互=119.360,P交互<0.001)。造模前,對照組大鼠體質量和血糖濃度與DR組差異均無統計學意義(P>0.05);造模4、8、12wk后大鼠無死亡,DR組大鼠體質量顯著低于對照組(P<0.001),血糖濃度顯著高于對照組(P<0.001),見表1。HE病理切片結果顯示,對照組大鼠視網膜組織細胞排列整齊,結構清晰,無病理性變化,DR組大鼠視網膜水腫,細胞分層模糊且排列紊亂,提示DR大鼠模型建立成功,見圖1。

圖1 兩組大鼠視網膜病理切片結果 A:對照組;B:DR組,箭頭表示細胞核固縮及組織排列紊亂。
表1 兩組大鼠造模前后體質量及血糖濃度
2.2各組大鼠視網膜組織中miR-373和VEGFAmRNA表達水平對照組、模型組、agomir-NC組和miR-373 agomir組大鼠視網膜組織中miR-373表達水平(1.00±0.06、0.34±0.03、0.34±0.03、4.37±0.15)和VEGFA mRNA表達水平(1.00±0.09、3.54±0.17、3.52±0.19、1.50±0.24)比較,差異有統計學意義(F=5513.582、536.590,均P<0.001)。與對照組比,模型組和agomir-NC組大鼠視網膜組織miR-373表達水平顯著下降,VEGFA mRNA含量顯著升高(P<0.05);與agomir-NC組比,miR-373 agomir組視網膜組織miR-373表達水平顯著升高,VEGFA mRNA含量顯著下降(P<0.05),見圖2。

圖2 各組大鼠視網膜組織中miR-373和VEGFA mRNA表達水平 A:miR-373表達水平;B:VEGFA mRNA表達水平。aP<0.05 vs 對照組;cP<0.05 vs agomir-NC組。
2.3miR-373對大鼠體質量和血糖濃度及視網膜組織病理變化的影響處理12wk后,agomir-NC組大鼠體質量為171.29±15.16g,血糖濃度為21.41±2.67mmoL/L,miR-373 agomir組大鼠體質量為264.62±14.02g,血糖濃度為17.22±0.30mmoL/L,與agomir-NC組比,miR-373 agomir組大鼠體質量顯著升高(t=14.292,P<0.001),血糖濃度顯著下降(t=4.927,P<0.001)。HE病理切片結果顯示,視網膜組織水腫情況得到緩解,細胞分層較為清晰,且排列較為整齊,見圖3。
圖3 miR-373 agomir對大鼠視網膜組織病理變化的影響 A:agomir-NC組,箭頭表示細胞核固縮及組織排列紊亂;B:miR-373 agomir組。
2.4各組大鼠視網膜組織Bax和Bcl-2蛋白表達情況對照組、模型組、agomir-NC組和miR-373 agomir組大鼠視網膜組織Bax蛋白表達量(0.20±0.03、0.97±0.05、0.98±0.05、0.55±0.05)和Bcl-2蛋白表達量(1.00±0.06、0.22±0.02、0.23±0.03、0.46±0.04)比較,差異有統計學意義(F=197.155、243.227,均P<0.001)。與對照組比,模型組和agomir-NC組大鼠視網膜組織Bax蛋白表達量顯著升高,Bcl-2蛋白表達量顯著下降(P<0.05);與agomir-NC組比,miR-373 agomir組大鼠視網膜組織Bax蛋白表達量顯著下降,Bcl-2蛋白表達量顯著升高(P<0.05),見圖4。
圖4 各組大鼠視網膜組織中Bax和Bcl-2蛋白表達情況 A:Western-blot檢測結果;B:Western-blot檢測結果量化分析。aP<0.05 vs 對照組;cP<0.05 vs agomir-NC組。
2.5miR-373靶向VEGFA 通過Mirtarbase網站(http://mirtarbase.cuhk.edu.cn/php/index.php)預測到miR-373與VEGFA 3’UTR存在結合位點。雙熒光素酶實驗顯示,miR-373 mimic顯著抑制野生型VEGFA 3’UTR熒光素酶活性,對突變型VEGFA 3’UTR熒光素酶活性無影響(圖5A)。Western-blot結果顯示,對照組、模型組、agomir-NC組和miR-373 agomir組大鼠視網膜組織VEGFA蛋白表達量(0.19±0.03、0.96±0.07、0.96±0.06、0.34±0.04)比較,差異有統計學意義(F=205.045,P<0.001),與agomir-NC組比,miR-373 agomir組VEGFA蛋白表達水平顯著下降(P<0.05),見圖5B。
圖5 miR-373靶向VEGFA A:雙熒光素酶實驗檢測結果,aP<0.05 vs mimic-NC組;B:Western-blot檢測結果,aP<0.05 vs 對照組;cP<0.05 vs agomir-NC組。
2.6miR-373對PI3K/AKT信號通路的影響對照組、模型組、agomir-NC組和miR-373 agomir組大鼠視網膜組織PI3K蛋白表達量(1.12±0.04、1.03±0.11、1.02±0.11、1.02±0.10)和AKT蛋白表達量(0.93±0.09、0.90±0.10、1.00±0.10、1.00±0.10)差異無統計學意義(F=0.755、0.806,均P>0.05),p-PI3K蛋白表達量(0.10±0.01、0.80±0.10、0.74±0.07、0.38±0.02)和p-AKT蛋白表達量(0.10±0.01、1.20±0.10、1.20±0.12、0.40±0.04)差異有統計學意義(F=83.216、145.211,均P<0.001)。與對照組比,模型組和agomir-NC組大鼠視網膜組織PI3K、AKT蛋白表達水平無顯著變化,p-PI3K、p-AKT蛋白表達水平顯著升高(均P<0.05);與agomir-NC組比,miR-373 agomir組大鼠視網膜組織PI3K、AKT蛋白表達水平無顯著變化,p-PI3K、p-AKT蛋白表達水平顯著下降(均P<0.05),見圖6。
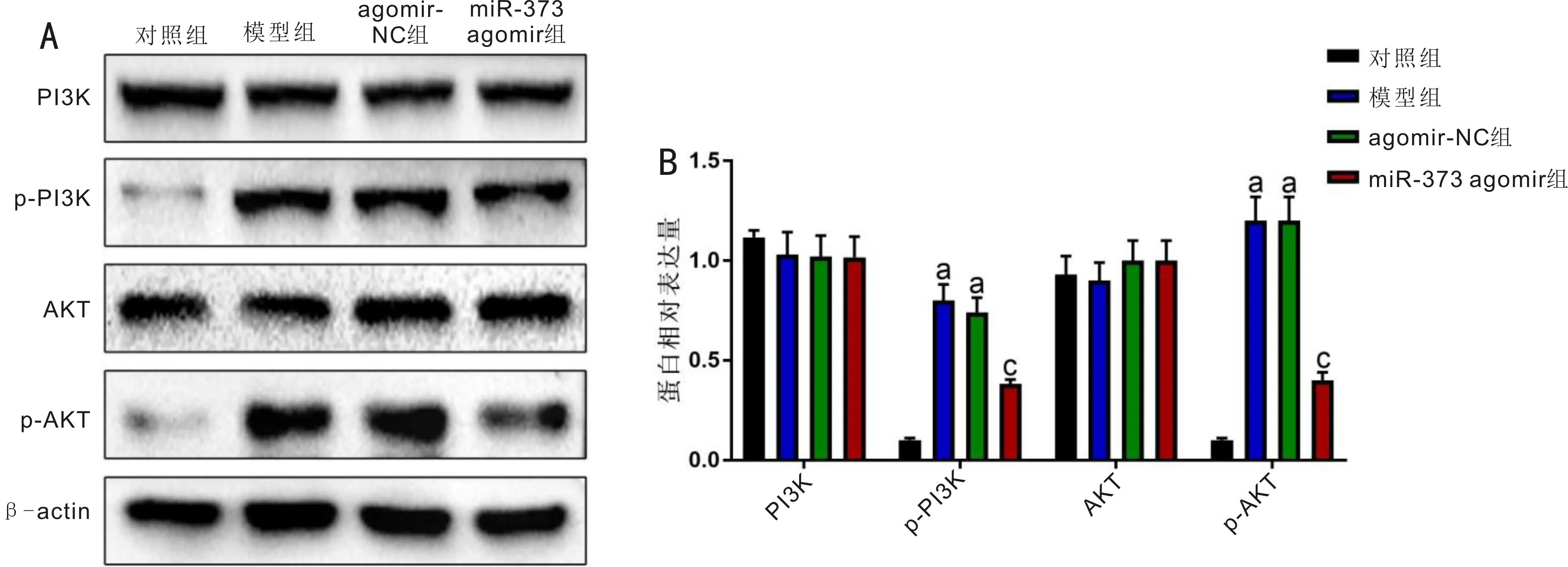
圖6 miR-373對PI3K/AKT信號通路的影響 A:Western-blot檢測結果;B:Western-blot檢測結果量化分析。aP<0.05 vs 對照組;cP<0.05 vs agomir-NC組。
3討論
在我國,DR的發病率和患病率逐年上升,以毛細血管周細胞減少、內皮細胞/基底膜增厚及血管新生為主要臨床特征,可分為增殖性和非增殖性糖尿病視網膜病變,其中增殖性糖尿病視網膜病變是導致25~65歲人群失明和視力損害的主要誘因[2]。目前研究表明DR的發病機制極為復雜,涉及炎癥、神經元調亡、細胞增殖、分化等多種病理過程,其具體機制仍需進一步闡明[7]。目前,許多研究證實miRNA參與DR發生與發展,且可能成為DR的新生物標志物[8-11]。如miR-204通過調節沉默信息調節因子1(SIRT1)的表達,抑制DR大鼠的炎癥反應和細胞凋亡[8]。在DR體外模型中,miR-199a-3p通過靶向VEGF/PI3K/AKT信號通路抑制血管生成,miR-590-3p通過靶向NLRP1抑制NADPH氧化酶(NOX4)信號通路的激活,減少細胞焦亡[9-10]。Liu等[11]研究表明2型糖尿病(T2DM)誘發的DR患者血清中miR-221的表達明顯升高,與糖化血紅蛋白等代謝參數顯著正相關,且對DR的診斷準確性高于血管緊張素Ⅱ(Ang Ⅱ)和VEGF。
miR-373位于染色體19q13.4.21,屬于miR-520/miR-373家族,該家族由3個不同的miRNA簇組成,分別是miR-302/miR-367、miR-371/miR-372/miR-373和miR-520[12]。越來越多的證據表明,miR-373可以通過調控特定基因在人類癌癥中發揮癌基因或抑癌基因的作用[13-14]。糖尿病視網膜細胞凋亡的分子基礎涉及促凋亡和抗凋亡的基因,Bax是視網膜神經元凋亡的關鍵因素,也是保護受損視網膜神經元的治療性基因策略的靶點之一。Bcl-2與視網膜神經細胞凋亡有關,Bcl-2與Bax的表達比例對決定細胞壽命至關重要[15]。本研究結果表明,miR-373在DR大鼠視網膜組織中表達量下調,視網膜組織Bax蛋白表達顯著增加,Bcl-2蛋白表達顯著減少;過表達miR-373后,可以明顯降低DR大鼠血糖,抑制視網膜組織Bax蛋白表達并促進Bcl-2蛋白表達,抑制視網膜細胞凋亡,改善DR。與Teng等[16]研究結果相同,該研究報道過表達miR-373可抑制細胞凋亡。結合Yang等[5]和Tian等[6]研究結果,我們推測miR-373可能參與DR的發病過程,上調miR-373表達可改善DR。VEGFA屬于VEGF家族,在血管生成、腫瘤生長及缺血性疾病中扮演著重要角色,與其受體結合,激活PKC、NOS、AKT、MAPK等途徑誘導血管生成。同時,也有研究表明VEGFA在DR視網膜組織中可以通過促進新生血管形成,從而促使DR發生發展[17]。VEGF抑制劑如雷珠單抗、阿柏西普、康柏西普等因具備促使視網膜新生血管萎縮,改善視功能預后等功能,目前在臨床上被廣泛應用。本研究通過生物信息學網站預測到miR-373可以與VEGFA的3’UTR區互補結合,并且應用雙熒光素酶實驗驗證了VEGFA是miR-373的直接靶點。提示miR-373可能通過下調VEGFA表達阻礙DR發生發展。結合Oltra等[18]研究結果表明采用miRNA降低VEGF可以作為治療DR的一種方法。
PI3K/AKT信號通路參與細胞的增殖、凋亡和分化,是體內重要的細胞信號通路,同時在葡萄糖轉運、糖原合成、糖酵解和糖異生的調節中也發揮重要作用。Fang等[19]研究指出根據KEGG通路數據庫的預測可知,VEGF位于PI3K/AKT通路的下游,且Simó等[20]研究表明胰島素通過激活PI3K/AKT通路誘導小鼠主動脈平滑肌細胞內VEGF轉錄和表達,從而引起DR惡化。本研究發現DR大鼠過表達miR-373后,p-PI3K、p-AKT及VEGFA蛋白表達水平顯著下調。上述結果提示,miR-373通過下調VEGFA的表達并抑制PI3K/AKT通路蛋白的表達,從而改善DR。這與Wang等[9]研究結果一致。
綜上所述,本研究在動物水平上表明miR-373通過靶向VEGFA參與DR的病理生理過程,其機制可能與miR-373抑制PI3K/AKT信號通路有關,提示miR-373可能成為治療DR的一個潛在的新靶點。

