人工周期聯合或不聯合促性腺激素釋放激素激動劑的子宮內膜準備方案對月經周期不規律患者凍融胚胎移植臨床結局的影響▲
劉俐伶 譚衛紅 韋 福 蔡江川
(廣西壯族自治區人民醫院生殖醫學與遺傳中心,南寧市 530021,電子郵箱:liulilingnn@126.com)
凍融胚胎移植(frozen-thawed embryo transfer,FET)是指將冷凍保存的一個或多個胚胎解凍并移植到子宮的技術,FET可以提高累積妊娠率,防止卵巢過度刺激綜合征的發生。隨著胚胎基因篩選技術的廣泛應用,胚胎冷凍保存的需求也越來越大[1]。因此,胚胎的冷凍保存和FET已成為輔助生育技術重要且常規的部分。胚胎解凍后的發育階段與胚胎移植當天子宮內膜的發育階段相一致是FET成功的關鍵。為優化胚胎植入技術,已有多種子宮內膜準備方案可供選擇,這些方案[2-5]包括有或沒有人絨毛膜促性腺激素(human chorionic gonadotropin,hCG)觸發的自然周期,有或沒有促性腺激素釋放激素激動劑(gonadotropin-releasing hormone agonist,GnRH-a)抑制的人工周期。但關于子宮內膜準備的最佳方法目前尚未達成共識[3]。
通常,月經周期規律的婦女可以使用各種方案促排卵,但月經周期不規律的女性因為不排卵或者隨機排卵而不宜采用自然周期方案,其可以使用促排卵藥物或人工周期來準備內膜,但是促排卵方案必須確定排卵誘導周期中的排卵時間,導致抽取血樣和就診的次數增加,并且不能選擇胚胎解凍和移植的日期。因此,人工周期方案是月經周期不規律女性FET中最常用的子宮內膜準備方式[6-7]。人工周期聯合GnRH-a下調的主要優點是可以防止自發排卵,減少周期取消率,但這個過程費用高,準備時間長,并且可能出現垂體抑制后低雌激素副作用。而不聯合GnRH-a的方案較經濟、簡單,但其可能因自發排卵而導致周期取消。已有研究報告人工周期聯合與不聯合GnRH-a可獲得一致的臨床結局[8-12],但是這類研究主要針對月經周期規律的女性或未明確定義月經周期規律與否的人群,針對月經周期不規律女性的研究很少,結論并不統一[10,13]。本研究回顧性分析人工周期聯合或不聯合GnRh-a的子宮內膜準備方案對月經周期不規律患者FET的臨床結局的影響。
1 資料與方法
1.1 臨床資料 回顧性分析2017年1月1日至2018年12月1日期間于我院行FET治療的556個周期(包括人工周期聯合或不聯合GnRh-a的子宮內膜準備方案)的臨床資料。納入標準:(1)平時月經周期不規律;(2)既往在我中心行體外受精獲得冷凍胚胎。排除標準:(1)FET周期因胚胎解凍存活失敗而取消;(2)失訪而無臨床結果的患者。按照內膜準備方案分為人工周期聯合GnRh-a組(A組)153例和人工周期不聯合GnRh-a組(B組)403例。兩組患者的年齡、體質指數、基礎竇卵泡數、不孕類型、移植胚胎類型、移植優質胚胎數、移植周期數、移植胚胎數等基線資料比較,差異均無統計學意義(均P>0.05),具有可比性,但A組孕酮給藥日子宮內膜厚度大于B組(P<0.05)。見表1。本研究獲得本院醫學倫理委員會批準,所有患者均對本研究知情同意并簽署知情同意書。
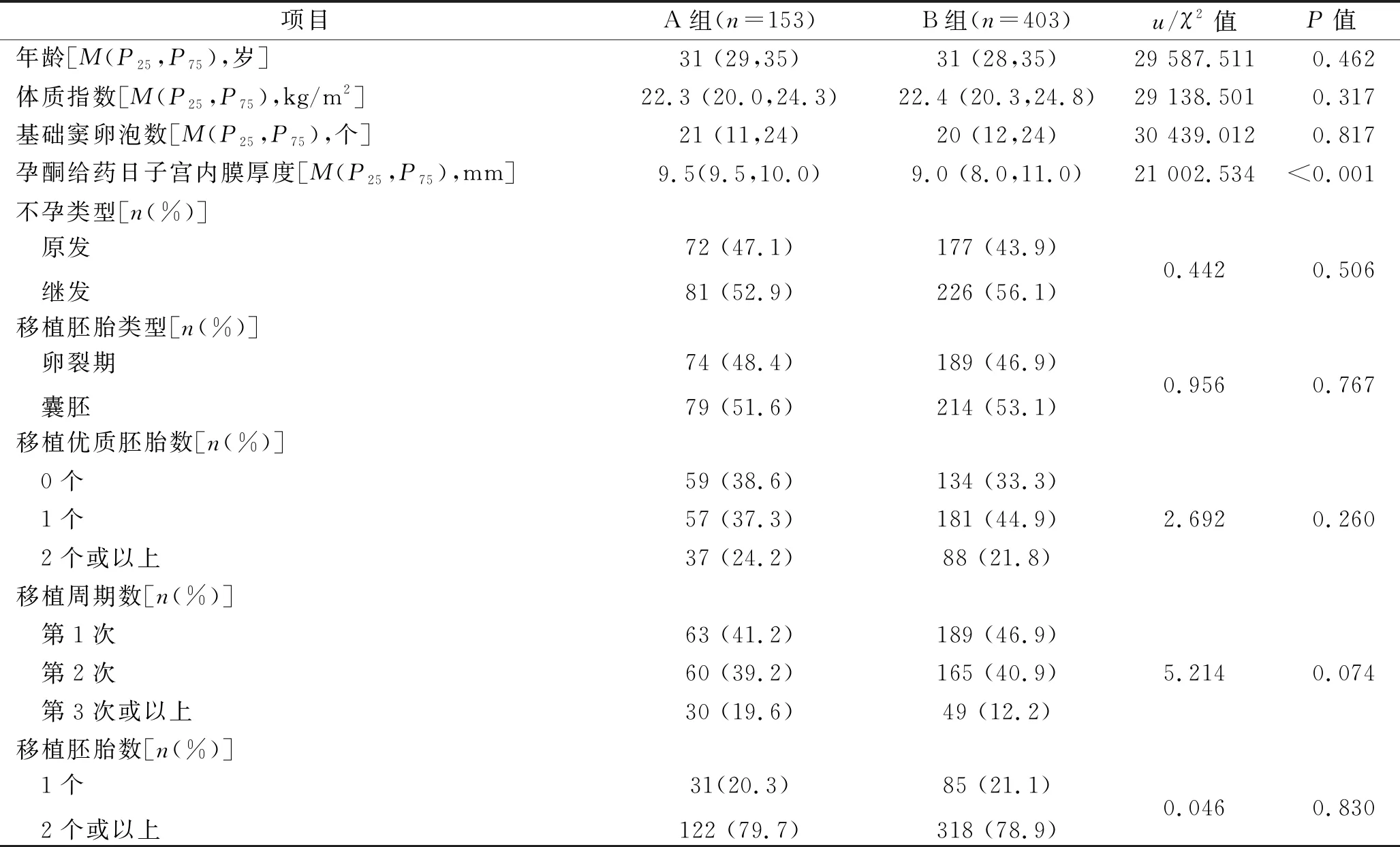
表1 兩組患者的基線資料的比較
1.2 研究方法 (1)A組于月經周期的第2~4天使用一次注射用曲普瑞林(達菲林,法國博福-益普生公司,生產批號:H20090274),3.75 mg。28 d后開始補充戊酸雌二醇(拜耳醫藥保健有限公司廣州分公司,生產批號:J20130009,規格:1 mg/片)。(2)B組月經第2~4天直接開始補充戊酸雌二醇。兩組戊酸雌二醇片用量均為2 mg/次,2次/d,7 d后改為2 mg/次,3次/d。14 d后兩組均采用經陰道超聲檢查測量子宮內膜厚度,并檢測血清雌二醇和孕酮水平。如果血清孕酮>1.5 ng/mL,則取消周期;如果子宮內膜厚度≥7 mm并呈三線征,則開始補充孕酮:給予黃體酮陰道緩釋凝膠(J)(雪諾同,瑞士默克雪蘭諾,生產批號:C14125/C)90 mg/次,1次/d,或給予黃體酮(浙江仙琚制藥, 生產批號:181105)肌肉注射,40 mg/d,移植卵裂期胚胎者連續補充3 d,移植囊胚期胚胎者補充5 d后行胚胎移植。若子宮內膜厚度仍<7 mm,繼續口服戊酸雌二醇,3 mg/次,3次/d,直至子宮內膜厚度≥7 mm后開始補充黃體酮;延長補充戊酸雌二醇時間達7 d時,如子宮內膜厚度仍<7 mm,則征詢患者意見是否取消或繼續移植,要求移植者繼續補充孕激素,用量同上。經腹部超聲引導下向宮腔移植1~3個胚胎。移植后繼續給予移植日的戊酸雌二醇和黃體酮用量至移植后14 d進行妊娠試驗,血β-hCG>7 U/L時判斷為妊娠。確認妊娠后,保持移植日使用的戊酸雌二醇和黃體酮用量不變,持續用藥至妊娠10周。所有胚胎均采用玻璃化冷凍技術保存,卵裂期和囊胚期胚胎均允許移植,卵裂期胚胎的分級采用Veeck量表進行判定,囊胚期胚胎的分級采用Gardner分級系統進行判定[14]。
1.3 觀察指標 比較兩組患者的臨床妊娠、持續妊娠、活產及流產等臨床結局。臨床妊娠定義為血β-hCG升高后2周超聲發現胎心;持續妊娠定義為妊娠第12周后繼續妊娠;流產定義為臨床妊娠20周以內的流產;活產定義為無論孕期長短,至少有一個活產嬰兒出生。臨床妊娠率=臨床妊娠周期數/移植周期數×100%,持續妊娠率=持續妊娠周期數/移植周期數×100%,活產率=活產周期數/移植周期數×100%,流產率=流產患者數/臨床妊娠周期數×100%。
1.4 統計學分析 采用SPSS 16.0軟件進行統計分析。不符合正態分布的計量資料以[M(P25,P75)]表示,組間比較采用Mann-Whitneyu檢驗;計數資料以例數和百分比表示,組間比較采用χ2檢驗。以P<0.05為差異具有統計學意義。
2 結 果
2.1 兩組患者FET臨床結局的比較 兩組患者的臨床妊娠率、持續妊娠率、活產率和流產率比較,差異均無統計學意義(均P>0.05),見表2。

表2 兩組患者FET臨床結局的比較[% (n/N)]
2.2 不同子宮內膜厚度患者FET臨床結局的比較 因兩組黃體酮給藥日子宮內膜厚度差異具有統計學意義,進一步對該指標進行亞組分析,在子宮內膜厚度≥7 mm亞組,兩組的臨床妊娠率、持續妊娠率、活產率和流產率差異均無統計學意義(均P>0.05);在子宮內膜厚度<7 mm亞組,A組的活產率高于B組(P<0.05),而兩組的臨床妊娠率、持續妊娠率和流產率差異均無統計學意義(均P>0.05)。見表3。
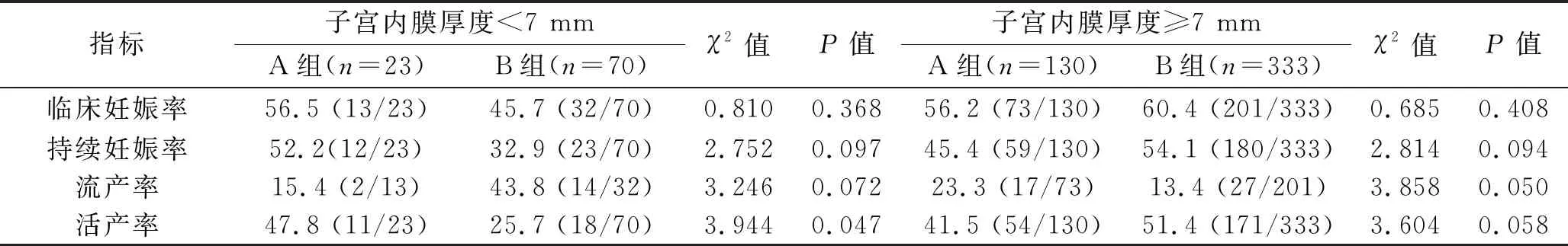
表3 不同子宮內膜厚度患者FET臨床結局的比較[% (n/N)]
3 討 論
凍融胚胎已成為輔助生育技術中胚胎移植的主要來源,FET的成功與否受患者年齡、冷凍前胚胎質量、移植胚胎數量、冷凍解凍方案、子宮內膜準備方案等因素的影響[15]。胚胎與子宮內膜發育同步是子宮內膜準備的關鍵步驟。Hebisha等[9]發現,應用GnRH-a進行預處理后,FET的著床率和妊娠率明顯升高;但是GnRH-a給藥時間為前一個周期的黃體中期,而不是月經第2~5天,而且沒有具體定義研究人群。多囊卵巢綜合征常以月經周期不規律為特征,Tsai等[16]觀察到FET前使用GnRH-a可提高高雄激素性多囊卵巢綜合征婦女的持續妊娠率,但該研究的樣本量小(60個周期)。因此,我們回顧性分析本中心FET周期中,月經周期不規律患者應用人工周期聯合或不聯合GnRh-a的子宮內膜準備方案的臨床效果,以評估GnRH-a在月經周期不規律婦女人工周期子宮內膜準備方案中應用的必要性。
本研究結果顯示,兩組患者的臨床妊娠率、持續妊娠率、活產率和流產率差異無統計學意義(均P>0.05)。在黃體酮給藥日不同子宮內膜厚度亞組分析中,當子宮內膜厚度≥7 mm時,兩組的臨床妊娠率、持續妊娠率、活產率和流產率差異均無統計學意義(均P>0.05),但是當子宮內膜厚度<7 mm時,采用人工周期聯合GnRh-a子宮內膜準備方案者的活產率高于采用人工周期不聯合GnRh-a子宮內膜準備方案者(P<0.05)。通常,子宮內膜厚度<7 mm是FET取消周期的一個標準,這與子宮內膜厚度<7 mm的薄型子宮內膜易發生妊娠損害有關,但是子宮內膜厚度滿足妊娠的閾值仍有爭議[17-20]。本研究中黃體酮給藥當天子宮內膜厚度<7 mm的93個周期沒有取消移植,并有部分患者成功妊娠。這說明子宮內膜厚度<7 mm的薄型子宮內膜患者的FET結局并不完全與子宮內膜厚度有關,可能還與子宮內膜的準備方案有關,這與其他學者的研究結論相似[21]。這提示,GnRh-a可能通過作用于子宮內膜的GnRH受體來改善薄型子宮內膜患者的子宮內膜容受性[22],從而提高活產率。活產是判斷輔助生育技術治療效果的黃金標準,它能更加全面和客觀地評估輔助生殖助孕方案對胚胎種植和圍產結局的影響,因此,我們認為采用GnRH-a預處理的人工周期方案可能改善了子宮內膜的容受性,薄型子宮內膜患者進行FET時更適合采用人工周期聯合GnRH-a的子宮內膜準備方案。
綜上所述,對于月經周期不規律的女性,當子宮內膜厚度≥7 mm時,在FET中采用人工周期聯合或不聯合GnRh-a的子宮內膜準備方案具有相同的臨床效果,但當子宮內膜厚度較薄(<7 mm)時,聯合GnRh-a的子宮內膜準備方案或可提高活產率。本研究為回顧性研究,且樣本量不大,兩組病例數相差較大,今后仍需通過增大樣本量和改進設計來證實本研究結論。

