水中痕量氨的顯色法測定及干擾分析
李遠剛,楊 容,陳 永,李華靜,周安寧,梁耀東
(西安科技大學 化學與化工學院,陜西 西安 710054)
0 引 言
從氨基酸、多肽到功能蛋白,氮是所有生物體構建各種功能分子的基本元素,從大氣中固定N2合成NH3是維持生命必不可少的過程[1]。工業上,將N2還原為NH3的Haber-Bosch工藝是當今化工的基本支柱之一。該工藝是在相對苛刻的條件下(200~400 bars,400~500 ℃)通過鐵基催化劑協同活化實現的,反應原料H2通常是通過蒸汽甲烷重整(SMR)或水煤氣變換反應(WGS)得到的,而SMR和WGS過程不可避免地會消耗大量化石燃料同時也排放大量CO2[2]。
在自然界,部分植物的根瘤菌合成氨是一個溫和的過程。常溫常壓條件下,在固氮酶的催化下將大氣中N2轉變為NH3,但是該過程速度慢、產率低[3]。受固氮酶合成氨過程的啟發,人們正在研究的新型光催化和電催化系統能夠在類似于固氮酶的溫和條件下,將大氣中的N2轉變為NH3。不同于高能耗高排放的Haber-Bosch過程,這種溫和條件下的合成氨路線能夠減少對化石燃料的依賴和溫室氣體的大量排放[4]。
光催化和電催化技術提出了一種有前景的無碳合成氨策略,從而為發展清潔、可持續的合成氨路線提供了潛在的新途徑[5]。然而,不同于已經工業化的Haber-Bosch過程,溫和條件下的合成氨研究尚處于實驗室探索階段,開發廉價高效的催化劑無疑是當前研究所面臨的重要挑戰。在這些研究中,為了準確評價催化劑活性,建立方便可靠的低濃度NH3定量方法顯得尤為重要。另外,水樣中低濃度氨的定量分析對控制環境水樣富營養化[6-7]、實現人與環境的和諧發展也非常重要。
常見的氨檢測方法有納氏試劑法、靛酚藍法、離子色譜法等。分光光度法因其成本較低得到廣泛應用[8]。其中以納氏試劑法和靛酚藍法最為常見。納氏試劑法[9-11]利用一種含有K2HgI4和KOH的溶液,使HgI42-離子與氨溶液在堿性條件下生成紅棕色絡合物,其最大吸收在420 nm處,在沒有干擾的情況下,所得到紅棕色絡合物的吸光度與氨濃度成正比。但是該方法存在試劑含有劇毒汞成分[12]、使用壽命較短(約3周)、氨與納氏試劑反應時間會影響氨的定量等缺點。另一種顯色方法是靛酚藍顯色法[13-15],該方法具有操作簡便、有較高的精密度和準確度、不需要特殊程序處理危險廢物等優點,廣泛應用于低濃度氨的定量分析。不同于上述顯色方法,離子色譜法[16-17]具有高效簡便、靈敏度高、重現性好、高選擇性等特點,由于需要復雜昂貴的儀器在實際應用中受到限制。
利用靛酚藍顯色法測定氨含量是一種非常成熟的技術,在環境水樣分析、生化樣品檢測等方面得到廣泛應用。然而,將該方法應用到光電催化合成氨樣品的定量分析時會遇到新的問題。因為電催化樣品共存于高濃度電解液中,而光電催化過程使用的催化劑往往含有過渡金屬成分。為了驗證靛酚藍顯色法在光電催化合成氨領域應用的可能性,本論文著重分析了在模擬光電催化的高濃度電解質、共存過渡金屬離子等條件下靛酚藍顯色法的離子干擾問題,并通過大量實驗提出了排除干擾的離子掩蔽方案。論文結果顯示,一些過渡金屬離子確實對靛酚藍顯色法測氨產生強干擾,使得分析結果不可靠,而通過本論文提出的離子掩蔽策略,可以達到定量分析要求。因此,本論文為靛酚藍顯色法分析強干擾離子存在下的水溶液氨含量提供了有益借鑒。
1 實 驗
1.1 實驗原理
靛酚藍分光光度法的理論依據為朗伯-比爾定律。在堿性條件及室溫下,以亞硝基鐵氰化鈉(硝普鈉)作為催化劑,氨與次氯酸鹽、水楊酸鹽反應生成藍色化合物[18-19]。其最大吸收波長671 nm處的吸光度與樣品中氨含量成正比例關系。反應式如圖1所示。
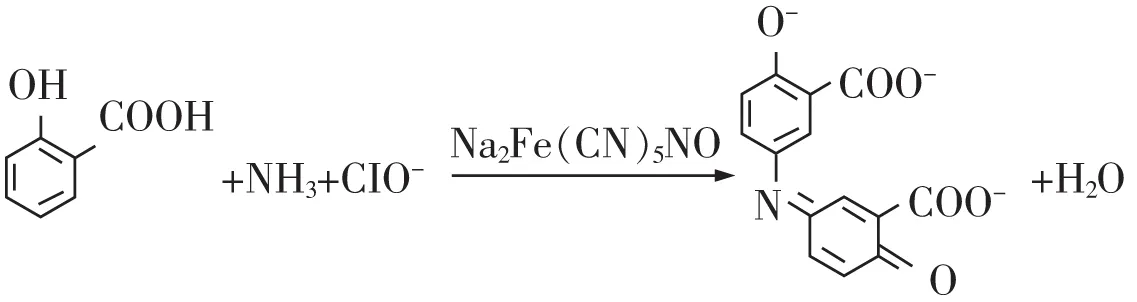
圖1 靛酚藍顯色反應式[20]
1.2 儀器
紫外-可見分光光度計UV-2500(島津)、離心機TGL-16C(上海安亭)、電子分析天平CP214(奧豪斯)、超聲波清洗機JP-020PLUS(潔盟)、燒杯等玻璃儀器。
1.3 試劑
實驗過程中所用的試劑都為分析純,采購于國藥集團化學試劑公司,硝普鈉溶液0.01 g/mL(阿拉丁)。實驗用水為去離子水,用干燥的氯化銨配制10 mM氨貯備液,使用時稀釋到所需濃度。
1.4 繪制標準曲線
準確配制濃度為0.2 mM的氨儲備液,準確量取該溶液0,1,2,4,6,8,16,24 mL于25 mL容量瓶,用超純水定容至刻度線,得到濃度分別為0,0.008,0.016,0.032,0.048,0.064,0.128,0.192 mM的氨標準溶液。分別取0.6 mL上述溶液用于顯色反應,依次加入1.9 mL去離子水、1 M水楊酸鈉溶液0.4 mL、硝普鈉溶液0.025 mL、0.35%wt次氯酸鈉溶液0.025 mL,搖勻、混合靜置。在室溫下反應1.5 h,使其充分顯色。然后從低濃度到高濃度依次測定其吸光度,得到濃度-吸光度的擬合曲線[21]。
1.5 離子干擾實驗
為了檢測常見金屬離子對氨含量測定的干擾情況。分別配制含有10 mM(Ag+,Al3+,Ni2+,Ca2+,Co2+,Cu2+,Fe3+,Zn2+,Mg2+,Mn2+,Cd2+)或0.1 M(Li+,Na+,K+)金屬離子的氨溶液。按上述實驗方法顯色并測定其吸光度,由此來確定干擾離子對測定水中氨含量的影響。掩蔽試劑的干擾測定使用相同的實驗方法。
1.6 干擾離子掩蔽實驗
為了進一步消除Ni2+,Cu2+,Co2+,Mn2+,Ag+,Fe3+離子對氨含量測定結果的影響。分別配制含有10 mM上述干擾離子以及相同濃度掩蔽試劑的氨溶液(0.1 mM)按相同的實驗方法顯色,并測定其吸光度,以此來消除干擾離子對測定氨含量造成的影響。如果加入掩蔽劑濃度不同于干擾離子,在圖中以×X表示,代表所用掩蔽劑濃度為干擾離子的X倍。
1.7 樣品測定
1.7.1 已知濃度氨溶液測定
準確量取1.25 mL,0.2 mM標準氨溶液,加入1.25 mL去離子水于5 mL試管中。然后取0.6 mL以上氨溶液,依次加入1.9 mL去離子水、水楊酸鈉溶液0.4 mL、硝普鈉溶液0.025 mL、次氯酸鈉溶液0.025 mL。在室溫下反應1.5 h,并測定其吸光度,通過以上標準曲線計算氨含量。平行測定3次,取平均值,計算相對偏差。
1.7.2 環境水樣測定
取不同環境中的2種真實水樣(西安科技大學臨潼校區校內湖及曲江池),經過簡單過濾處理。取0.6 mL以上水樣,依次加入1.9 mL去離子水、水楊酸鈉溶液0.4 mL、硝普鈉溶液0.025 mL、次氯酸鈉溶液0.025 mL。在室溫下靜置1.5 h,待顯色完全測定其吸光度,計算水樣中的氨含量。各樣品分別平行測定7次,然后根據標準曲線計算得到各樣品中的氨含量,求取平均值為真實水樣中的氨含量(C0)。
1.7.3 回收率測定
采用加標回收實驗測定回收率[22],在上述水樣中加入0.1 mM(C1)的氨標準溶液,按相同方法顯色,測定吸光度,計算加標后濃度(Cx)按下列公式計算回收率P∶P=(Cx-C0)/C1×100%。
2 結果與討論
2.1 標準曲線的繪制
不同氨含量的標準溶液顯色以后測定紫外可見吸收光譜結果如圖2(a)所示。可以發現所有樣品的紫外可見吸收光譜在671 nm出現最大吸收峰,且吸光度隨樣品氨濃度增加而增加。以氨含量(mM)為橫坐標,以671 nm處的吸光度數值為縱坐標繪制氨的標準工作曲線,結果如圖2(b)所示。其R2=0.999 34,說明靛酚藍顯色法具有良好的線性關系。經過分析計算,得到該方法的檢出限為0.010 5 mM,線性范圍為0.032 ~ 0.32 mM。
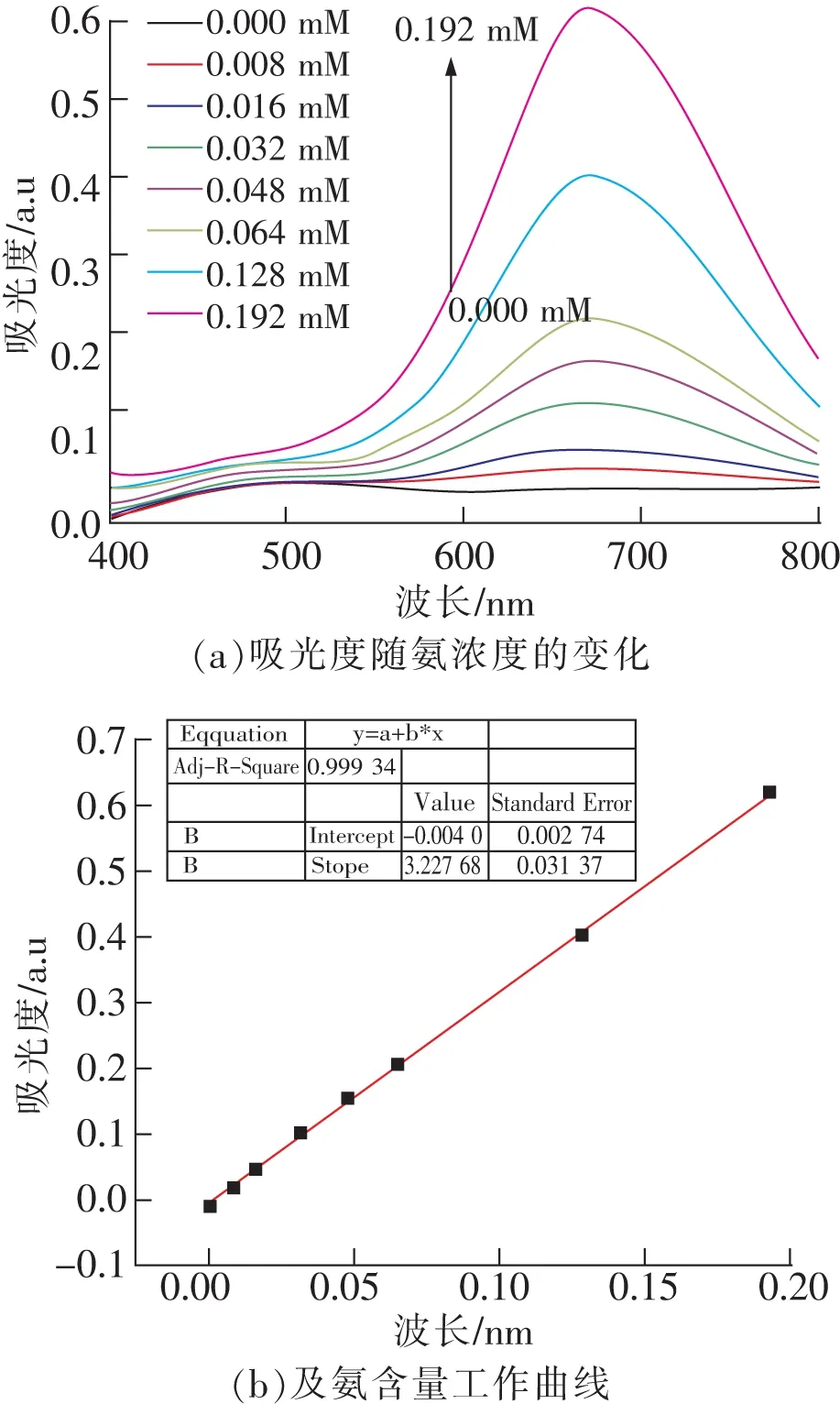
圖2 吸光度隨氨濃度的變化(a)及氨含量工作曲線(b)
2.2 干擾實驗結果分析
為檢驗不同金屬離子對氨含量測定的干擾情況,在共存干擾離子(Ag+,Al3+,Ni2+,Ca2+,Co2+,Cu2+,Fe3+,Zn2+,Mg2+,Mn2+,Cd2+)濃度為氨濃度的100倍或干擾離子(Li+,Na+,K+)的濃度為氨濃度的1 000倍情況下分別測定已知氨濃度溶液的吸光度,經過回歸方程計算的氨濃度與無干擾(空白)氨濃度測定值的偏差如圖3所示。
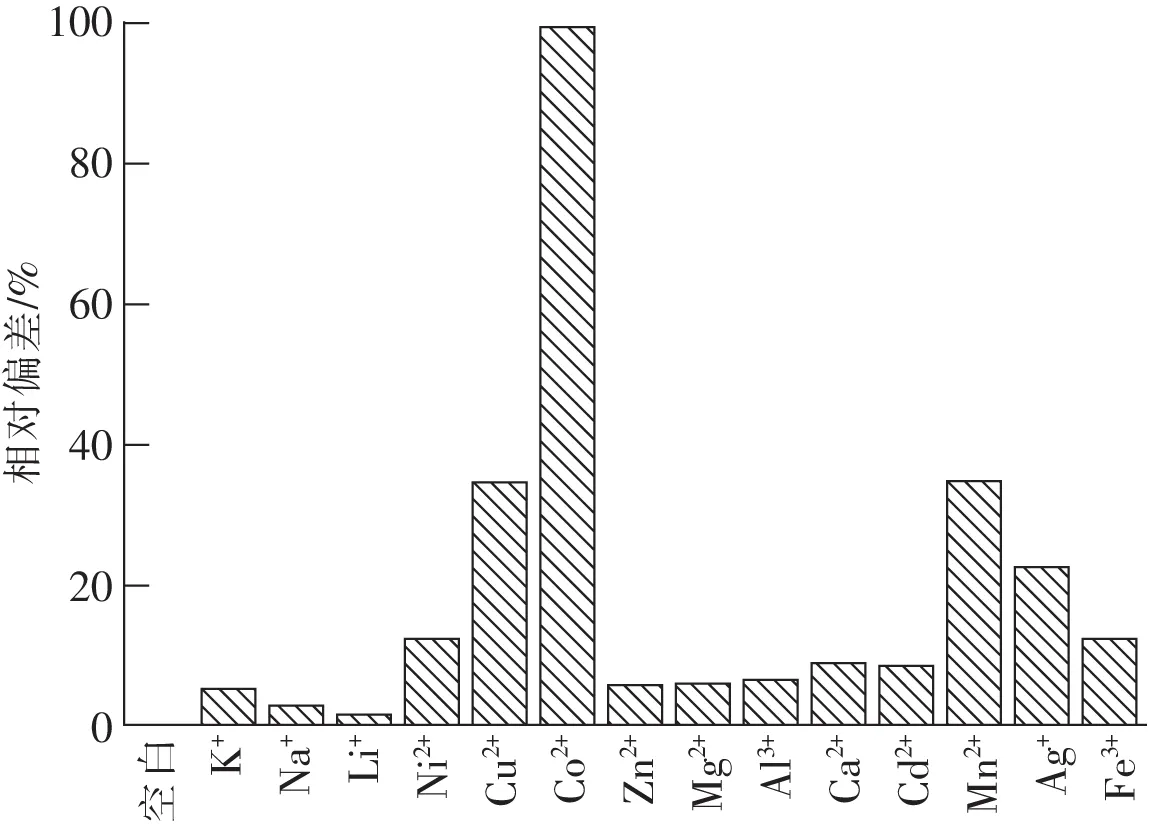
圖3 在不同金屬離子存在下氨測定的相對偏差
從圖3可知,絕大多數離子(Li+,Na+,K+,Zn2+,Mg2+,Al3+,Ca2+,Cd2+)對氨含量測定的干擾小于10%;只有部分離子(Ni2+,Cu2+,Co2+,Mn2+,Ag+,Fe3+)對氨測定的干擾大于10%。其中Co2+離子對測定結果的干擾最為明顯,偏差達到99.37%。考慮到實驗精度的要求,認為干擾離子引起的偏差大于10%即為存在干擾。由此可知,Ni2+,Cu2+,Co2+,Mn2+,Ag+,Fe3+離子對測定水中氨含量產生較大干擾,為了消除這些離子對氨測量的影響,需要加掩蔽劑對其進行掩蔽。
2.3 掩蔽實驗結果分析
2.3.1 干擾離子掩蔽實驗
實驗采用常見試劑分別對Ni2+,Cu2+,Co2+,Mn2+,Ag+,Fe3+離子進行掩蔽,結果如圖4所示。
從圖4(a)可以看出,EDTA,Na2SO4對Mn2+離子掩蔽效果明顯,掩蔽后的氨測定偏差分別減小到9.345%,8.227%;從圖4(b)可以看出,EDTA,NaOH,H3PO4,NaF,KMnO4(H+)、磺基水楊酸(C7H6O6S),Na2SO4對Fe3+離子掩蔽效果明顯,掩蔽后的氨測定偏差分別減小到8.099%,9.968%,0.623%,6.230%,0.934%,4.049%,5.607%;從圖4(c)可以看出,酒石酸(PST)、Na2CO3對Co2+離子掩蔽效果明顯,掩蔽后的氨測定偏差分別減小到4.984%,2.492%;從圖4(d)可以看出,Na2CO3,EDTA,K3[Fe(CN)6],Na3PO4,Na2SO4對Ni2+離子掩蔽效果明顯,掩蔽后的氨測定偏差分別減小到3.115%,4.984%,0.3115%,2.492%,9.657%;從圖4(e)可以看出,Na2CO3,Na3PO4,KMnO4(H+)對Cu2+離子掩蔽效果明顯,掩蔽后的氨測定偏差分別減小到9.960%,1.557%,5.60%;從圖4(f)可以看出,Na2CO3,NaOH,鄰菲羅啉(PTL)、Na3PO4對Ag+離子掩蔽效果明顯,掩蔽后的氨測定偏差分別減小到0.311 5%,2.180%,1.550%,9.345%。
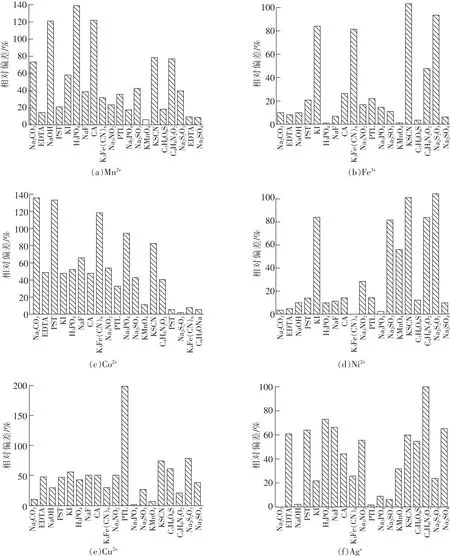
圖4 常見試劑對干擾離子的掩蔽效果
2.3.2 掩蔽試劑的干擾分析
為進一步驗證掩蔽方案的可靠性,我們測試了對干擾離子有掩蔽效果的EDTA等12種掩蔽試劑對氨測定的干擾情況,結果如圖5所示。
從圖5可知,絕大多數掩蔽試劑H3PO4,NaF,PTL,PST,C7H6O6S,Na2CO3,Na2SO4等對氨測定的干擾小于10%,而K3[Fe(CN)6],KMnO4(H+),Na3PO4這些掩蔽劑自身對水中氨含量測定存在嚴重干擾,其引起氨測定偏差分別為71.96%,26.49%,10.90%,由于自身干擾較大掩蔽劑不能用于離子掩蔽實驗,為確保實驗的精確度和可靠性,應該優先選擇干擾較小的掩蔽劑。
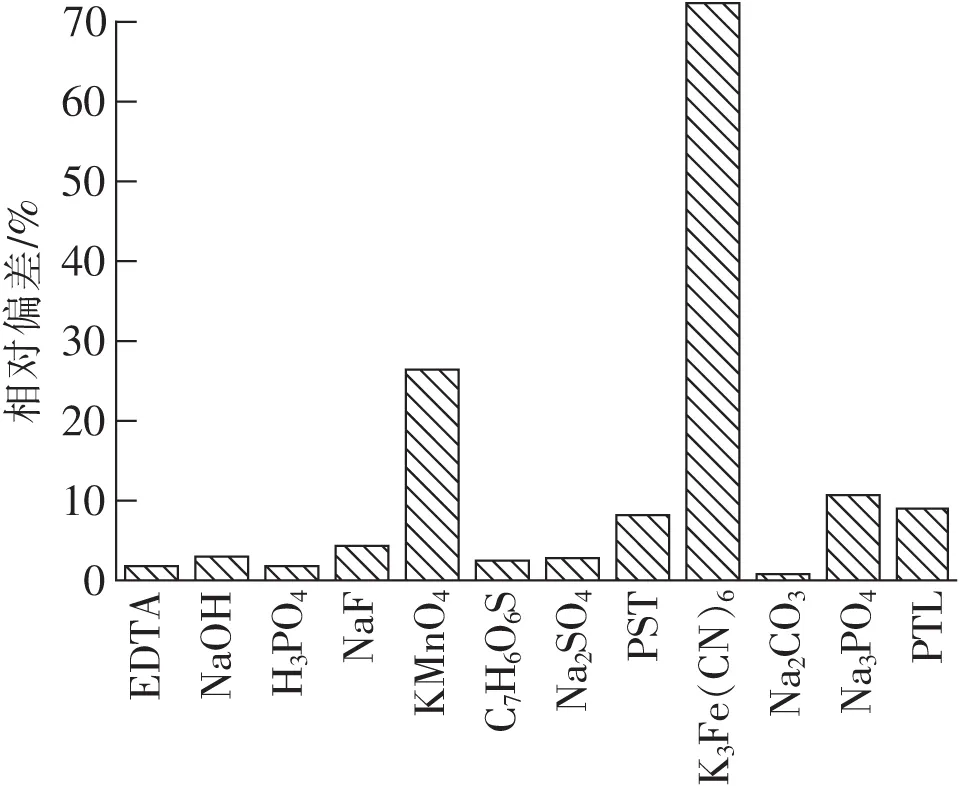
圖5 掩蔽劑對測定結果的干擾
從以上干擾掩蔽實驗的結果發現,Co2+,Ni2+,Cu2+,Ag+離子都可以通過分別加入Na2CO3掩蔽消除干擾,而Mn2+,Fe3+離子分別可以通過加入Na2SO4,H3PO4掩蔽消除干擾。
2.4 方法評價
2.4.1 已知濃度的氨測定
為評估該方法的可靠性,對已知濃度的氨溶液進行了3次平行測定,實驗結果見表1。
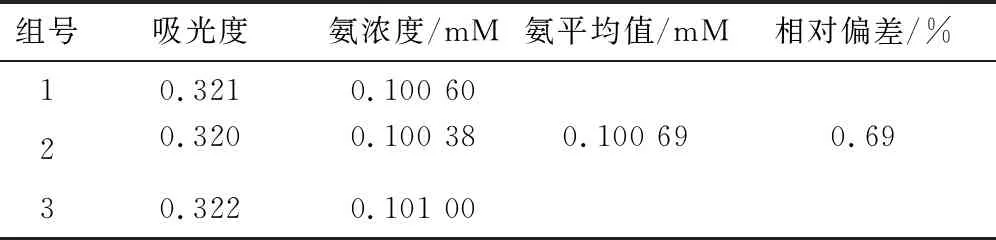
表1 已知氨濃度溶液測定結果
表1所示為對已知濃度為0.100 00 mM氨溶液的3次平行測定結果,求得平均值為0.100 69 mM,相對偏差為0.69%,小于1%證明該方法有較高的準確度。
2.4.2 環境水樣測定
為進一步驗證此方法的可靠性,采用加標回收法測定真實水樣氨含量的回收率,結果見表2。
由表2可知,用靛酚藍法測定西安科技大學臨潼校區校內湖水樣和曲江池水樣的回收率分別為101.09%和95.91%,符合定量分析的要求,并且曲江水樣氨含量比臨潼水樣氨含量高。
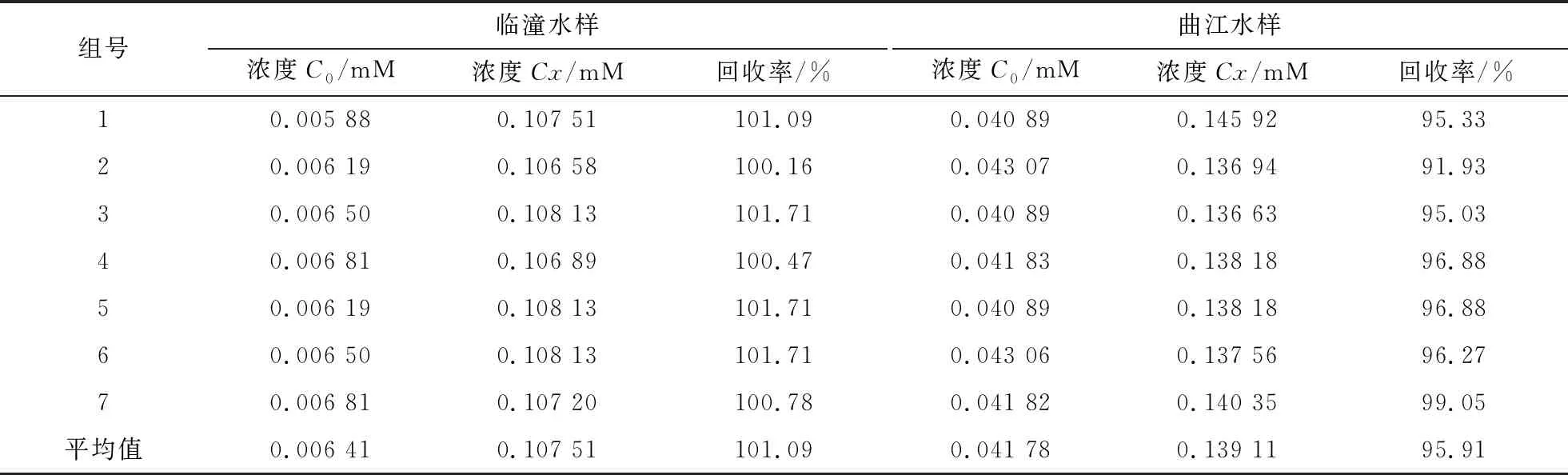
表2 加標回收率的測量結果
3 結 論
該論文采用靛酚藍顯色法測定了水樣中的氨濃度,詳細研究了常見金屬離子對測定結果的干擾情況,并對強干擾離子采取了試劑掩蔽措施。在大量實驗的基礎上,發展了對影響氨測定金屬離子的掩蔽方案。該論文提出的氨測定及干擾離子掩蔽方案在常溫常壓下的光電催化合成氨催化劑評價對環境水體富營養化控制等領域具有一定的指導意義和應用前景。

