庫欣病的1例報告
李嬌嬌,王嘉熙,奚悅
(1.錦州醫科大學附屬第三醫院;2.錦州醫科大學醫療學院,遼寧 錦州 121000)
庫欣病(cushing’s disease,CD)是由于垂體促腎上腺皮質激素(adrenocorticotropic hormone,ACTH)分泌亢進導致腎上腺分泌過多皮質醇所引起的臨床類型[1],其手術方案首選經蝶垂體腺瘤切除術。近年來,庫欣病的診療體系快速發展,ACTH依賴性垂體腺瘤的定位也不斷完善,但實際上在術中未能探查到實質性庫欣病病例數占5%~20%,同時,垂體腺瘤也存在手術不徹底的情況,65%~96%可以在術后緩解,但在5年后約5%~10%患者復發[2-3]。對于手術失敗后持續或復發的患者,可以選擇藥物治療。現分析我院收治的1例庫欣病的診治過程,并復習相關文獻,總結其術后的情況。
1 病例資料
1.1 一般情況
患者,女,65歲,因“頭暈2年,乏力、視物模糊、臉變圓8月,垂體瘤術后4月”于2014年10月27日入錦州醫科大學附屬第三醫院。患者2年前始出現活動后頭暈,血壓增高(具體不詳)。逐漸出現乏力、視物模糊,同時出現臉變圓紅、腹圍增加、四肢變細、上唇小須。既往高血壓病史3年,血壓最高207/80 mmHg,口服拜新同降壓;糖尿病病史1年,應用胰島素控制血糖;2014年6月于北京協和醫院行垂體瘤微創手術治療;術后皮質醇再次升高,故來診。既往有糖尿病、高血壓病家族史。體格檢查:體溫36.0 ℃,脈搏80次/分,呼吸20次/分,血壓185/94 mmHg,精神不振,滿月臉,多血質外貌,向心性肥胖,皮膚略菲薄,唇上小須,甲狀腺無腫大,雙肺呼吸音粗,可聞及干濕羅音,心、腹體格檢查均無明顯異常。雙下肢輕度可凹性水腫,雙足背動脈搏動減弱。結合該患者臨床癥狀及ACTH、皮質醇明顯升高等輔助檢查結果,臨床診斷為:(1)皮質醇增多癥(庫欣綜合征),庫欣病,垂體瘤術后;(2)兩側肺炎;(3)低蛋白血癥。患者入院后復查ACTH、皮質醇暫時恢復正常,癥狀明顯緩解,口服補鉀、抗炎、降壓、胰島素控制血糖等對癥支持治療后,于2014年12月16日出院。術后半年復查皮質醇再次增高,口服酮康唑抑制皮質醇合成,定期復查皮質醇,出現腎上腺減退癥,于2015年停藥,其后每10 d口服1次潑尼松,同時口服氯化鉀緩釋片、護肝片、注射胰島素控制血糖,其后復查皮質醇、血鉀濃度均在正常范圍。
患者定期隨訪,于2017年9月29日、2018年6月20日、2019年3月11日檢查血常規、肝功、腎功、血脂、離子(鈉氯、鈣磷鎂)、空腹C肽、HIV及甲狀腺功能三項均正常。復查ACTH(8:00):38.67 ng/L、12.97 ng/L、15.67 ng/L,垂體增強MRI:垂體術后改變,副鼻竇內滲出性病變;腎上腺增強CT:考慮右側腎上腺體部占位,腺瘤。患者再次出現皮質醇增高及頭暈、乏力癥狀,不除外腎上腺瘤導致的病情反復,可考慮雙側腎上腺切除、垂體直線加速器治療,交代病情,患者拒絕手術,選擇保守治療。2019年12月5日、2020年1月6日復查,患者出現腎上腺皮質功能減退癥,甲潑尼龍糾正腎上腺低功,在治療過程中,腎上腺皮質功能亢進、減退及緩解,血鉀降低與正常交替出現。給予護肝片保肝、胰島素降糖、硝苯地平片降壓、補鉀,間斷給予酮康唑及甲潑尼龍等對癥治療。隨訪至2020年10月13日,皮質醇、血鉀恢復正常。
1.2 輔助檢查
肝臟功能、腎臟功能、甲狀腺功能、空腹C肽及動脈血氣分析正常,白蛋白33.6 g/L,ACTH(8:00、16:00、0:00):97.20 ng/L(10.00~80.00 ng/L,括號內為正常值參考范圍,以下相同)、83.50 ng/L(5.0~40.0 ng/L)、97.60 ng/L(5.0~10.0 ng/L),胸部CT:慢性支氣管炎,兩肺炎癥,右肺中葉肺不張,左肺上葉慢性炎癥。
1.2.1 內分泌學檢查,見圖1。
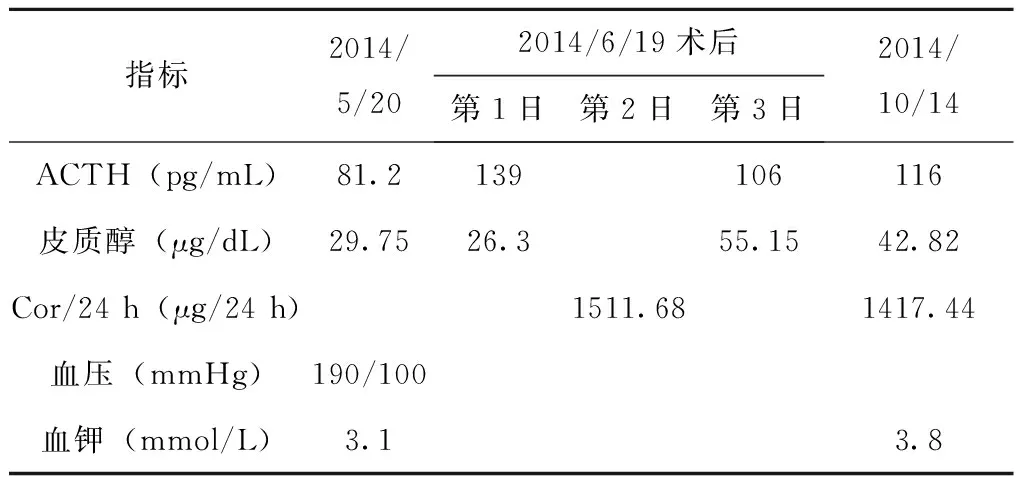
表1 北京協和醫院輔助檢查結果
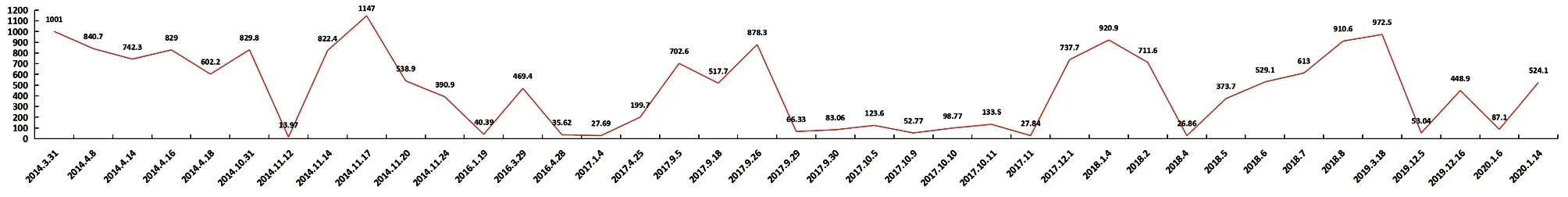
皮質醇:171~536 nmol/L
1.2.2 代謝紊亂證據
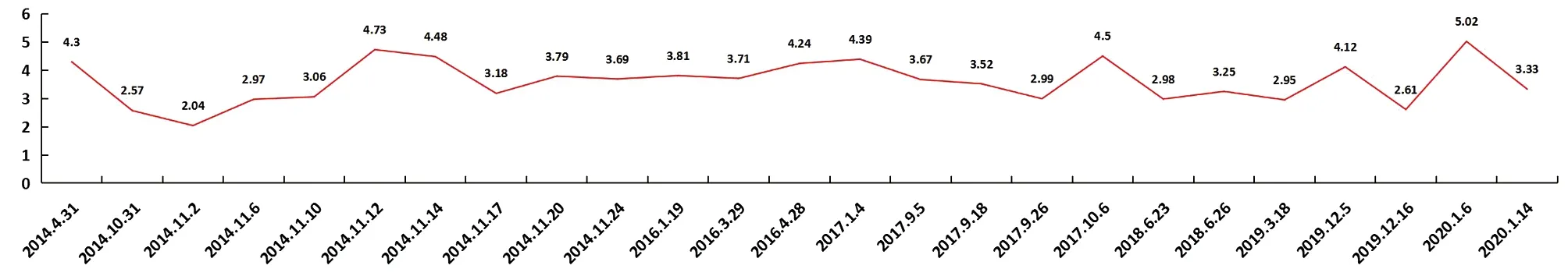
血鉀:3.5~5.5 mmol/L
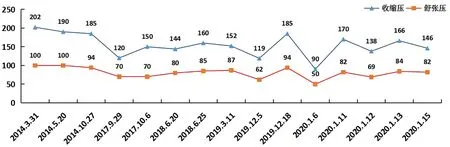
圖3 血壓波動情況(mmHg)
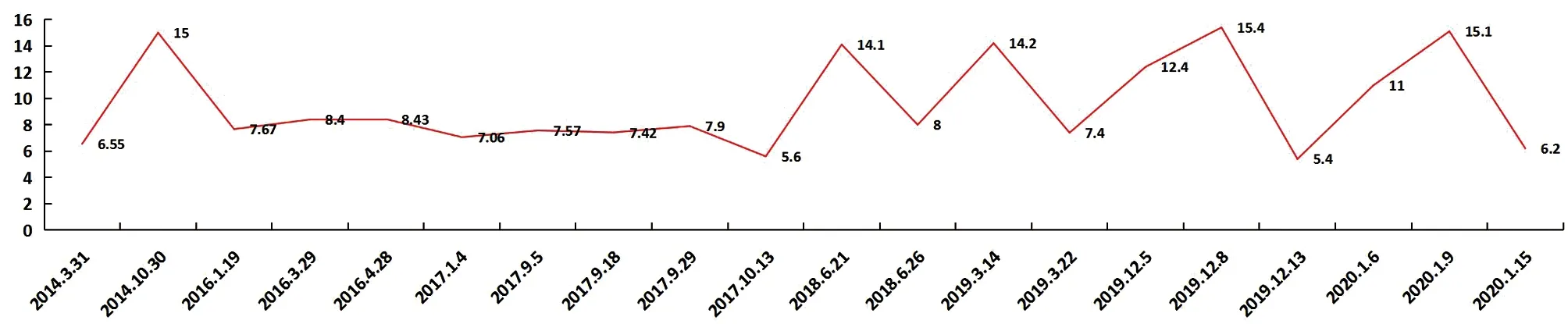
圖4 空腹血糖波動情況(mmol/L)
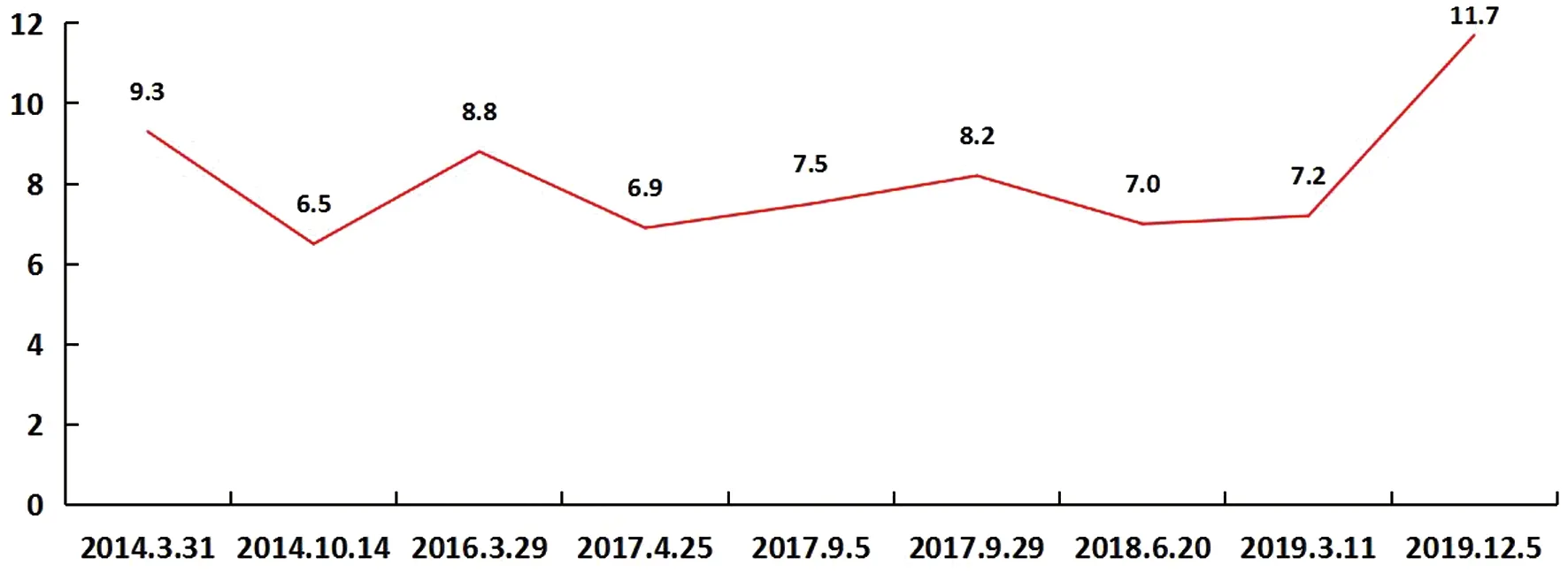
圖5 糖化血紅蛋白檢測結果觀察(%)
1.2.3 動態功能測定(北京協和醫院)。
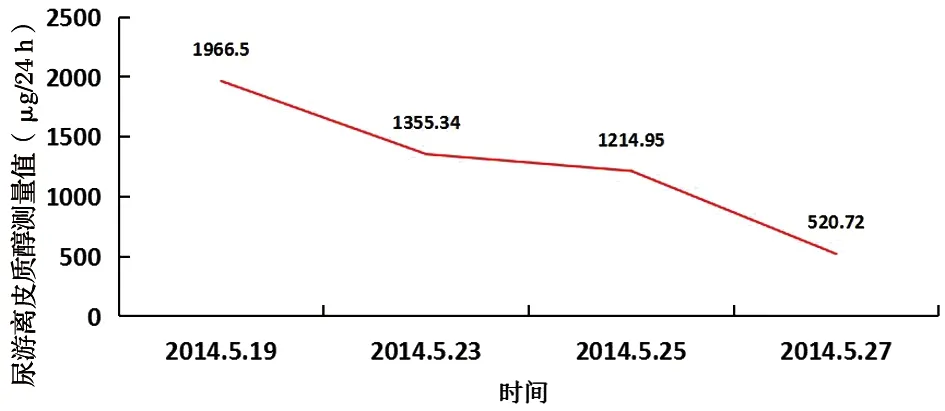
注:2014/5/19及5/23為對照值;5/25為地塞米松0.5mg(2:00、8:00、14:00、20:00)第2日;5/27為地塞米松2 mg(2:00、8:00、14:00、20:00)第2日
1.2.4 影像學檢查
垂體增強MRI:垂體左側3 mm×6 mm垂體微腺瘤(白箭頭),見圖7a;腎上腺增強CT:雙側腎上腺增生,雙側腎上腺寬度超過同層面膈肌腳寬度(白箭頭),見圖7b;PET-CT:蝶鞍擴大,垂體正中偏后代謝增高灶,考慮為垂體瘤可能,見圖7c;病理活檢及免疫組化結果顯示:ACTH(+)、GH(+)、LH(+)、PRL(+)、TSH(部分+)、FSH(-)、p53(-)、ki-67(index約1%),見圖7d。
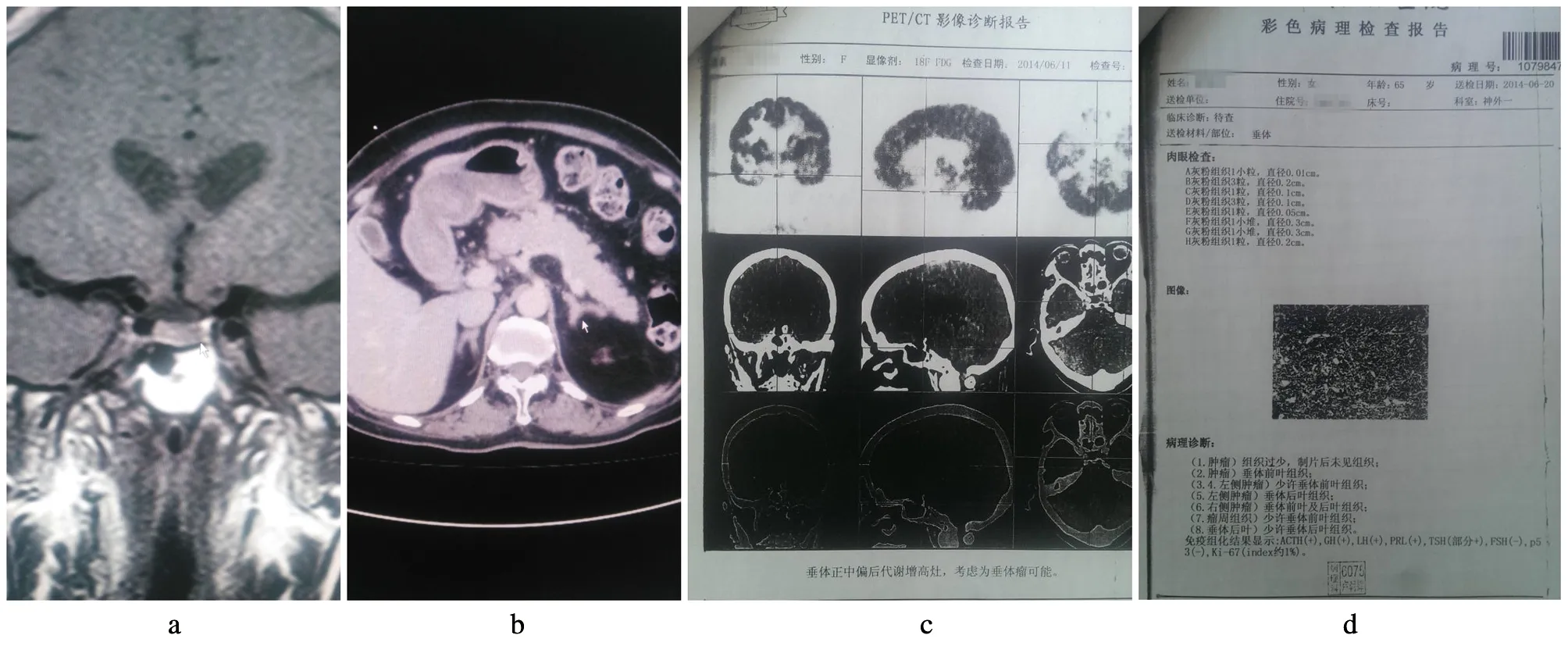
a:垂體增強MRI;b:腎上腺增強CT;c:PET-CT;d:病理活檢及免疫組化
2 討 論
庫欣綜合征(cushing’s syndrome,CS)是臨床上的罕見病,其每百萬人中約有1~3人發病,且女性患者較多,約為男性患者的3倍[4]。庫欣病約占庫欣綜合征的70%,且80%的患者為ACTH微腺瘤(直徑<10 mm),臨床上在切除微腺瘤后大多數患者可治愈;約10%病人為ACTH大腺瘤,伴腫瘤占位表現;少數患者垂體無腺瘤,呈ACTH細胞增生。ACTH腺瘤自主間歇性分泌和下丘腦-垂體-腎上腺軸功能紊亂導致皮質醇分泌增多,失去晝夜分泌節律[5]。大量研究表明,該病的診斷及治療不斷完善,但還存在一些問題尚未解決[6]。
本例患者老年女性,具有高血壓、低血鉀、糖尿病、精神不振,滿月臉,多血質外貌,向心性肥胖,皮膚略菲薄,唇上小須等典型的CS癥狀及體征,血皮質醇、ACTH升高明顯,皮質醇喪失晝夜分泌節律,不能被抑制小劑量地塞米松,但大劑量地塞米松能被抑制,考慮診斷為庫欣病。PET/CT檢查結果提示垂體微腺瘤,未找到其他腫瘤證據,異位ACTH綜合征被排除。庫欣病首選手術治療,如垂體腫瘤切除術、腎上腺腫瘤全切或大部切除術,術后應做垂體直線加速器放療,以降低發生Nelson綜合征的風險。有研究顯示,庫欣病腫瘤的大小和擴展程度與手術的治療效果密切相關,術前MRI的腺瘤可見度和神經外科專業知識也對手術結果產生一定的影響[7]。本病例治療方案為經單鼻孔蝶竇入路鞍區占位性病變切除術+鞍底重建術。
患者術后上述指標暫時恢復正常,大部分庫欣綜合征可經手術治療后完全緩解,然而,病情緩解半年后患者再次出現發病初期狀態,雖然病情有所改善,但血皮質醇濃度再次分泌增加。復查皮質醇,ACTH水平間斷升高,結合該患者頭暈、乏力等臨床表現,且其發病特點為自發緩解、反復發作,考慮原因:(1)手術失敗,可考慮雙側腎上腺切除、垂體直線加速器治療,交代病情,患者拒絕手術,選擇保守治療。阻滯腎上腺皮質激素合成的藥物有酮康唑、甲吡酮、米托坦、依托咪酯、卡麥角林、奧曲肽、帕瑞肽、米非司酮等。總的來說,庫欣病的藥物治療大概分為以下3類:a.作用于垂體的神經遞質類藥物如帕瑞肽;b.作用于腎上腺抑制皮質醇分泌的藥物如酮康唑;c.糖皮質激素受體拮抗劑如米非司酮[8]。腎上腺靶向藥物(酮康唑)能抑制腎上腺皮質細胞中依賴細胞色素P450的酶如17α羥化酶、11β羥化酶和膽固醇側鏈裂解酶,通過抑制腎上腺、性腺類固醇合成的多個步驟,從而抑制腎上腺合成皮質醇[9]。雖然療效確切,但不是對因治療,ACTH腺瘤仍然存在,血ACTH濃度仍是增高的。應用酮康唑治療時,應及時復查血漿皮質醇濃度,并使其保持在正常水平,避免出現腎上腺皮質功能不全;(2)垂體存在另一個ACTH瘤,間歇分泌ACTH導致皮質醇升高;(3)異位ACTH瘤導致的病情反復,異位ACTH綜合征在臨床診療過程中容易誤診為庫欣病,但是PET-CT檢查結果提示垂體微腺瘤不除外,其他部位未發現異常;(4)隨訪至2017年復查皮質醇升高,ACTH正常,考慮腎上腺瘤自主間歇性分泌引起的皮質醇升高。目前,僅僅考慮這些原因,真正的原因有待進一步發現。經與患者及其家屬溝通,下一步治療方案包括再次行垂體切除術、行腎上腺切除術或藥物保守治療,該患者垂體瘤術后病情仍然反復,且療效不佳是治療的一個難點。如果垂體存在另一個ACTH瘤間歇分泌,在行腎上腺切除術后可能會因下丘腦-垂體-腎上腺軸負反饋抑制減弱促使瘤體長大;而如果腎上腺瘤自主間歇性分泌,則再次行垂體切除術將收獲甚微[10]。我院在對患者及其家屬充分告知和交代病情后,患者拒絕二次手術,選擇保守藥物治療。現患者定期隨訪,病情較前緩解。
綜上所述,庫欣病首選經蝶垂體腺瘤切除術治療,該病例是典型的垂體瘤術后治療效果不佳,病情反復更增加了治療的難度,這時靶器官治療不失為一種選擇,即將雙側腎上腺切除+垂體直線加速器治療。由于該病的復發率較高,術后的定期隨訪至關重要。

