多孔四氧化三鐵靶向遞送尼日利亞菌素誘導細胞焦亡聯(lián)合光熱療法用于三陰型乳腺癌治療的研究
江偉,潘越,姚和瑞*,胡海*
乳腺癌在臨床上根據雌激素受體(ER)、孕激素受體(PR)、人類表皮生長因子受體-2(Her-2)的表達水平可將乳腺癌分為Luminal型、HER-2過表達型及三陰型3種分子亞型[1,2]。三陰型乳腺癌(TNBC)則因其惡行程度高、療效差、易轉移等特點預后最差[3-5]。相比其它類型乳腺癌,TNBC對靶向Her-2的靶向治療和內分泌治療不敏感,而對化療比較敏感,但盡管如此,化療的響應人群有限,預后仍然不理想。盡管對于有BRCA突變的患者可以應用PARP抑制劑,但80%以上的TNBC沒有BRCA突變。因此尋找一種新型、低毒、高效的治療策略,對TNBC的治療有著重大意義。
Fe3O4是一種磁性納米材料,又名磁鐵礦,是唯一一種被FDA批準用于生物醫(yī)學領域的金屬氧化物[6]。Fe3O4已被廣泛應用于藥物靶向遞送、磁共振成像(MRI)造影劑、熱療、DNA或蛋白質分離、生物傳感等方向[7-11]。納米載體藥物遞送技術正在不斷成熟,納米載藥遞送技術的成熟為腫瘤的精準靶向治療提供了可能。而Fe3O4則是靶向性、穩(wěn)定性良好的藥物載體,但目前國內外暫無Fe3O4負載焦亡誘導藥物(尼日利亞菌素)的相關研究報道。在我們的研究中合成形貌均一,穩(wěn)定性好,光熱轉化性能好的Fe3O4是研究的關鍵。
細胞焦亡(pyroptosis)作為一種新型的細胞程序性死亡方式,細胞焦亡的現(xiàn)象最早在上世紀90年代由Zychlinsky等[12]在感染志賀菌的小鼠的巨噬細胞中發(fā)現(xiàn),自從被發(fā)現(xiàn)以來一直備受關注。細胞焦亡的分子機制可分為依賴于Caspase-1的經典途徑和依賴于Caspase-4/5/11的非經典途徑[13,14]。Caspase的活化一方面可作用于Gasdermin蛋白,切割該蛋白產生帶C端結構域和帶N端結構域的兩段蛋白,帶N端結構域的蛋白最終可與細胞膜結合并導致細胞膜的穿孔,細胞內容物釋出[15,16]。活化的Caspase另一方面可促進IL-1β和IL-18前體的成熟,產生成熟的IL-1β和IL-18,隨細胞內容物一起釋放到胞外,并引起機體的炎癥反應[13,17]。細胞焦亡已被證實與慢性炎癥、自身免疫性疾病、神經退行性疾病、心血管疾病、艾滋病、腫瘤等多種疾病相關[18-22]。本研究中通過誘導腫瘤細胞發(fā)生焦亡的方式來治療腫瘤可能是將來腫瘤治療領域的一種潛在的治療手段。
尼日利亞菌素(nigericin,nig)可以在巨噬細胞中引起細胞焦亡[23],是一種焦亡誘導藥物。但沒有相關的研究證明在腫瘤細胞中也能同樣誘導發(fā)生細胞焦亡,然而nigericin卻被證明有抗腫瘤的效果。Liu等[24]證實了nigericin可以通過抑制大腸癌細胞中的Wnt/β-catenin信號通路來達到抑制腫瘤的生長、遷移和侵襲的效果。Hegazy等[25]表示nigericin有抑制癌癥干細胞的特性,可誘導mTORC1失活和AMPK磷酸化對人神經膠質瘤產生明顯的治療效果。本研究將從焦亡的角度來探索nigericin和腫瘤的關系。
1 材料與方法
1.1 材料
1.1.1 實驗材料 小鼠乳腺癌細胞4T1購于ATCC細胞庫。Fe3O4納米粒子(合成),尼日利亞菌素-Nigericin(InvivoGen公司)。
1.1.2 儀器 水熱釜(上海新諾儀器集團有限公司),電動攪拌器(常州方科儀器有限公司),磁力攪拌器(德國IKA艾卡公司),高分辨透射電鏡(美國FEI公司),q-PCR儀(羅氏公司),酶標儀(TECAN,瑞士帝肯)。
1.1.3 試劑 CCK-8試劑盒(APExBIO公司),RPMI-1640培養(yǎng)基(GIBCO公司),南美特級胎牛血清FBS(Biological Industries),雙抗——青霉素、鏈霉素(New Cell&Molecular Biotech),胰酶(GIBCO公司),PBS緩沖液(GIBCO公司),兔抗鼠N-GSDMD單抗(Abcam公司),HRP標記的抗兔IgG單抗(Cell SignalingTechnology公司),ECL超敏發(fā)光液(ABPBiosciences公司),RNA快速提取試劑盒(上海奕杉生物科技有限公司),5×PrimeScript RT Master Mix(TaKaRa公司),SYBR Premix Ex TaqⅡ2×(TaKaRa公司)。
1.2 方法
1.2.1 Fe3O4納米粒子的制備 FeCl3·6H2O(1.08 g,4 mmol)、檸檬酸鈉(C6H5O7Na3·2H2O)(2.35 g,8 mmol)和尿素(0.72 g,12 mmol)緩慢的溶解到80 ml的蒸餾水中,攪拌混合均勻后,然后再加入聚丙烯酰胺(0.6 g)(在攪拌的過程中緩慢加入),用磁力攪拌器劇烈的攪拌1 h。得到的混合溶液轉移到不銹鋼高壓釜中,并在200℃保溫12 h。用乙醇和去離子水的混合溶液將產物洗滌三次,洗滌后常溫真空干燥,得到固體產物,該產物不會團聚,能很好地再次溶于水溶液中,置于干燥器中保存。
1.2.2 Fe3O4納米粒子的物理表征 透射電鏡拍攝:將Fe3O4納米粒子加入純水中,超聲分散5 min使其在水中充分分散均勻,取1滴溶液滴在透射電鏡的銅網上,室溫靜置10 min,并放置恒溫烘箱中烘干,水分烘干后放置透射電鏡下觀察Fe3O4納米粒子的形態(tài)。
1.2.3 Fe3O4納米粒子負載nigericin 稱取10 mg Fe3O4于5 mL EP管A,加入2.5 mL DMSO,高功率超聲5 min至完全分散,稱取50 mg nigericin于另一5 mL EP管B,稱取5 mg多巴胺(PD)于另一5 mLEP管C中。
將溶解有Fe3O4的DMSO加入EP管B中,高功率超聲5 min至完全分散,并將混合溶液轉移至新的50 mL離心管中,在超聲振蕩下,往離心管中逐滴滴入20 mL Tris-HCl緩沖液(10 mM,pH=8.8),使溶液處于堿性環(huán)境,繼續(xù)超聲5 min。
往管C中加入2.5 mL純水溶解多巴胺,加入上述50 mL離心管中將溶液混合均勻,使用攪拌器攪拌3 h,可見溶液顏色變成黑色,得到負載完成后的Fe3O4@nigericin混合溶液。負載完成后將溶液進行分裝成10等份,以供后續(xù)實驗使用。
1.2.4 Fe3O4納米粒子的光熱性能驗證 配制不同濃度0μg/mL,25μg/mL,50μg/mL,100μg/mL,150μg/mL,200μg/mL,250μg/mL的Fe3O4溶液,連接好808 nm激光(NIR)發(fā)射器,連接好光熱成像儀,將激光器功率調節(jié)至1 W/cm2,對準Fe3O4溶液上方進行激光照射10 min,利用光熱成像儀進行拍攝記錄溫度。
1.2.5 Fe3O4納米粒子的生物相容性測定 將培養(yǎng)的4T1細胞消化下來種于96孔板,使每孔細胞數量為1000個,共設置6組,每組4~5個復孔,96孔板孔內細胞長至50%后,棄去上清,6組分別加入終濃度含0μg/mL,25μg/mL,50μg/mL,100μg/mL,150μg/mL,200μg/mL的Fe3O4溶液,置于培養(yǎng)箱培養(yǎng)24 h后,加入CCK8工作液,孵育2 h后,用酶標儀450 nm波長處檢測OD值。
1.2.6 細胞殺傷能力測定 將培養(yǎng)的4T1細胞消化下來種于96孔板,使每孔細胞數量為1000個,共設置6組,每組3個復孔,96孔板孔內細胞長至50%后,棄去上清,6組分別加入完全培養(yǎng)基,終濃度分別含5μg/mL nigericin、10μg/mL nigericin、15μg/mL nigericin、200μg/mL Fe3O4@nigericin溶液,200μg/mL Fe3O4@nigericin溶液(12 h時予以808 nm激光照射10 min)。培養(yǎng)至12 h時,第6組進行80 nm激光照射,每孔10 min,并繼續(xù)培養(yǎng)至24 h,再加入CCK8工作液,孵育2 h后,用酶標儀450 nm波長處檢測OD值。
1.2.7 細胞焦亡驗證
1.2.7.1 GSDMD蛋白western-blot 將培養(yǎng)的4T1細胞消化下來種于細胞培養(yǎng)皿中,共設置6組,6組分別加入完全培養(yǎng)基,終濃度分別含5μg/mL nigericin、10μg/mL nigericin、15μg/mL nigericin、200μg/mL Fe3O4@nigericin溶液,200μg/mL Fe3O4@nigericin溶液(12 h時予以808 nm激光照射10 min)。培養(yǎng)至12 h時,第6組進行808 nm激光照射10 min,并繼續(xù)培養(yǎng)至24 h,用ripa裂解液裂解細胞收取蛋白,并用BCA試劑盒測蛋白濃度,加入loading buffer煮沸10 min使蛋白變性,根據所測濃度等蛋白質量上樣,進行電泳,電泳完成后轉膜2 h,轉膜結束后使用5%的牛奶進行封閉1 h,TBST洗干凈牛奶后進行一抗孵育4度過夜,次日再用TBST清洗3遍,使用二抗孵育1h,再用TBST清洗3遍,進行ECL發(fā)光。
1.2.7.2 IL-1β、IL-18基因q-PCR 將培養(yǎng)的4T1細胞消化下來種于細胞培養(yǎng)皿中,共設置6組,6組分別加入完全培養(yǎng)基,終濃度分別含5μg/mL nigericin、10μg/mL nigericin、15μg/mL nigericin、200μg/mL Fe3O4@nigericin溶液,200μg/mL Fe3O4@nigericin溶液(12 h時予以808 nm激光照射10 min)。培養(yǎng)至12 h時,第6組進行808 nm激光照射10 min,并繼續(xù)培養(yǎng)至24 h,使用RNA快速提取試劑盒提取RNA,所得RNA進行測濃度,并根據濃度進行逆轉錄。所得c-DNA使用引物進行擴增,通過2-ΔΔct法計算各組的相對表達量。各引物序列為actin-F:CTCTCCCTCACGCCATC;actin-R:ACGCACGATTTCCCTCTC;IL-18-F:AAAGTTAGGTGGGGAGGGT;IL-18-R:CAGCCTCGGGTATTCTGTT;IL-1β-F:TCGCAGCAGCACATCAACAAGAG;IL-1β-R:AGGTCCACGGGAAAGACACAGG。
1.3 統(tǒng)計學分析
利用IBM SPSSStatistics 25.0對實驗數據進行統(tǒng)計學分析,計量資料以平均值±標準差(SD)的形式表示,通過單因素方差分析對多組數據進行比較,進而使用LSD方法比較兩兩比較。當統(tǒng)計結果P<0.05時認為具有統(tǒng)計學意義。
2 結果
2.1 Fe3O4納米粒子的物理表征
利用FeCl3·6H2O、檸檬酸鈉和尿素合成的Fe3O4納米顆粒,通過透射電鏡(transmission electron microscope,TEM)觀察到的結果為圖1a和b,顯示其納米顆粒整體外觀形態(tài)規(guī)則、呈現(xiàn)為球形,大小一致、分散均勻、無團聚現(xiàn)象,通過比例尺測量其粒徑約為240~250 nm,納米顆粒的內部有光線透過,表示其為內部多孔結構。在觀察Fe3O4納米顆粒具有良好的形貌后,我們將其與nigericin混合負載,并在其外表面包裹一層鹽酸多巴胺,完成后再次拍攝透射電鏡,觀察到的結果為圖1c和d,可以看出負載藥物后Fe3O4納米粒子的形態(tài)未發(fā)生變化,外觀仍然呈現(xiàn)球形,并在其外表面形成了一層膜包裹住了納米顆粒,通過比例尺測量其粒徑約為310~320 nm。

圖1 A:Fe3O4的TEM圖;B:Fe3O4的TEM圖(放大后);C:負載后Fe3O4的TEM圖;D:負載后Fe3O4的TEM圖(放大后)
2.2 Fe3O4納米粒子的光熱實驗
納米材料的光熱轉化性能決定著光熱療法的效果,因此對合成的Fe3O4納米顆粒進行光熱性能測定,將Fe3O4納米顆粒溶解于純水中,配制不同濃度25μg/mL、50μg/mL、100μg/mL、150μg/mL、200μg/mL的Fe3O4溶液,在808 nm激光器下照射10 min,并記錄溫度變化,圖2的結果顯示,808 nm的激光照射可以很好地使Fe3O4溶液升溫,200μg/mL的Fe3O4溶液4 min左右即可使溶液升至40℃以上,其升溫效率呈濃度和時間依賴性,具有良好的光熱轉化性能。
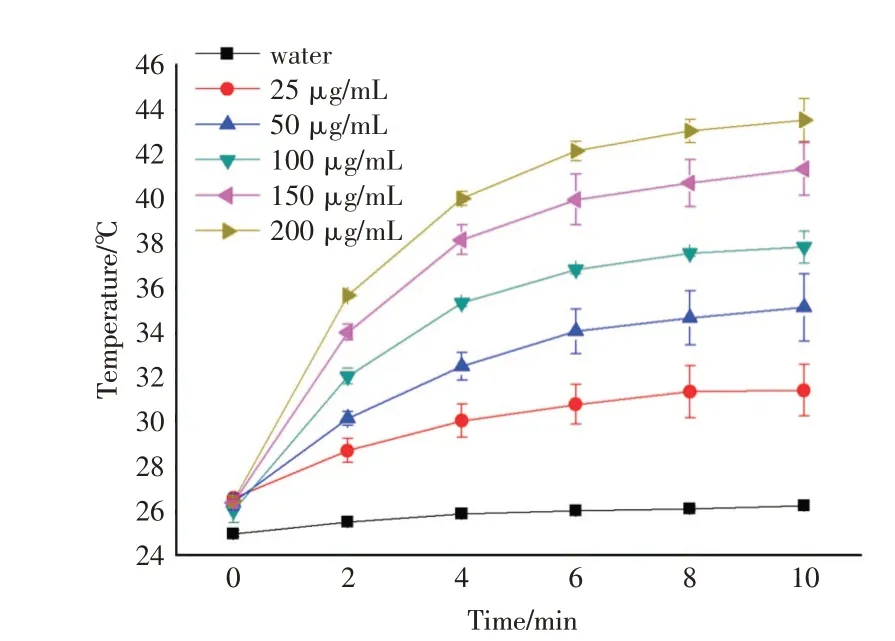
圖2 不同濃度Fe3O4溶液808 nm激光照射升溫曲線
2.3 Fe3O4納米粒子的生物相容性
納米材料的毒性往往限制了納米材料的生物應用,良好的生物相容性是其在生物體中應用的前提。測定合成的Fe3O4納米顆粒的生物相容性,將Fe3O4納米顆粒溶解于純水中,配制不同終濃度25μg/mL、50μg/mL、100μg/mL、150μg/mL、200μg/mL的Fe3O4溶液,并將不同濃度的Fe3O4溶液加入至培養(yǎng)好的4T1細胞中,共培養(yǎng)24 h,測定細胞的存活率。圖3的結果顯示,盡管隨著Fe3O4溶液濃度的增加,細胞的存活率略有降低,但最高濃度200μg/mL的Fe3O4溶液與細胞共培養(yǎng)后,細胞的存活率仍然接近90%以上,可認為其對細胞的毒性很小。
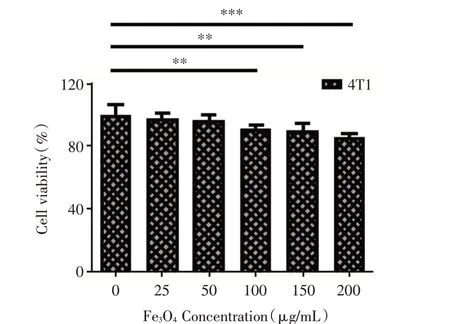
圖3 不同濃度Fe3O4溶液對4T1細胞存活率影響
2.4 細胞殺傷能力測定
在驗證了Fe3O4納米顆粒的良好的生物相容性和光熱轉化性能后,我們將其應用于細胞實驗,我們配制了對應的不同終濃度的負載藥物后的Fe3O4@nigericin溶液,與4T1細胞進行共培養(yǎng),并對其進行808 nm激光照射,測定細胞的存活率(圖4a),并計算了其對細胞的抑制率(圖4b)。結果顯示與圖3結果對比,細胞存活率明顯下降,證實了nigericin聯(lián)合光熱療法對4T1細胞有很好的殺傷效果(P<0.001)。
2.5 GSDMD蛋白western-blot
在證實nigericin聯(lián)合光熱療法具有很好的細胞殺傷性能后,我們通過western-blot來驗證細胞在被殺傷過程中是否發(fā)生了焦亡。我們在培養(yǎng)的6組細胞中分別加入完全培養(yǎng)基、終濃度分別含5μg/mLnigericin、10μg/mL nigericin、15μg/mL nigericin、200μg/mL的Fe3O4@nigericin、200μg/mL的Fe3O4@nigericin(12 h時予以808 nm激光照射10 min),24 h后收取蛋白樣品進行western-blot實驗,孵育兔抗鼠N-GSDMD單抗。圖5的結果顯示在加入nigericin和進行了光熱治療后,N-GSDMD的表達量明顯增加,細胞焦亡得到了增強,在蛋白水平證實了細胞焦亡在細胞殺傷中發(fā)揮了重要作用。

圖4 A:不同濃度Fe3O4負載藥物后聯(lián)合808 nm激光對4T1細胞存活率影響;B:不同濃度Fe3O4負載藥物后聯(lián)合808 nm激光對4T1細胞的抑制率。
2.6 IL-1β、IL-18基因q-PCR
除了蛋白水平的驗證,我們還驗證了焦亡細胞釋放的炎癥介質IL-1β、IL-18的基因水平的變化,在培養(yǎng)的6組細胞中分別加入完全培養(yǎng)基、終濃度含5μg/mL nigericin、10μg/mL nigericin、15μg/mL nigericin、200μg/mL的Fe3O4@nigericin、200μg/mL的Fe3O4@nigericin(12 h時予以808 nm激光照射10 min),24 h后收取RNA,逆轉錄后進行q-PCR擴增驗證,圖6的結果顯示對比NC組,在加入nigericin和進行了光熱治療后,IL-1β、IL-18基因的表達都有相應的增加(P<0.01),此結果與蛋白表達水平的趨勢大基本一致。
3 討論
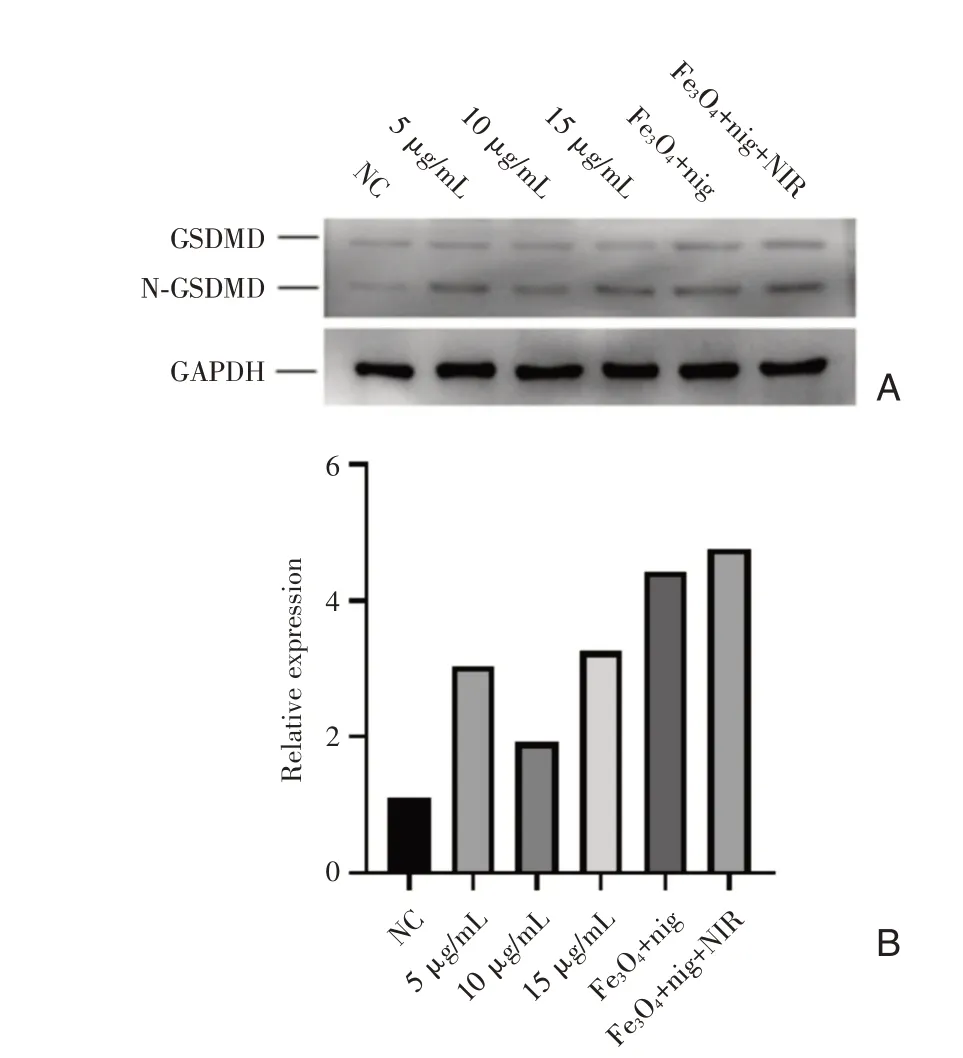
圖5 A:不同處理因素作用細胞后GSDMD蛋白的表達水平;B:western-blot實驗結果灰度分析柱狀圖
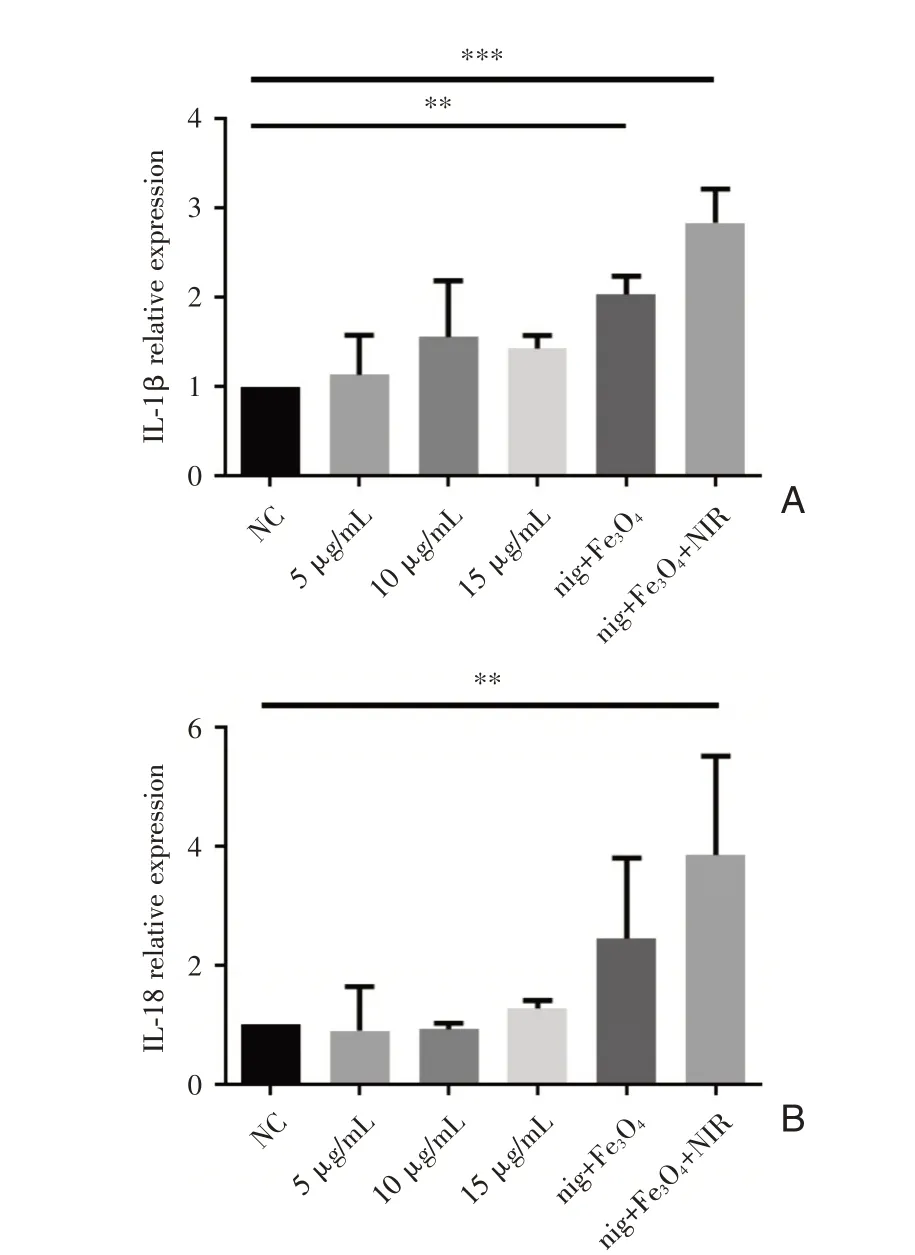
圖6 A:不同處理因素作用細胞后IL-1β基因的相對表達量;B:不同處理因素作用細胞后IL-18基因的相對表達量
乳腺癌是女性最常見的惡性腫瘤之一,其發(fā)病率正逐年升高,發(fā)病人群也在逐漸年輕化,其中三陰型乳腺癌多發(fā)生于絕經前女性,其在所有乳腺癌中占15%左右[26,27],多為中晚期乳腺癌(Ⅲ-Ⅳ),且死亡率高,在Afshin Rakhsha的研究中報道,TNBC的Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期患者5年總生存率分別為92.3%、86.5%、57.8%和9%[28]。因此鑒于傳統(tǒng)療法對TNBC的療效差的現(xiàn)狀,尋找一種新型、高效、低毒的療法是提高TNBC生存率的關鍵。本研究結果表明Fe3O4負載nigericin聯(lián)合光熱療法對小鼠三陰型乳腺癌4T1細胞具有明顯的殺傷作用。
納米材料在生物醫(yī)學領域有了多方面的應用,但往往納米材料的生物相容性制約了其的進一步應用。納米材料的毒性機制仍未十分清楚[29],但生物相容性差的納米材料會損傷體內的正常組織及細胞。Chu[30]等人的研究發(fā)現(xiàn)二氧化硅納米顆粒可以通過非特異性內吞作用進入細胞中被膜包被的細胞器中,從而影響細胞器的功能而產生毒性。Annangi[31]等人研究了氧化鋅對野生型小鼠胚胎成纖維細胞的毒性影響,發(fā)現(xiàn)僅僅1μg/mL氧化鋅即可在細胞中誘導ROS產生,進而損傷細胞的DNA。Hu[32]等人研究了氧化石墨烯納米片對A549細胞的影響,發(fā)現(xiàn)氧化石墨烯納米片可以直接與細胞膜相互作用對細胞膜產生物理損傷。我們的研究結果顯示,在Fe3O4濃度高達200μg/mL時細胞的存活率仍然接近90%,因此可認為合成的Fe3O4在不高于200μg/mL的濃度內細胞毒性很低,具備良好的生物相容性。
已有研究報道Fe3O4具有良好的光熱轉化性能,可用作光熱治療的光熱轉化劑。在Lu[33]等的Fe3O4/Au DSNFs多模態(tài)成像指導的乳腺癌治療的研究中,他們所設計的Fe3O4/Au DSNFs比游離的USIONPs有著更高的光熱轉換效率(82.7%)。Ge等[34]人的研究表明Fe3O4-R837 SP可以通過PTT激活體內先天免疫系統(tǒng)和適應性免疫系統(tǒng)來顯著增強PD-L1的全身治療效率。Yuan等[35]人在Fe3O4的表面包裹一層PEG分子形成了PEG-Fe3O4復合物,通過激光照射可明顯抑制C6細胞的活力,表明了其優(yōu)秀的光熱抗癌功效。本研究的結果顯示我們合成的Fe3O4具有良好的光熱轉化性能,與相關的文獻的報道一致。
目前已有一系列最新研究揭示了焦亡和免疫與腫瘤有著密不可分的關系。邵峰院士團隊[36]的另一重大發(fā)現(xiàn)揭示了細胞毒性淋巴細胞在發(fā)揮其作用殺傷靶細胞的過程中產生的Granzyme A可以裂解激活GSDMB,導致靶細胞焦亡,該免疫機制可以促進小鼠中CTL介導的腫瘤清除。Zhang等[37]的研究表明GSDME的表達可以增強腫瘤相關巨噬細胞對腫瘤細胞的吞噬作用,同時增強腫瘤浸潤性自然殺傷細胞和CD8+T的功能和增加其數量,該分子機制可能與腫瘤抑制相關。本研究的結果證實了我們的聯(lián)合治療模式是通過細胞焦亡的機制殺傷腫瘤細胞。然而本研究的實驗結果僅限于體外細胞實驗,在機體內是否同樣有較好的療效以及是否能通過釋放某種炎癥因子激活機體的免疫反應,有待進一步的動物實驗的驗證。
綜上所述,F(xiàn)e3O4負載nigericin聯(lián)合光熱療法可以誘導小鼠三陰型乳腺癌4T1細胞發(fā)生焦亡以達到治療TNBC的目的。本研究的相關結果能為該方向的研究提供重要的參考價值,對改善TNBC治療的現(xiàn)狀提高TNBC的生存率具有重要的意義。

