度拉糖肽對AD小鼠學習記憶減退和突觸退行性變的保護作用*
姜國晶 周 梅 俞 婧 楊 敏 劉筱涵 趙 綱 鄧艷秋
1 天津醫科大學第二醫院老年病科,天津市 300211; 2 天津醫科大學基礎醫學院生理學與病理生理學系;3 天津腫瘤醫院病理科
阿爾茨海默病(Alzheimer’s Disease,AD)是以進行性學習記憶力減退為主要臨床表現的神經退行性疾病,神經細胞外形成淀粉樣斑塊(Aβ)、細胞內見神經纖維纏結(NFTs)及神經元、軸突丟失是AD的主要病理表現[1]。神經元突觸缺失及其引起的突觸可塑性的改變在AD的早期病理變化中占有重要地位,與學習和記憶減退密切相關[2]。葡萄糖代謝異常和胰島素信號通路受損是2型糖尿病(T2DM)和AD的共同特征,AD也被稱為3型糖尿病[3]。胰高血糖素樣肽1(GLP-1)作為T2DM藥物作用的靶點,受到廣泛關注[4]。研究發現GLP-1和GLP-1受體(GLP-1R)廣泛表達于中樞神經系統,主要分布在神經元胞體和樹突上,GLP-1R基因缺失的小鼠學習記憶能力下降[5]。筆者先前報道長效GLP-1R激動劑度拉糖肽對AD樣學習記憶減退的保護作用[6],本實驗通過腹腔注射度拉糖肽,聯合應用GLP-受體拮抗劑,進一步探究度拉糖肽對散發性AD小鼠的學習記憶、突觸蛋白、CREB和Aβ的表達及對神經細胞和突起的影響及其機制。
1 材料與方法
1.1 動物及分組 選取SPF級雄性野生型C57/BL6小鼠32只,9周齡。采用隨機數字表法分為對照組(CON組)、模型組(STZ組)、度拉糖肽治療組(Dul組)和度拉糖肽加抑制劑組(Ex組),每組8只。造模前小鼠常規飼養、適應環境1周。
1.2 實驗材料 度拉糖肽(禮來,上海,中國),Ex9-39(中肽,杭州,中國),Streptozotocin (STZ)(Sigma Aldrich,USA),SAP97、SP11抗體(Thermo Fisher Scientific,USA) Aβ1-42、p-CREB抗體、辣根過氧化物酶標記的羊抗小鼠和IgG羊抗兔IgG(Abcam,UK)。無菌度拉糖肽制備:將1.5mg/0.5ml度拉糖肽放于超凈臺內,取其中0.5ml放入無菌離心管中,4℃無菌條件下保存。腹腔注射時將度拉糖肽與無菌生理鹽水混合稀釋。
1.3 動物處理和取材 于STZ組、Dul組和Ex組小鼠雙側腦室內注射STZ(3mg/kg體質量),以建立散發性AD模型。注射后21d,Dul組小鼠腹腔注射度拉糖肽,Ex組小鼠注射度拉糖肽和Ex9-39,CON組和STZ組給予等量無菌生理鹽水,均持續注射4周。嚴格遵守《實驗動物管理條例》進行實驗。水迷宮實驗完成后,小鼠斷頭處死,冰上迅速取腦,取右半腦放入離心管中-80℃凍存用于蛋白免疫印跡實驗,左半腦部分固定于4%中性甲醛溶液中用于尼氏染色和高爾基染色。
1.4 學習記憶能力行為測試 自度拉糖肽注射后23d起對小鼠進行學習記憶能力行為學測試,采用Morris水迷宮實驗。選取四個象限中點為四個入水點,分別進行以下檢測:(1)定位航線實驗:將4組小鼠隨機從3個不同象限面向池壁放入水中,分別記錄60s內小鼠尋找到平臺的時間(逃避潛伏期)及其游泳路徑。若小鼠于60s內成功找到平臺,記錄實際逃避潛伏期;若60s內未找到平臺,則將逃避潛伏期記為60s,而后研究者手動將小鼠放到平臺上并停留30s;每次實驗時間為4d,4次/d,路徑相同。(2)空間搜索試驗:于步驟(1)后次日進行,撤除平臺,將各組小鼠分別從第一象限相同入水點面向池壁放入水中,統計小鼠60s內在原平臺象限內的停留時間。
1.5 小腦組織SAP97、SP11、CREB和Aβ1-42表達檢測 采用Western blot法。取各組小鼠凍存腦組織,冰浴下勻漿,而后4℃、16 000r/min離心10min,取上清液,常規進行SDS-PAGE凝膠電泳,提取蛋白并轉移至聚偏二氟乙烯(PVDF)膜,室溫下于脫脂牛奶中封閉30min,而后分別加入抗SAP97、SP11、p-CREB、CREB和Aβ一抗,4℃孵育過夜,TBST洗膜,加入辣根過氧化物酶標記的山羊抗小鼠或兔二抗,室溫孵育1h,TBST洗膜。將PVDF膜置于掃描儀內,ECL顯色。以β-actin為內參。
1.6 尼氏染色 對各組小鼠腦組織切片,脫蠟、復水后,置于尼氏染色液中,于56℃浸染1h。雙蒸水清洗,分化液中分化,無水乙醇脫水,二甲苯透明,中性樹膠封片,于普通顯微鏡下觀察染色情況并拍照。
1.7 高爾基染色 按試劑盒說明書完成。取2mm厚已固定腦組織,放入3.5%重鉻酸鉀溶液中1周,每天定時換液。1周后采用雙蒸水溶液洗凈組織塊,放入1.5%AgNO3雙蒸水溶液中浸銀5d,每天換液1次,常溫避光保存。梯度乙醇脫水,二甲苯透明,石蠟包埋,連續切片,每隔5張取1張,厚度為50μm。脫蠟、封片。
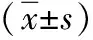
2 結果
2.1 度拉糖肽改善AD小鼠的學習記憶能力 在前4d水迷宮定位航行實驗中,與CON組相比,STZ組小鼠的逃避潛伏期增大,Dul組同STZ組小鼠相比,逃避潛伏期縮短,而Ex組小鼠的逃避潛伏期與STZ組的數據接近(圖1a)。在空間探索實驗,STZ、Ex組小鼠在目標象限的游泳時間比CON組明顯減少, Dul組小鼠在目標象限的游泳時間比STZ組小鼠明顯增加(圖1b)。各組小鼠游泳速度無明顯差異,隨著訓練次數的增加,CON組和Dul組小鼠從盲目的隨機式和邊緣式尋找平臺轉變為有目的直線式變化,而STZ和Ex組小鼠軌跡轉變不明顯(圖1c)。這些結果提示度拉糖肽可能通過GLP-1受體改善AD樣小鼠的空間學習記憶能力。

圖1 小鼠Morris水迷宮實驗
2.2 度拉糖肽提高小鼠腦組織神經突觸蛋白的表達水平 與CON組相比,STZ、Ex組小鼠腦組織SAP97和SP11表達量下降,與STZ、Ex組相比,Dul組小鼠腦組織兩種蛋白的表達升高(圖2)。


圖2 小鼠腦組織中突觸相關蛋白Western Blotting結果
2.3 度拉糖肽促進小鼠轉錄調節因子CREB的表達,減少Aβ的產生 轉錄調節因子CREB與調節突觸可塑性和學習記憶的形成密切相關,β-actin為內參,同CON組相比, STZ和Ex組小鼠腦組織CREB磷酸化的水平下降,Aβ1-42水平增加。與STZ組相比,Dul組小鼠CREB磷酸化修飾水平上升,Aβ聚集水平下降(P<0.05),提示度拉糖肽可能通過GLP-1受體改善AD樣小鼠腦內CREB的活性和減少Aβ聚集(圖3)。

圖3 小鼠腦組織內CREB蛋白和Aβ的Western Blotting結果
2.4 度拉糖肽改善AD樣小鼠腦組織神經細胞的功能活性 CON組小鼠海馬CA2區和皮質神經元細胞排列密集、整齊,胞漿中可見豐富尼氏體,呈深藍色,細胞核藍染,著色較深;STZ、Ex組小鼠海馬CA2區和皮質神經細胞數量減少,細胞漿中尼氏體數量少,呈空泡狀,染色較淺;而Dul組小鼠腦組織海馬CA2區和皮質神經元細胞尼氏小體比STZ組和Ex組有明顯改善(圖4)。


圖4 小鼠腦組織尼氏染色
2.5 度拉糖肽改善AD樣小鼠的神經突起 高爾基染色示,CON組中錐體細胞呈錐體形或三角形,油鏡下可見樹突和棘突枝干粗大、豐富,二者排列錯綜復雜;STZ、Ex組樹突和棘突斷裂,分支減少,枝干纖細;Dul組樹突和棘突較STZ組和Ex組明顯豐富粗大(圖5)。

圖5 小鼠大腦皮質神經元的高爾基染色圖片
3 討論
小鼠腦室注射STZ是制備散發性AD動物模型的常用方法。本研究結果顯示,STZ處理小鼠的學習和記憶能力較CON組小鼠明顯減退,與筆者之前其他研究者的報告一致[7],而度拉糖肽通過GLP-1受體明顯改善了模型小鼠的學習記憶能力。腦內GLP-1與GLP-1R結合可激活GLP-1信號,可通過腦—腸—GLP軸抑制食欲,調節神經元軸突生長及海馬神經元回路活性、上調酪氨酸羥化酶活性、促進兒茶酚胺生成[8]。外源性給予GLP-1類似物能明顯提高腦組織的GLP-1的表達,影響胰島素信號并激活胰島素信號分子如cAMP-PKA和PI3K-AKT途徑[9],并調節腦內的葡萄糖代謝,AD患者認知能力下降與其腦內胰島素抵抗、葡萄糖代謝失調等密切相關,GLP-1信號減弱參與認知功能減退和AD神經退行性變,而長效的度拉糖肽可能通過提高胰島素信號和糖代謝改善模型小鼠的學習記憶能力。
神經元突觸缺失和突觸可塑性變化是AD早期病理變化,在AD學習和記憶功能障礙發病中起重要作用。突觸蛋白是突觸可塑性的結構基礎,突觸相關蛋白97參與控制神經突觸受體密度和信號強度,突觸小泡蛋白存在于突觸前成分的突觸囊泡膜上,可間接反映突觸的數量、分布和密度,常用作突觸密度的標志物[10]。筆者在實驗中發現兩種蛋白的表達在STZ組明顯降低,伴有CREB的活性減低和Aβ1-42的增加,且在尼氏和高爾基染色可以明顯觀察到尼氏小體的減少和神經突起的減少包括樹突縮短和樹突棘的明顯減少。研究發現:Aβ1-42通過降低樹突棘密度,引起神經元損失,進而影響突觸可塑性,使與記憶相關的突觸功能受損[11]。既往研究[12]發現,早期AD的組織病理學表現為神經元樹突棘、突觸數量減少,且突觸蛋白水平下降早于突觸數量減少,進而突觸功能受損,降低神經遞質傳遞效率,進而導致Aβ沉積于突觸內,產生神經毒性,進一步損傷突觸可塑性,最終進展為神經退行性變和認知障礙。動物研究發現,Aβ過度表達可抑制突觸蛋白Syn、PSD-95表達。CREB是一種選擇性結合CREs 的核蛋白的轉錄增強因子。主要對PKA等信號發生應答反應。未經磷酸化的CREB主要存在于核內,cAMP激活PKA后,活化PKA進入細胞核,使CREB磷酸化,調節靶基因的轉錄,這些基因與記憶的形成有關。其中CREB 的133 位絲氨酸殘基(Ser133) 對CREB的轉錄活性起著重要作用[13]。有研究[14]報道,GLP-1類似物利拉魯肽可促進AKT磷酸化,提高cAMP水平,同時可抑制GSK3β磷酸化及神經細胞凋亡。DPP4抑制劑西格列汀調高GLP-1的水平,提高突觸相關蛋白97、突觸蛋白-1、突觸小泡蛋白和PSD95在3×Tg小鼠腦組織中表達下調,與改善CREB的活性相關[15]。因此,度拉糖肽可能通過提高GLP-1受體調節cAMP、PI3K/AKT等信號分子,影響CREB ser133的磷酸化,活化的CREB進一步改變基因的轉錄,提高小鼠腦組織突觸相關蛋白轉錄和合成,減少Aβ的沉積,增強突觸可塑性,從而達到神經保護的作用。
因此,長效GLP-1R激動劑度拉糖肽可能通過GLP-1受體,調節CREB的活性,減少AD樣小鼠腦內Aβ沉積,增加突觸蛋白的表達水平和突觸的長度,進而改善神經細胞的突觸退行性病變,提高小鼠的學習記憶能力,其機制需進一步深入研究。

