血清同型半胱氨酸水平和亞甲基四氫葉酸還原酶、甲硫氨酸合成酶還原酶基因多態性與胎盤缺血性疾病的相關性
鄭媛珂,有風芝,石巍,胡亞琪,魏心怡
胎盤缺血性疾病(ischemic placental disease,IPD)是導致不良妊娠結局的主要因素,主要包括子癇前期、胎盤早剝及胎兒生長受限(fetal growth restriction,FGR)這3種疾病[1],是引起胎兒死產、早產、出生缺陷及新生兒神經系統發育不良的重要原因,且半數以上的早產是由IPD引起的[2],因此該病的早期預測及孕期管理策略至關重要。目前研究認為子宮螺旋小動脈重鑄障礙、胎盤滋養細胞侵襲力下降導致的胎盤缺血和功能障礙是其共同的病理生理基礎[3]。而亞甲基四氫葉酸還原酶(methylenetetrahydrofolate reductase,MTHFR)和甲硫氨酸合成酶還原酶(methyltransferase reductase,MTRR)基因多態性可導致同型半胱氨酸(homocysteine,Hcy)升高,損傷血管內皮細胞,引起胎盤血管病變。本研究旨在探究血清Hcy水平及葉酸代謝酶MTHFR、MTRR基因多態性與IPD的相關性。
1 資料與方法
1.1 研究對象
選取2017年1月至2019年10月在鄭州大學第三附屬醫院就診并分娩的孕產婦448例,年齡(29.6±3.1)歲。其中298例胎盤缺血性疾病患者納入病例組,分為3個研究亞組(包括子癇前期135例、FGR 90例、胎盤早剝73例)進行研究。子癇前期組中包括輕度及重度子癇前期,胎盤早剝組均為排除前置胎盤以及產后或手術后病理證實存在不同程度的胎盤早剝。子癇前期、FGR及胎盤早剝診斷標準參考《婦產科學》第9版。隨機選取同期健康孕婦150例納入對照組。所有孕婦均為單胎妊娠,排除原發性或繼發性高血壓、糖尿病、心臟病等疾病。該研究經醫院倫理委員會同意實施,所有婦女均簽署知情同意書。
1.2 方法
1.2.1 樣本DNA采集及基因檢測 采集研究對象口腔黏膜上皮細胞,使用柱式抽提試劑盒抽提樣本DNA。采用Taqman-MGB探針技術,檢測MTHFRC677T、A1298C和MTRR66G這3個位點的基因多態性,在ABI7900型熒光定量PCR檢測儀上讀取終點熒光。相關儀器、試劑均購自美國ABI公司。
1.2.2 血清Hcy檢測 采集研究對象口腔黏膜細胞當天,抽取空腹靜脈血3 mL,以3 000 r/min離心后將血清分離并保存,應用循環酶法定量檢測血清Hcy濃度,儀器為全自動干式生化分析儀(Olympus AU5400,日本),檢測試劑盒(煙臺澳斯邦生物工程有限公司),此試劑盒Hcy的正常參考值5~15μmol/L。
1.3 統計學方法
2 結果
2.1 各組孕婦的血清同型半胱氨酸水平比較
本研究3個基因位點(MTHFRC677T、A1298C和MTRRA66G)的數據均通過Hardy-Weinberg遺傳平衡實驗(P>0.05),可認為研究對象具有群體代表性。病例組的血Hcy水平為胎盤早剝組(11.00±2.58)μmol/L,FGR組(9.05±2.11)μmol/L,子癇前期組(10.28±2.31)μmol/L,均高于對照組的(6.77±1.51)μmol/L,差異有統計學意義(P<0.05)。
2.2 不同基因型下血清同型半胱氨酸水平的比較
448例研究對象中,MTHFRC677T位點TT基因型者血Hcy水平明顯高于CC型、CT型(P<0.05);MTHFRA1298C位點CC基因型的血Hcy水平明顯高于AA型(P<0.05),與AC型血 Hcy水平比較,差異無統計學意義(P>0.05);MTRRA66G位點GG基因型的血Hcy水平與AA和AG基因型比較,差異均無統計學意義(P均>0.05),詳見表1。
2.3 各組MTHFRC677T、MTHFRA1298C和MTRRA66G基因多態性位點分析比較
與對照組相比,胎盤早剝組孕婦的MTHFRA1298C基因中CC型及突變C等位基因頻率分布差異有統計學意義(P<0.05),詳見表2;FGR組孕婦的MTHFRC677T基因中TT型及突變T等位基因頻率分布與對照組比較差異有統計學意義(P<0.05),詳見下頁表3;子癇前期組孕婦的MTHFRC677T基因中CT型、突變T等位基因和MTHFRA1298C基因中CC型及突變C等位基因的頻率分布與對照組相比差異有統計學意義(P<0.05),詳見下頁表4。
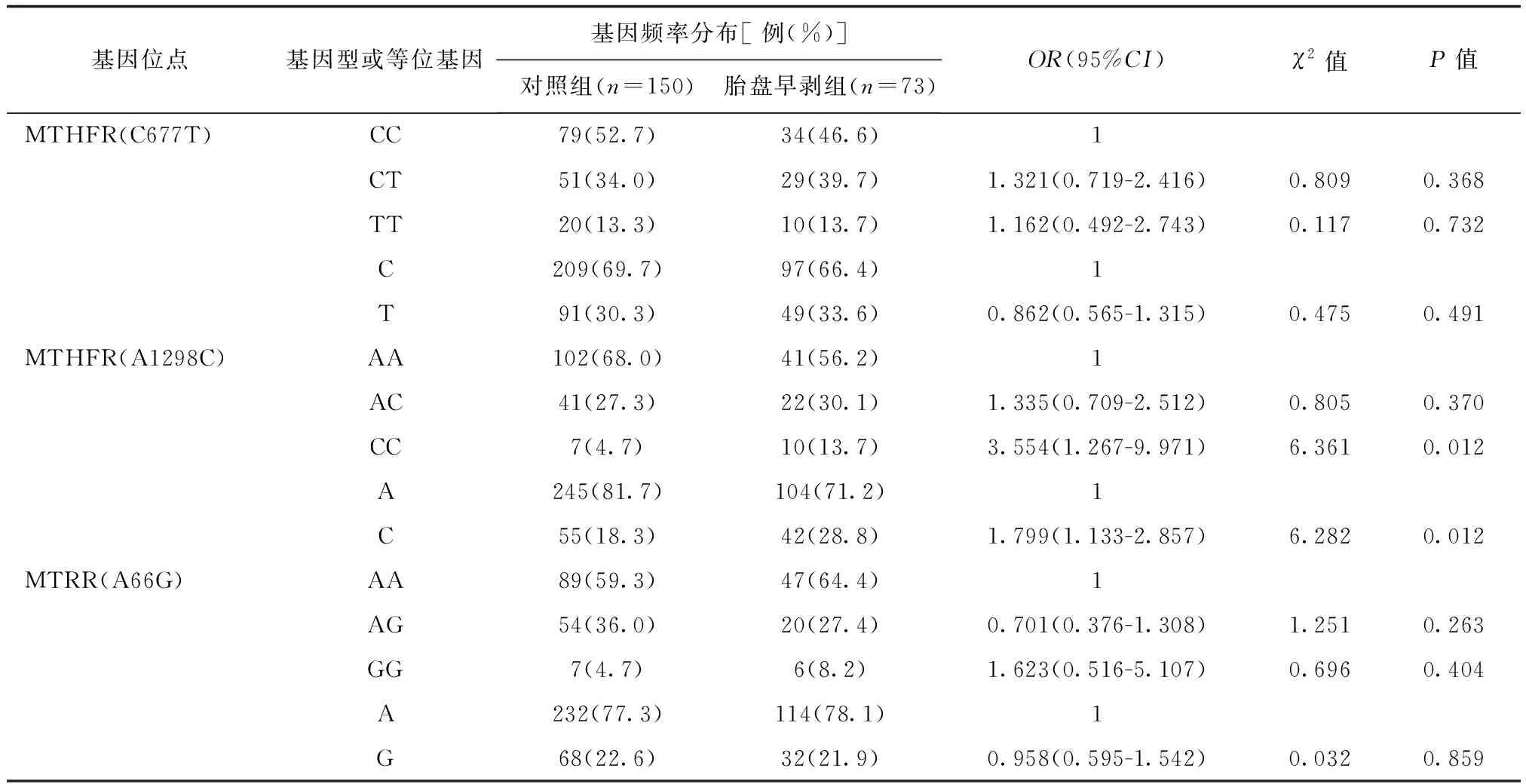
表2 3種基因多態性在胎盤早剝組與對照組孕婦中的分布比較
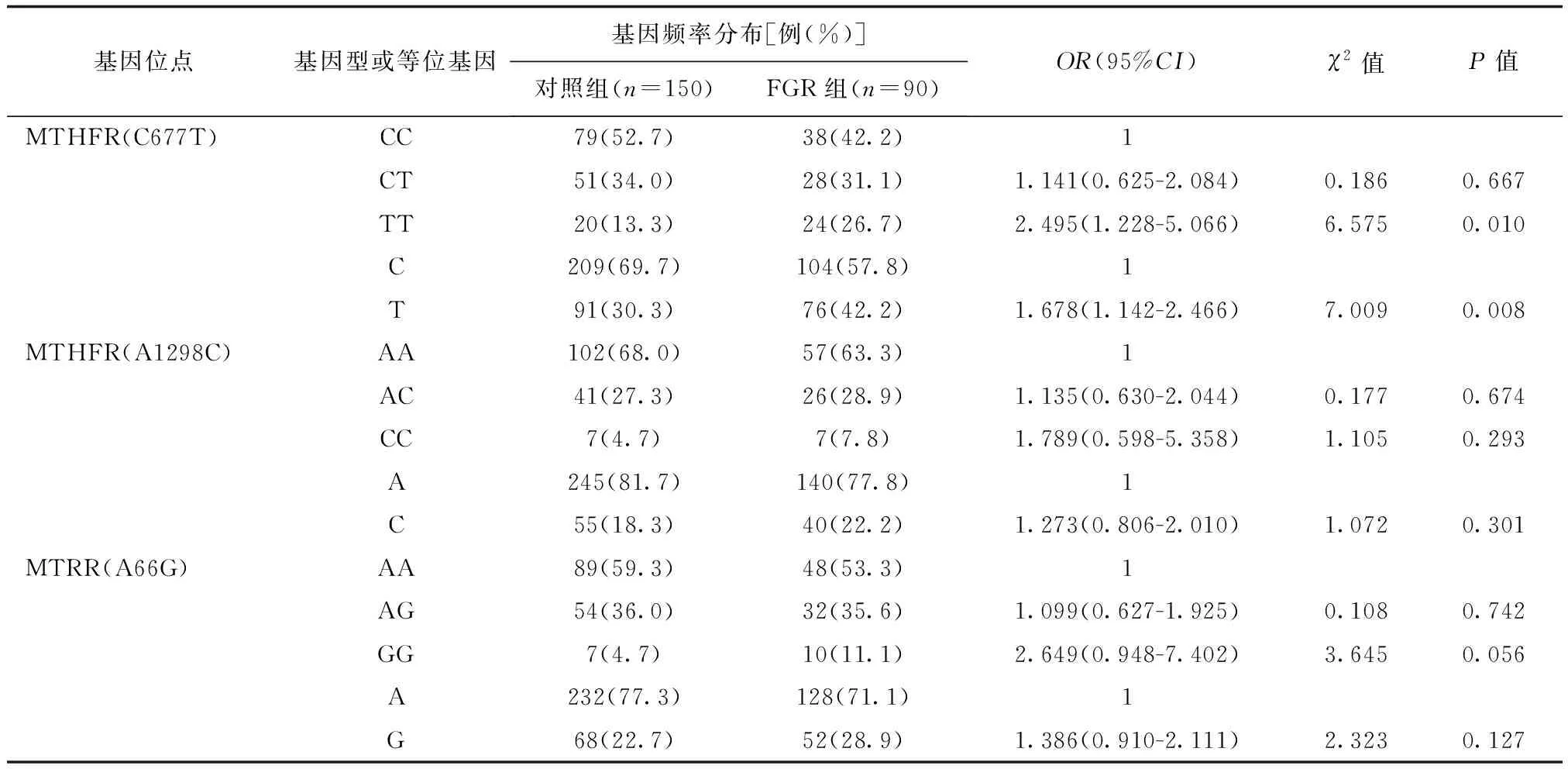
表3 3種基因多態性在FGR組與對照組孕婦中的分布比較
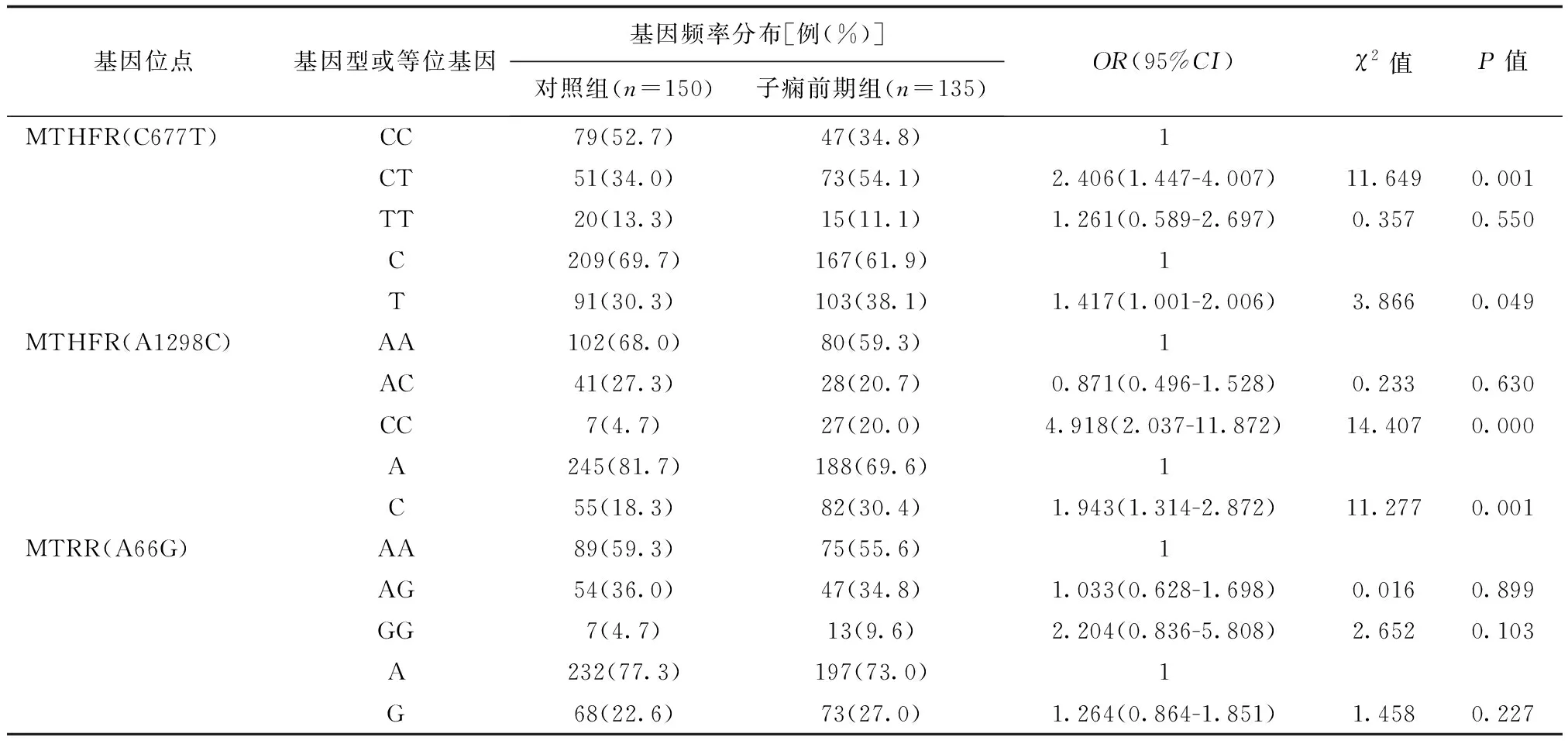
表4 3種基因多態性在子癇前期組與對照組孕婦中的分布比較
3 討論
Hcy是甲硫氨酸去甲基化后產生的含硫氨基酸,體內Hcy水平與遺傳和營養情況有關,如酶缺陷、葉酸、維生素缺乏或腎功能受損時Hcy升高。妊娠期Hcy升高可損傷血管內皮細胞,改變血液中凝血狀態,影響胎盤功能或胎盤灌注,增加胎盤血栓形成風險,導致嚴重妊娠期并發癥,如子癇前期、流產、胎盤早剝、FGR、靜脈血栓形成等。目前孕期母體血清Hcy水平、葉酸代謝基因與IPD的關系存在爭議。Hogeveen等[6]研究表明當Hcy水平高于95%時,FGR發生風險增加。也有少部分人認為Hcy的升高對FGR有保護作用,胎兒體重可伴隨著Hcy增加而增加[7]。徐少勇等[8]指出妊娠期高血壓患者血清Hcy較對照組明顯增高,進一步說明Hcy參與了妊娠期高血壓的發生、發展。本研究中,3組IPD患者血清Hcy水平均明顯高于對照組,進一步說明了Hcy水平的升高可以預測這些血管病變的發展。MTHFR C677T基因中,TT基因型孕婦血清Hcy水平明顯高于CC、CT型,MTHFR A1298C基因中,CC型孕婦血清Hcy水平高于AA型,提示MTHFR C677 T、A1298 C基因突變可引起血清Hcy水平升高。而MTRR A66G基因中,GG型血Hcy水平與AA、AG型比較差異無統計學意義。因此建議臨床通過早期篩查MTHFR,對MTHFR C677T的TT型、A1298C的CC型孕婦從妊娠早期開始關注血清Hcy水平,指導妊娠期葉酸服用。
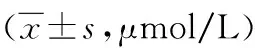
表1 MTHFR、MTRR不同基因型與血清Hcy水平的關系
MTHFR、MTRR是參與Hcy代謝過程的關鍵酶,其基因多態性可改變酶活性,一方面會造成胎兒生長發育所需DNA和蛋白質甲基化不足,另一方面可使血清Hcy水平升高[9]。MTHFR中最常見突變為677C>T和1298A>G。有研究指出MTHFR C677T基因多態性可能與FGR的發生存在一定的相關性,尤其是T等位基因與FGR的關系更大[10]。徐少勇等[8]對70例妊娠期高血壓疾病患者和70例健康孕婦患者的MTHFR C677T位點多態性分析發現,妊娠期高血壓疾病患者MTHFR C677T中CT基因型、T等位基因頻率明顯高于對照組,該基因多態性是妊娠期高血壓疾病發生的重要誘因。Chen等[11]應用Meta分析了13篇關于MTHFR C677T基因突變與胎盤早剝的文獻發現其基因位點突變與胎盤早剝無明顯相關性。本研究中,FGR組患者C677T中TT基因型、突變T等位基因頻率和子癇前期組CT基因型、突變T等位基因頻率均明顯高于對照組。提示MTHFR C677T基因多態性與FGR、子癇前期的發生有關,但未發現與胎盤早剝的相關性。
關于MTHFR A1298C與IPD的研究較少。Sarra等[12]分析了203例IPD患者MTHFR C677T、A1298C基因位點多態性后發現,A1298C基因多態性可使血清Hcy水平升高,增加胎盤血管病變的風險,而C677T則無明顯相關性。岳紅云等[13]研究指出A1298C位點的CC突變基因型是子癇前期發生的高風險因子,病例組CC基因型頻率高于對照組(OR12.59,95%CI:3.15-256.81)。也有研究認為MTHFR C677T、A1298C和MTRR 66G基因多態性引起子癇前期的風險較低[14]。Cande等[15]在研究葉酸代謝基因與胎盤早剝關系時發現MTHFR C677T、A1298C基因突變均不增加其發生風險。本研究中胎盤早剝、子癇前期組患者中MTHFR A1298C基因中的CC基因型、突變C等位基因頻率均高于對照組,提示該MTHFR A1298C多態性與這兩種病的發生有相關性,但未發現其與FGR的相關性。
MTRR是Hcy再甲基化途徑中重要酶,最常見的變異為66A>G,可降低甲硫氨酸合成酶的活性進而升高Hcy。何傳鳳[16]對50例妊娠期高血壓患者的MTRR A66G位點多態性分析發現,該基因多態性與妊娠期高血壓發生密切相關,AG基因型增加了子癇前期的發生風險,可作為評價妊娠期高血壓預后的有效指標。目前關于MTRR A66G與胎盤早剝、FGR的研究文獻報道較少,這也是本研究的創新之處。本研究中,3組病例組MTRR A66G各基因型分布無明顯差異,提示MTRR A66G基因多態性與3種胎盤血管疾病均無相關性。與文獻[16]報道不同的原因可能是:不同機構檢測方法的不同及地域、種族差異,本研究樣本僅來自河南省內,不同地區人群中MTHFR、MTRR分布不同等原因。
綜上所述,血清Hcy升高與子癇前期、胎盤早剝、FGR密切相關,MTHFR C677T、A1298C基因多態性可參與IPD的發生、發展,且其與Hcy升高的關系進一步說明可能會影響妊娠結局,MTRR A66G基因多態性與IPD無關且并不能預測Hcy的升高。目前由于IPD病因復雜,診斷仍主要根據臨床表現及排除診斷,葉酸代謝基因多態性有望為該病發生的預測、疾病進展的判斷提供新的研究思路。

