低溫脅迫下不同溫敏性油菜保護酶活性及內源激素變化
馬學才,方彥,劉麗君,馬驪,曾瑞,朱明川,王亞林,牛早霞,李學才,孫萬倉,李愛國,武軍艷
(1.甘肅農業大學農學院,甘肅省干旱生境作物學重點實驗室,甘肅 蘭州 730070;2.河北省農林科學院旱作農業研究所,河北 衡水 053000)
油菜是我國第一大油料作物,產油量占國產油料作物產油量的55%左右,是國產植物油第一大油源,油菜產業的發展對于保障國家糧油安全,具有重大的意義[1].隨著全球氣候的變化,作物新品種的育成,推廣布局結構在逐漸變化,油菜的種植區劃也逐年向北移動[2].世界范圍內的極端溫度在很多地區出現,且這一現象逐年增多,致使寒冷災害對作物的生長及最終產量形成產生重要影響[3].在我國北方,低溫是作物生長不良以及產量不高的重要原因之一.因此,增強油菜抵抗嚴寒的能力來保障其產量顯得尤為重要[3-5].
低溫條件下,植物生長活力下降,通過保護性酶活性和內源激素含量的變化調控生理反應,維系植株的生長[6].植物葉片在低溫脅迫下,保護性酶發揮作用,而超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)是公認的細胞膜保護酶,在理論上就存在相關性[6].脫落酸(absoisic acid,ABA)是傳導和使抗冷的DNA分子轉錄成蛋白質的傳播信息分子,可以借助提高保護酶的高效運行與無機鹽的量的恒定,降低低溫對葉片的損傷,提高較冷溫度當下葉片里葉綠素的儲存及光能的化學作用,使其更容易生長出根,特別是根的橫向變粗,降低冬天的油菜死亡率,提高其耐低溫性能[7-9].在低溫脅迫下,植物為了適應寒冷的環境,生長素(auxin,IAA)含量會發生相應的變化,如低溫脅迫后鹿蹄草的內源IAA含量會逐漸降低[10].赤霉素(gibberellin,GA)能夠促進植物莖節的伸長生長,從而促進植物的生長,在植物逆境脅迫等各種生理現象中扮演重要的角色[11-12].本研究以3個溫敏性不同的油菜品種為材料,低溫處理后測定其根、生長點以及葉片中ABA、IAA、GA的含量,根及葉片保護酶活性.分析了短時低溫脅迫下不同溫敏性油菜各組織生理活性物質和內源激素含量的變化規律,得出這種變化的差異與抗寒性的關系,為油菜應答低溫生長的機理研究提供理論依據.
1 材料與方法
1.1 試驗材料
試驗材料如表1,圖1所示。

圖1 隴油6號,天油4號,隴油10號生長點特性
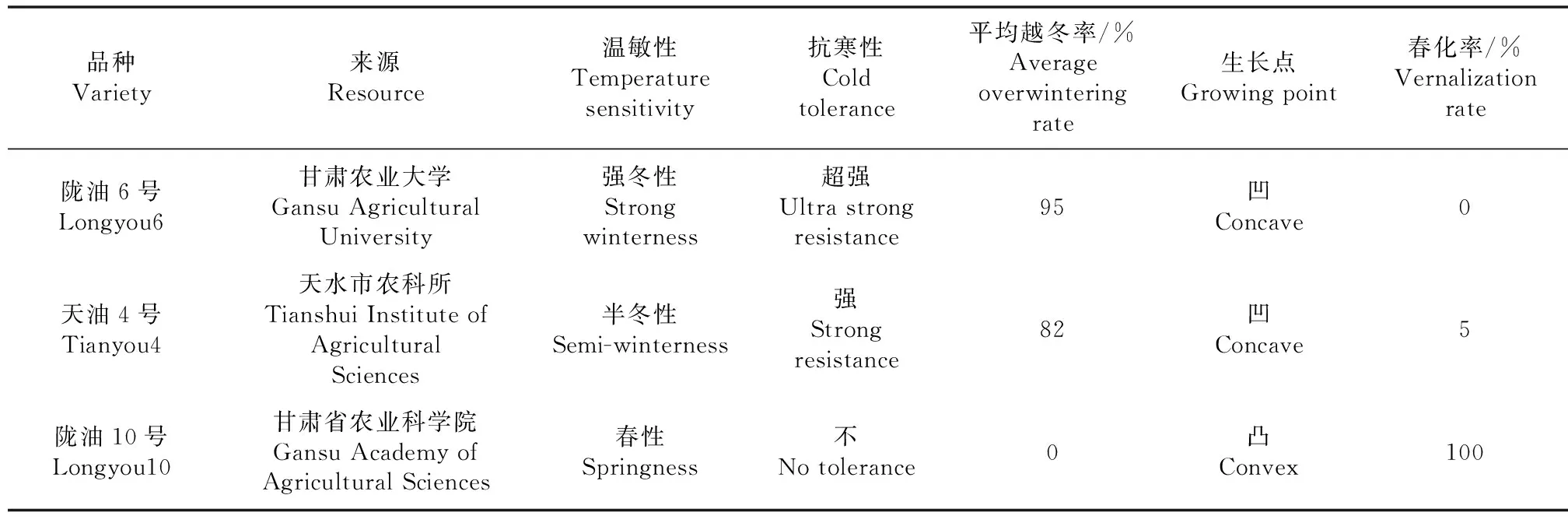
表1 試驗材料特征及來源
1.2 試驗設計及方法
2019年10月中旬種植于甘肅農業大學(N 36°5′,E 103°4′),種子經培養皿萌發后挑選播種于營養缽中,每盆4株,放置于室內,每天澆適量的水,待油菜幼苗長至5~6片真葉時置于人工氣候箱進行低溫(4℃)處理,日光照10 h,模擬苗期低溫環境,每個處理3盆.處理后0(CK)、2、4、6、8、12、24、48 h分別取心葉外第3片功能葉、生長點及根系放到冰盒中立即進行內源激素的測定;用處理0(CK),LT1(24 h),LT2(48 h)的根和葉片進行生理活性物質的測定.采用酶聯免疫吸附(ELISA)[13]法測定內源激素的含量,分別采用氮藍四唑法、紫外吸收法、愈創木酚法、紫外吸收法測定SOD、CAT、POD、APX的酶活性[14].
1.3 數據分析
利用SPSS及Excel進行數據及作圖分析.
2 結果與分析
2.1 低溫脅迫下不同品種根系、葉片的生理指標分析
低溫處理后,各品種根、葉保護性酶活性變強,冬性的品種比抗寒性弱的保護性酶活性高,且同一時間段下都達到了顯著水平(P<0.05)(圖2~3).與CK相比,SOD和POD變化趨勢和增長率相近,根系葉片均表現持續增加的變化趨勢.在感受低溫的過程中,CAT的變化呈升高趨勢,隴油6號較天油4號,隴油10號CAT活性高,根系含量高于葉片.APX活性隨著低溫處理時間的延長,呈現逐漸升高,根系增幅率高于葉片,3個品種根系APX活性增長率高,至LT2時,與CK相比分別增長了3.46倍,3.12倍.2.99倍;與此相比,3個品種葉片APX活性只增長了0.90倍,0.83倍,0.82倍.可見,在低溫下冬性品種的四種酶活性響應較及時,根系變化更明顯.
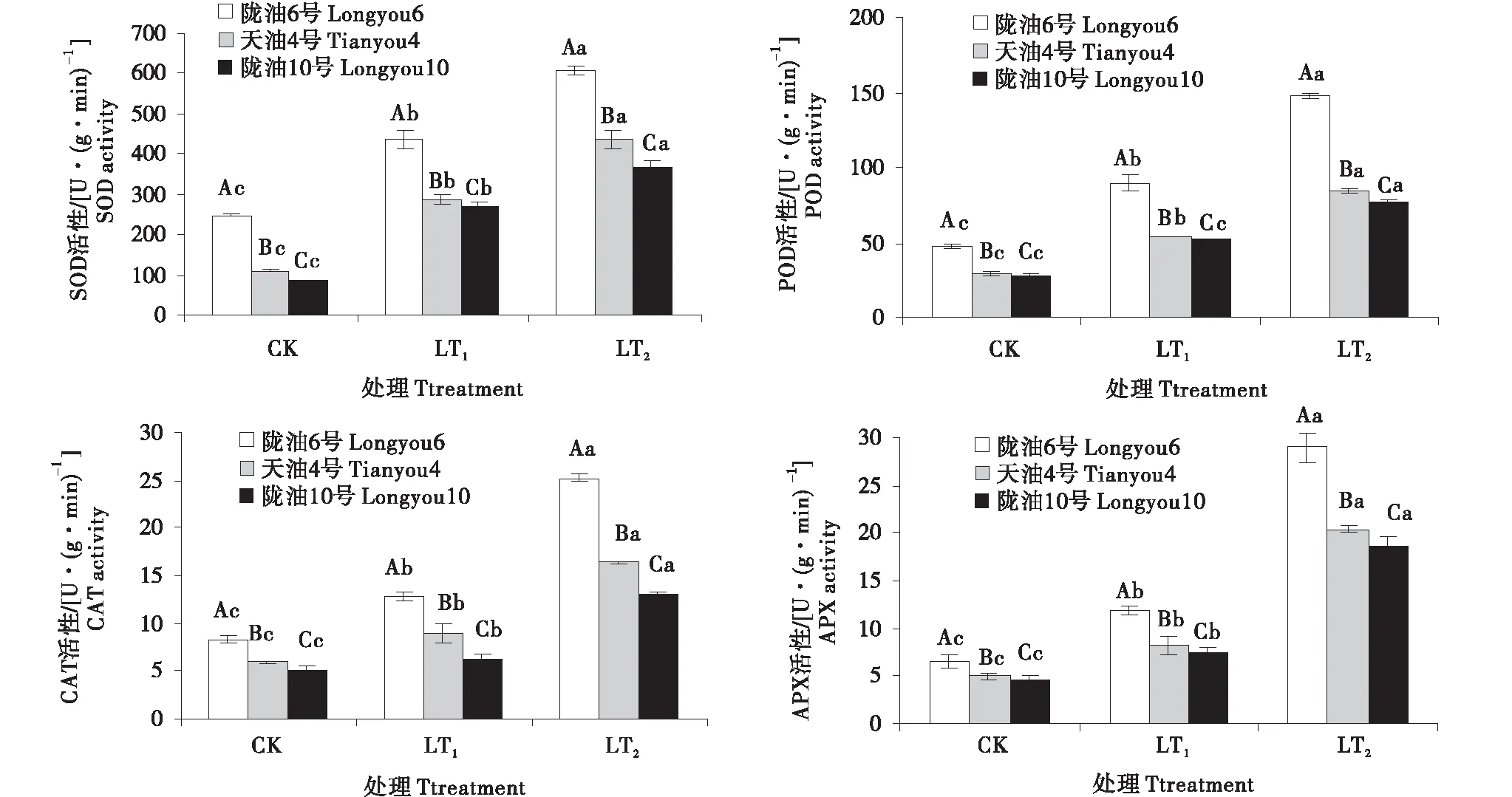
不同大寫字母表示同一時間不同品種之間的顯著差異(P<0.01),不同小寫字母表示同一品種不同時間之間的顯著差異(P<0.05)
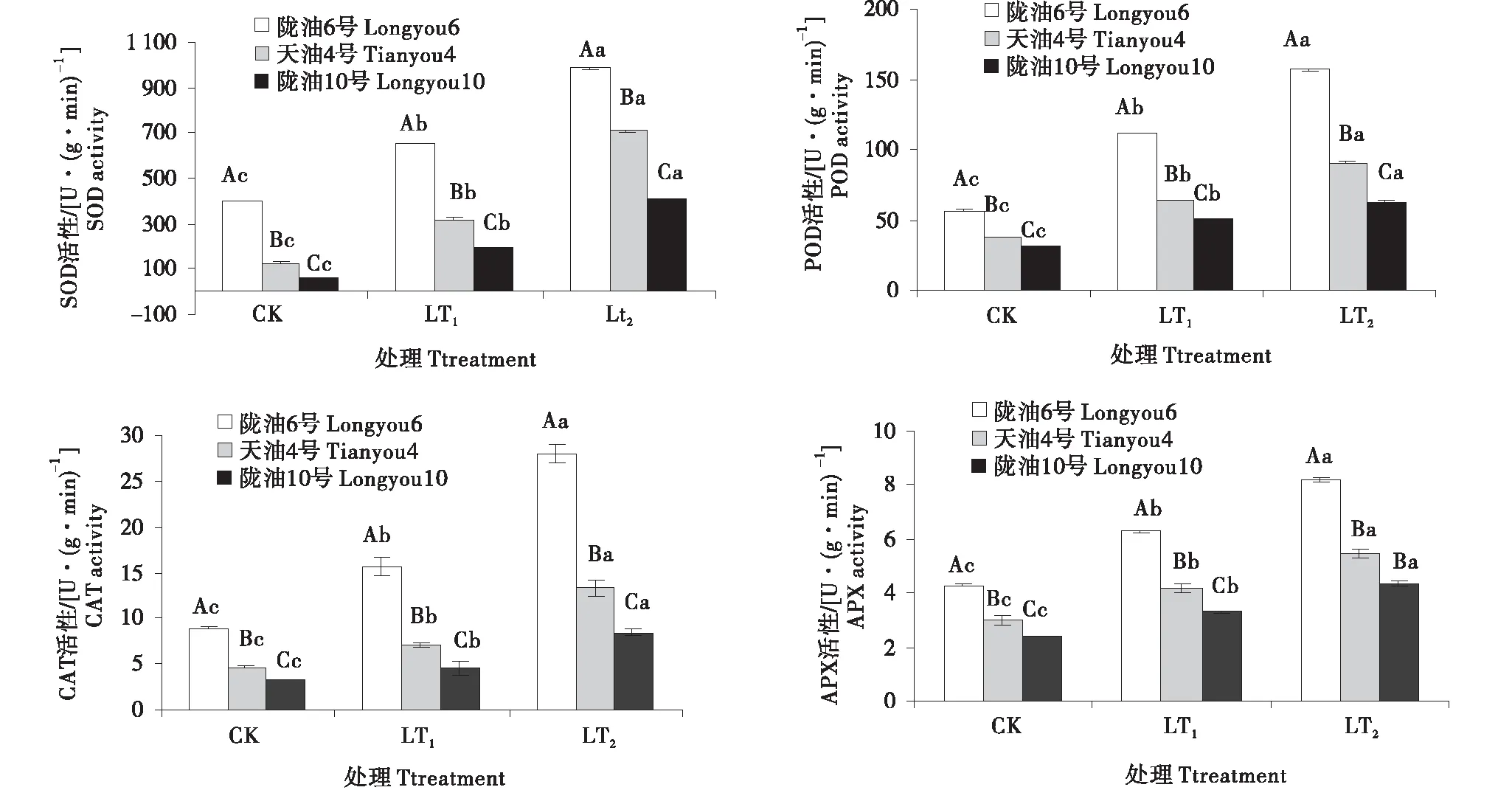
不同大寫字母表示同一時間不同品種之間的顯著差異(P<0.01),不同小寫字母表示同一品種不同時間之間的顯著差異(P<0.05)
2.2 ABA含量的變化分析
在感受低溫的過程中,不同品種ABA含量的變化不同(圖4~6).在根系中,3個品種均呈先升高再降低的趨勢,隴油10號在6 h達到峰值,隴油6號和天油4號在12 h達到峰值.生長點的結果表明,隴油6號、天油4號在處理2 h開始升高,隴油10號則逐漸升高,至處理48 h時高于對照(0 h),達到211.59 ng/g.在2~24 h,隴油6號的含量均高于天油4號和隴油10號(P≤0.05).葉片的含量表現為先短暫降低后逐漸升高,隴油10號在處理2 h之后逐漸升高,隴油6號、天油4號則在4 h后升高,可見,低溫后春性品種的葉片反應更敏感,比冬性先做出出反應.從不同組織來看,冬性的生長點的ABA含量對低溫的響應與春性不同.
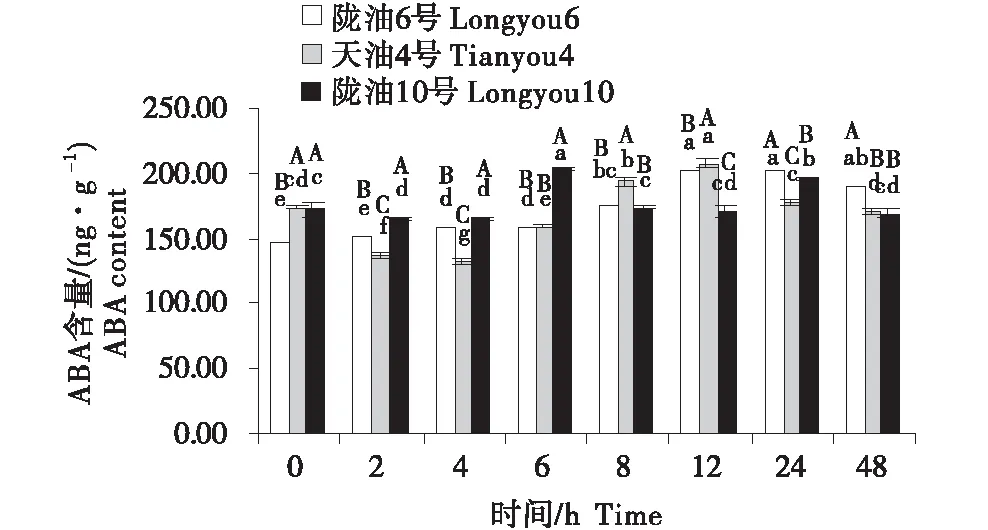
不同大寫字母表示同一時間不同品種之間的顯著差異(P<0.01),不同小寫字母表示同一品種不同時間之間的顯著差異(P<0.05).
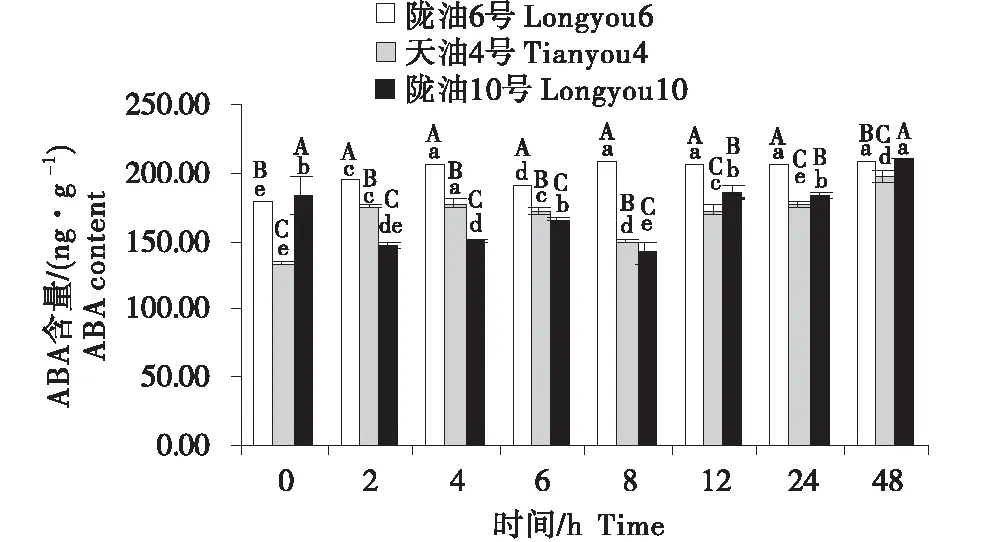
不同大寫字母表示同一時間不同品種之間的顯著差異(P<0.01),不同小寫字母表示同一品種不同時間之間的顯著差異(P<0.05).
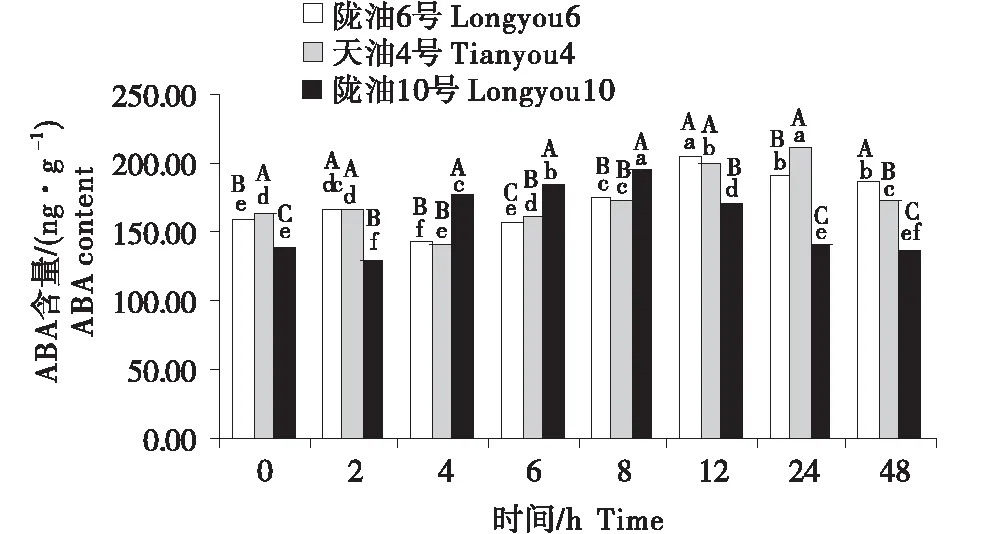
不同大寫字母表示同一時間不同品種之間的顯著差異(P<0.01),不同小寫字母表示同一品種不同時間之間的顯著差異(P<0.05).
2.3 IAA含量的變化分析
3個品種均表現為,葉片的IAA含量最高,根系次之,生長點最低(圖7~9).在根系中,3個品種的變化均為先升高后降低;與天油4號相比,隴油6號升高幅度較大并在處理6 h達到峰值,隴油10號則在處理2 h達到峰值后降低.生長點和葉片的IAA變化趨勢相似,隴油6號平緩上升,增幅穩定,天油4號和隴油10號為先升后降的趨勢,且隴油10號的升高幅度和降低幅度均低于天油4號;低溫6 h后冬性、半冬性品種的含量顯著高于春性品種(P≤0.05).
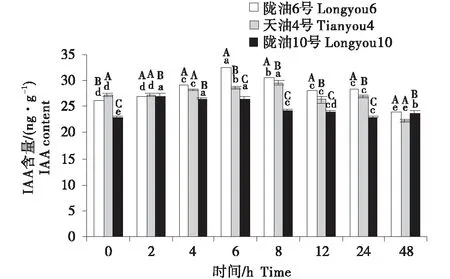
不同大寫字母表示同一時間不同品種之間的顯著差異(P<0.01),不同小寫字母表示同一品種不同時間之間的顯著差異(P<0.05).
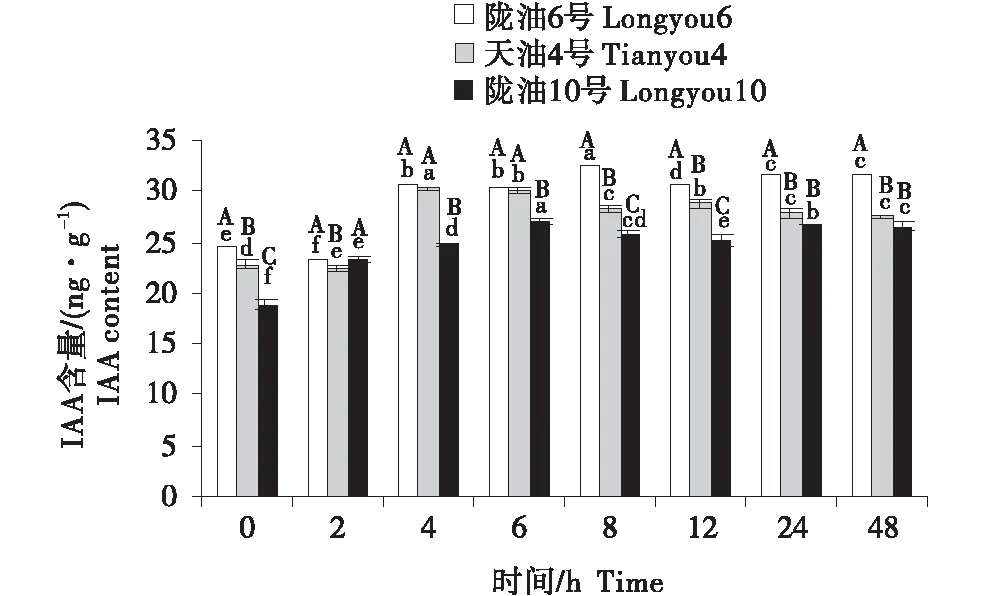
不同大寫字母表示同一時間不同品種之間的顯著差異(P<0.01),不同小寫字母表示同一品種不同時間之間的顯著差異(P<0.05).
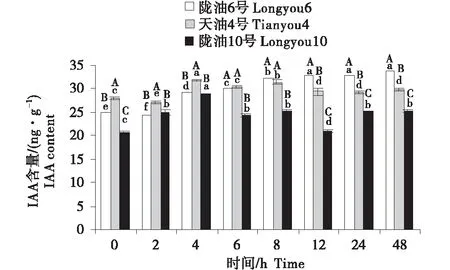
不同大寫字母表示同一時間不同品種之間的顯著差異(P<0.01),不同小寫字母表示同一品種不同時間之間的顯著差異(P<0.05)
2.4 GA含量的變化分析
3個組織的含量變化為:生長點>葉>根.隨著低溫時間的延長,3個品種的根系的GA含量均表現為緩慢升高(圖10~12).3個品種的生長點的含量先降低,至4 h后逐漸升高.低溫脅迫后,與隴油10號相比,隴油6號、天油4號的變化更平穩,隴油10號變化幅度較大.由此推斷,低溫處理下,冬性品種GA含量的變化較小,春性品種變化較大,且春性品種的GA含量高于冬性品種.
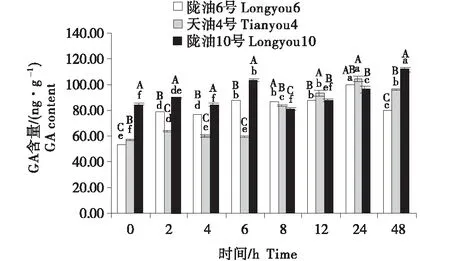
不同大寫字母表示同一時間不同品種之間的顯著差異(P<0.01),不同小寫字母表示同一品種不同時間之間的顯著差異(P<0.05)
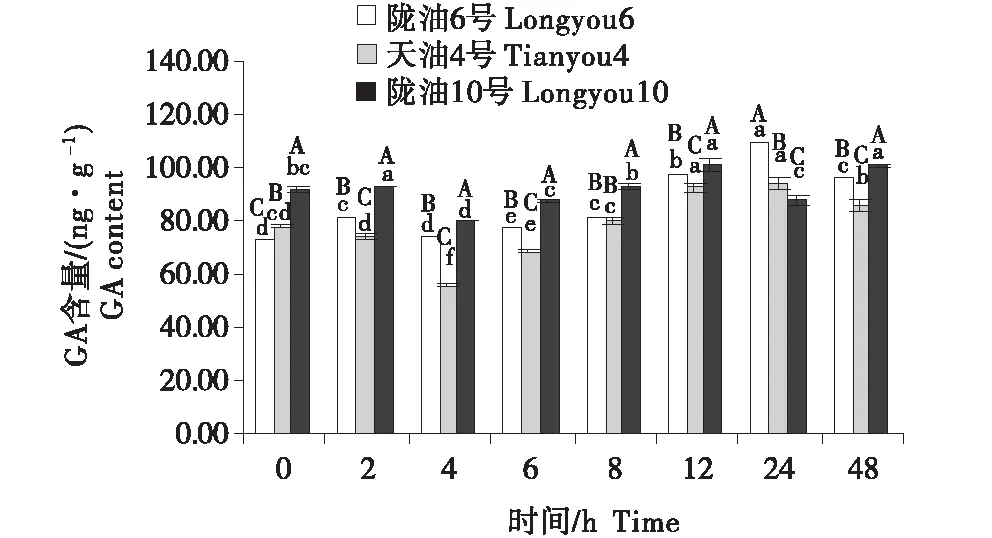
不同大寫字母表示同一時間不同品種之間的顯著差異(P<0.01),不同小寫字母表示同一品種不同時間之間的顯著差異(P<0.05)
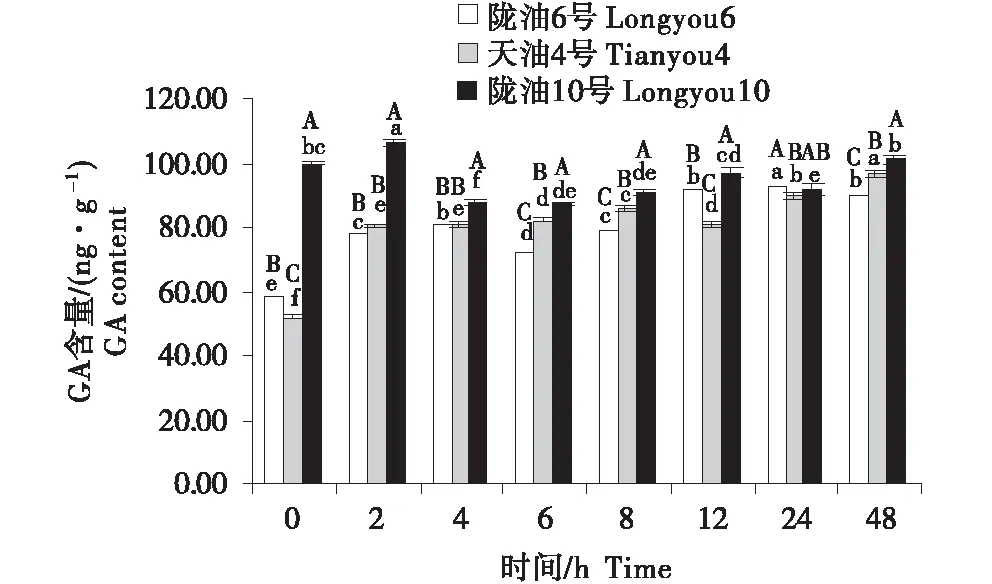
不同大寫字母表示同一時間不同品種之間的顯著差異(P<0.01),不同小寫字母表示同一品種不同時間之間的顯著差異(P<0.05)
2.5 內源激素的比值變化
隨低溫處理時間的延長各品種ABA、IAA、GA三者的比值較對照均有不同程度的變化;不同品種不同組織之間均有差異.3個品種各組織中ABA/IAA的比值最高,ABA/GA其次,IAA/GA最低.隴油6號、天油4號生長點的ABA/IAA、ABA/GA比值均高于根和葉片,根、生長點的ABA/IAA呈逐漸升高的趨勢,隴油10號并未有這種趨勢.隨著處理時間的延長,3個品種的根的ABA/GA比值均降低.IAA/GA比值沒有明顯的變化趨勢.
3 討論
3.1 根系的酶活性的變化是不同感溫性油菜低溫生長的關鍵
SOD、POD、CAT、APX是植物遭受低溫時保護性酶的典型代表,為了抵御低溫,植物中的保護性酶通過相互配合共同協調來完成對自身的保護[15];低溫逆境中SOD、POD、CAT、APX活性水平也是作為植物抗寒性檢測的重要指標[16].研究表明,隨著低溫處理的持續,紫花苜宿保護性酶活性增加,抗寒性強的品種酶活增加的要快,抗寒性弱的品種酶活增加的慢[17].本研究結果表明,經過低溫處理,葉片對低溫敏感,葉片中幾種酶的活性在感受到低溫時會顯著增加,發揮酶的保護作用.超強抗寒品種在低溫脅迫下根中幾種酶活性增加的迅速,不抗寒品種在低溫脅迫下葉片中幾種酶活性變化較為遲鈍.說明抗寒性不同,品種油菜酶活性變化不同;根系是冬油菜低溫生長和越冬的關鍵,其生理活性物活性高且變化強烈.
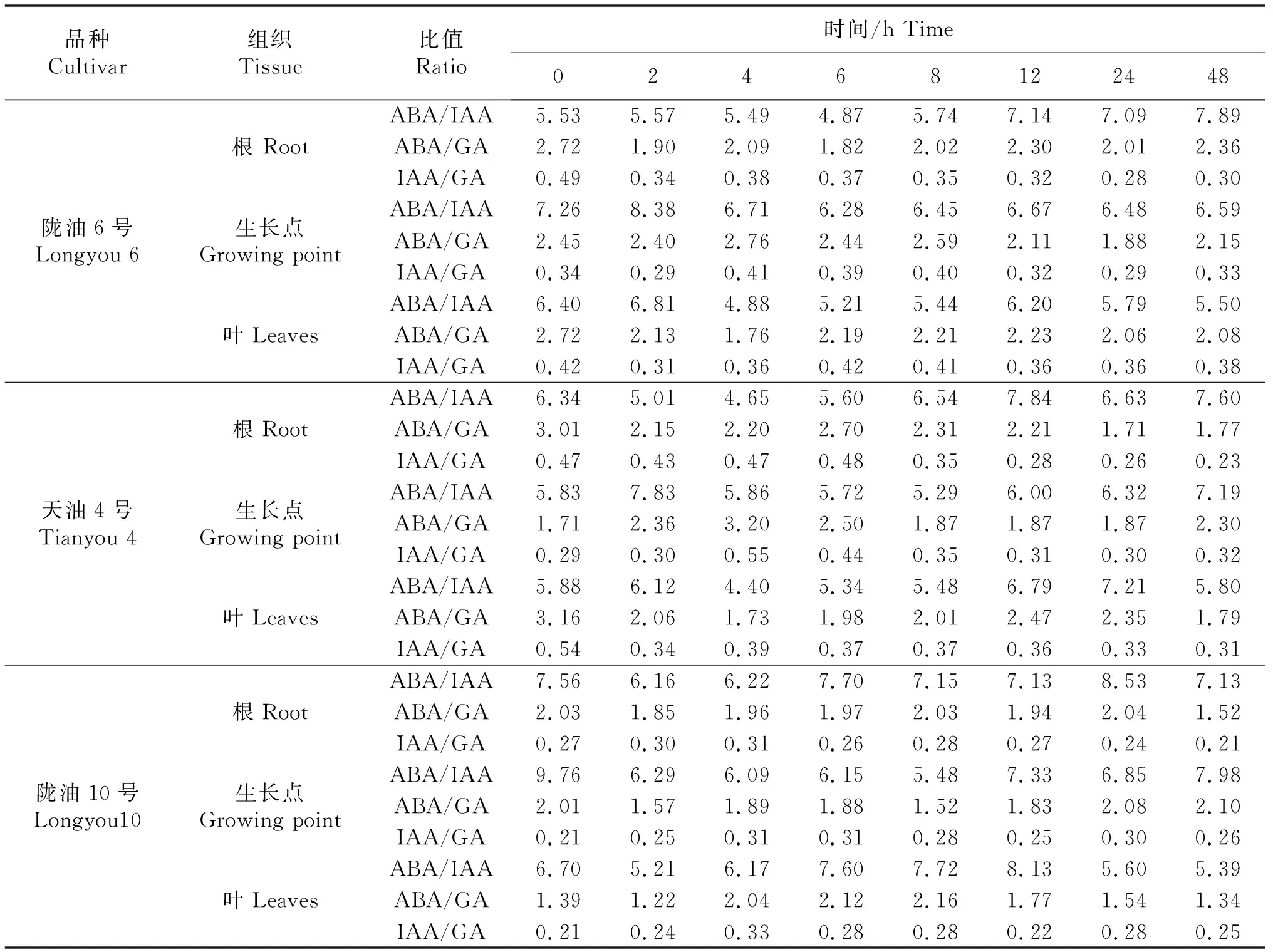
表2 低溫條件下不同品種各組織內源激素比值
3.2 冬性品種的ABA積累量更高,激素之間的動態平衡更好
低溫降低植物的生長活力,影響內源激素的產生和運輸,使得植物的生理生化狀態發生變化,從而影響逆境脅迫信息傳遞,誘發抗寒生理反應[14].調控內源激素的動態平衡是油菜適應逆境環境的關鍵[18].本研究表明,隨低溫處理時間的延長,ABA/IAA、ABA/GA比值升高,增加ABA的合成,同時適當減少IAA、GA的合成抵御低溫;冬性強的品種ABA/IAA與ABA/GA的值均較高,ABA含量積累增多,IAA和GA的含量輕微降低,春性品種的積累速率及積累量均低于冬性品種,可見冬性、半冬性品種通過在較短的時間積累較多的ABA,緩解油菜所受的傷害,提高其抵御低溫傷害的能力[19-23].小麥的研究結果也說明抗寒性強的品種IAA含量高于弱抗寒品種[24],田小霞等[25]結果表明低溫會降低薰衣草的GA水平,使植株生長速度減慢,從而適應低溫脅迫.
3.3 生長點的激素積累是保障強冬性油菜越冬的重要因素
不同組織在逆境對抗中扮演的角色不同,冬油菜由于具有適應低溫的形態特性導致其更具抗寒力[26-27].冬油菜在越冬過程中,地上部全部干枯[28],只有根系存活于土壤中,次年新葉從其生長點重新長出(圖10),完成生長,因此根系及生長點是其越冬生長的重要組織,也是其越冬后生長的啟動點[29].本研究中在低溫脅迫過程中冬性、半冬性品種的生長點的ABA含量均高于春性品種,且ABA/IAA、ABA/GA比值均高于根和葉片;冬性品種根系的ABA的含量變化最明顯,呈上升趨勢,春性則剛好相反.低溫鍛煉過程中,冬油菜葉片承受冷害能力強,春油菜葉片承受一定時期后,ABA、IAA、GA的合成減少,阻遏正常生長,這與陳奇[30]等的研究結果基本吻合.可見生長點的激素積累對強冬性白菜型油菜應答低溫具有重要作用.抗寒性強的品種與抗寒性弱的品種生長點特性的不同,造成其內源激素富集比其它組織的要高,更能適應逆境.

圖13 越冬前冬油菜葉片干枯,返青后心葉重新長出
4 結論
低溫脅迫下,隴油6號、天油4號較隴油10號ABA積累量更高,GA和IAA含量更穩定,激素之間的相互作用更強且動態平衡更好,保護性酶活性水平更高.隴油6號、天油4號生長點對低溫做出反應迅速且持續時間長,能耐受更長時間低溫脅迫.

