左乙拉西坦片仿制藥與原研藥溶出度一致性評價*
劉明鷺,李 震 ,楊龍華 ,朱雙鵬,楊 釗
(1. 山東省青島市食品藥品檢驗研究院,山東 青島 266000; 2. 浙江京新藥業(yè)股份有限公司,浙江 紹興 312500)
左乙拉西坦(LEV)為西坦類藥物,屬吡咯烷酮類,可視為 γ-氨基丁酸(GABA)的環(huán)狀衍生物,是一種新型抗癲癇藥物。左乙拉西坦片由比利時優(yōu)時比制藥公司[1]研發(fā),商品名 KEPPRA(開浦蘭),于 2000 年獲美國食品藥物管理局(FDA)批準,在美國和歐盟上市,并于2006 年11 月獲國家食品藥品監(jiān)督管理局(SFDA)批準進口[1]。目前在全球超過66 個國家和地區(qū)上市,有超過100 萬人的治療記錄,是目前美國癲癇治療中心應用最多的抗癲癇藥物[2]。仿制藥與原研藥的質量差異主要采用溶出度試驗評價,通過在體外模擬口服固體制劑在胃腸道的溶出,以評價口服固體制劑的內在質量。而多種溶出介質下測定的溶出曲線可有效反映藥物在體內的釋放過程,本研究中比較并分析了左乙拉西坦片仿制藥與原研藥在4 種不同溶出介質中的溶出曲線,為評價仿制藥質量和療效的一致性提供參考[3-5]。現(xiàn)報道如下。
1 儀器與試藥
1.1 儀器
Agilent 708DS 型溶出儀、Agilent 1260 型高效液相色譜儀(美國安捷倫公司);Sartorius Bt 125D 型天平(德國賽多利斯公司,精度為十萬分之一);AS10200BT 型超聲儀(美國賽默飛世爾科技公司,功率為300 W,頻率為50 /60 Hz);Mettler MP200 型 pH 計(瑞士梅特勒公司);ZKT-18F 型真空脫氣儀(天津天大天發(fā)科技公司)。
1.2 試藥
左乙拉西坦對照品(A 公司,批號為R039L0,含量為99.9%);左乙拉西坦酸(雜質C)對照品(歐洲藥品質量管理局,批號為4.0,含量為100.0%);左乙拉西坦片(仿制制劑,B 公司,批號分別為 A1802061,A1701202,A1701203,A1701204,規(guī)格為每片 0.25 g);左乙拉西坦片(原研制劑,商品名開浦蘭,比利時優(yōu)時比制藥公司,批號為 195846,規(guī)格為每片 0.25 g);乙腈(色譜純,美國Fisher 公司);純化水(實驗室自制);磷酸氫二鉀、鹽酸、無水乙酸鈉、氫氧化鈉(分析純,國藥集團化學試劑有限公司)。
2 方法與結果
2.1 色譜條件與系統(tǒng)適用性試驗
色 譜 柱 :Agilent Eclipse XDB - C18柱 (150 mm ×4.6 mm,5 μm);流動相:0.2% 磷酸氫二鉀溶液 - 乙腈(950 ∶50,V / V,用稀磷酸調 pH 值至 6.0);流速:1.0 mL / min;檢測波長:205 nm;柱溫:30 ℃ ;進樣量:20 μL。分別取雜質C 對照品與左乙拉西坦對照品適量,加水 - 乙腈(950 ∶50,V / V)溶解,稀釋,制成每 1 mL 各含0.1 mg 的溶液,作為系統(tǒng)適用性試驗用溶液。理論板數(shù)按左乙拉西坦峰計應不低于3 000,雜質C 與左乙拉西坦峰之間的分離度應大于1.5。結果左乙拉西坦峰的理論板數(shù)為8 715,分離度為2.7。
2.2 溶出條件選擇
首先采用《美國藥典》(USP)收載的左乙拉西坦片的溶出條件對原研藥進行測定[6],轉速為 50 r/min,15 min時溶出量約為85%,觀察溶出杯中崩解現(xiàn)象,原研藥為溶蝕型,在50 r/min 條件下在杯底靜水區(qū)沉積,薄膜包衣片明顯崩解偏慢,推測在50 r/min 條件下可能存在過度區(qū)分。根據(jù)原國家食品藥品監(jiān)督管理總局發(fā)布的《普通口服固體制劑溶出度試驗技術指導原則》[7]《普通口服固體制劑溶出曲線測定與比較指導原則》[8]《人體生物等效性試驗豁免指導原則》[9],并參考文獻[10 -11],溶出條件設定:溶出介質體積為500 mL,溫度為(37±0.5)℃ ,轉速為 75 r/min;4 種溶出介質(純化水,經測定 pH 為 6.20),pH 1.0 鹽酸溶液(取鹽酸 9.0 mL,用水稀釋至 1 000 mL,搖勻,即得),pH 4.5 醋酸鹽緩沖液(取醋酸鈉2.99 g,冰醋酸1.6 mL,加水溶解并稀釋至1 000 mL,即得),pH 6.8 磷酸鹽緩沖液(量取 0.2 mol/L磷酸二氫鉀溶液250mL,0.2mol/L 氫氧化鈉溶液112mL,混勻,加水稀釋至1 000 mL,即得),上述溶出介質均采用脫氣裝置經42 ℃ 脫氣1 h 后立即使用;取樣時間為5,10,15,30,45 min。
2.3 溶液制備
取左乙拉西坦對照品25 mg,精密稱定,置50 mL容量瓶中,分別用 pH 1.0 鹽酸溶液、pH 4.5 醋酸鹽緩沖液、pH 6.8 磷酸鹽緩沖液和水4 種溶出介質溶解,并稀釋至刻度,搖勻,制得每1 mL 中約含0.5 mg 的對照品溶液。取每批樣品(批號分別為 195846,A1802061,A1701202,A1701203,A1701204)各 12 片,分別在 pH 1.0 鹽酸溶液、pH 4.5 醋酸鹽緩沖液、pH 6.8 磷酸鹽緩沖液和水4 種溶出介質中進行試驗,取溶出液,用 0.45 μm 聚醚砜微孔濾膜(天津市津騰實驗設備有限公司)濾過,取續(xù)濾液,即得供試品溶液。
2.4 方法學考察
線性關系考察:取左乙拉西坦對照品50 mg,精密稱定,置10 mL 容量瓶中,用水溶解,并稀釋至刻度,搖勻,作為左乙拉西坦對照品貯備液,分別精密量取對照品貯備液 0.2,0.6,1.0,1.4,1.8 mL,置 10 mL 容量瓶中,用 pH 1.0 鹽酸溶液、pH 4.5 醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液和水4 種溶出介質稀釋至刻度,搖勻,按2.1 項下色譜條件進樣測定。以左乙拉西坦對照品的質量濃度(X,mg/mL)為橫坐標、峰面積(Y)為縱坐標繪制標準曲線,并計算回歸方程。結果在上述4 種溶出介質中,左乙拉西坦對照品質量濃度在 0.10 ~0.90 mg/mL范圍內與峰面積線性關系良好。詳見表1。
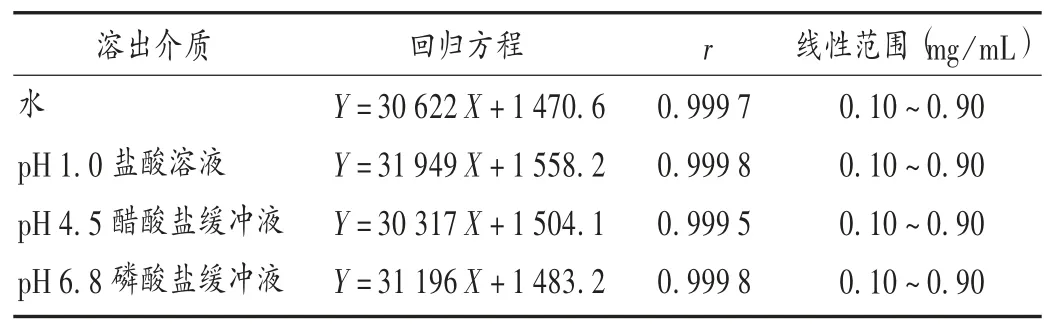
表1 線性關系考察結果(n =5)Tab.1 Results of linear relation test(n = 5)
精密度試驗:取 2.3 項下對照品溶液,按 2.1 項下色譜條件重復進樣測定6 次。結果水、pH 1.0 鹽酸溶液、pH 4.5 醋酸鹽緩沖液、pH 6.8 磷酸鹽緩沖液 4 種溶出介質的 RSD 分別為 0.15% ,0.20% ,0.27% ,0.21%(n =6),表明儀器精密度良好。
穩(wěn)定性試驗:吸取2.3 項下4 種溶出介質45 min時的供試品溶液適量,分別于室溫下放置0,2,4,8,16 h時,按2.1 項下色譜條件進樣測定,結果左乙拉西坦的峰面積幾乎無變化,水、pH 1.0 鹽酸溶液、pH 4.5 醋酸鹽緩沖液、pH 6.8 磷酸鹽緩沖液的 RSD 分別為0.75% ,0.66% ,0.49%,0.70% (n =5),表明供試品溶液在室溫條件下放置16 h 穩(wěn)定性良好。另分別取4 種溶出介質在45 min 時的供試品溶液適量,置37 ℃水浴中保溫,同法測定,結果的 RSD 分別為 0.83% ,1.06% ,0.79%,0.85%(n =5),表明供試品溶液在 37 ℃放置 16 h穩(wěn)定性良好。
加樣回收試驗:取左乙拉西坦對照品適量,精密稱定,置容量瓶中,按處方量加入輔料,分別用4 種溶出介質溶解,稀釋,配制成相當于制劑中藥物含量80%,100%,120%的濃度,混勻,制成低、中、高3 種濃度的溶液,各3 份,離心,按2.1 項下色譜條件進樣測定,并計算加樣回收率。結果見表2。
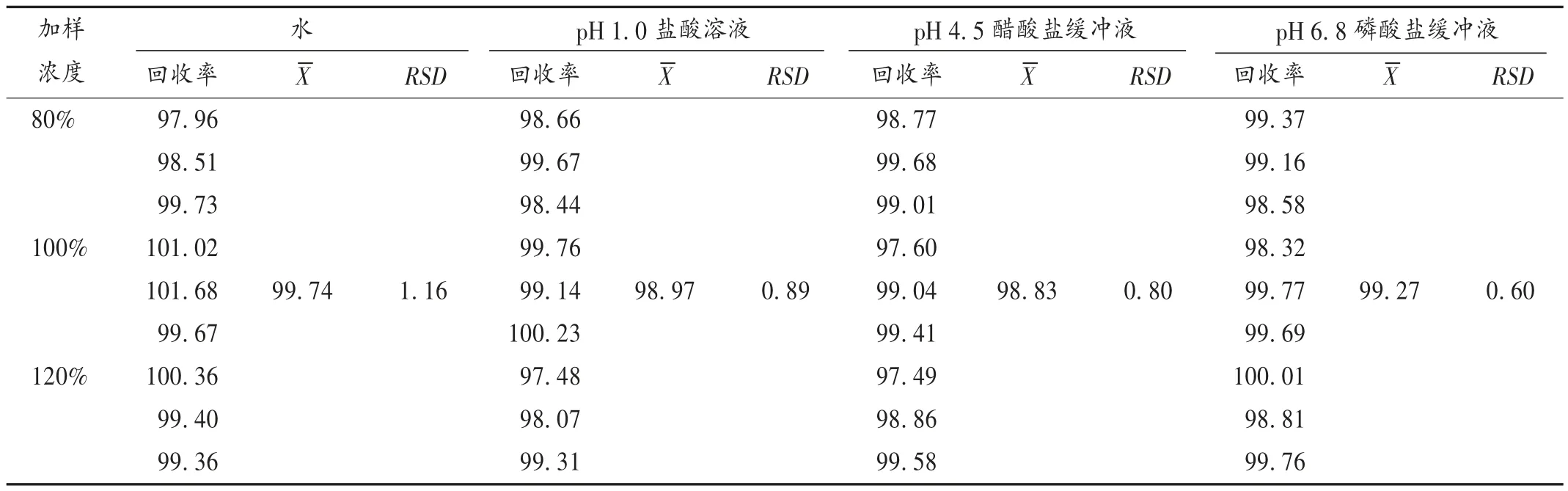
表2 4 種溶出介質中左乙拉西坦加樣回收試驗結果(%,n =9)Tab.2 Results of the recovery test of levetiracetam in four dissolution media(%,n = 9)
濾膜吸附試驗:取左乙拉西坦原研藥1 片,置500 mL容量瓶中,加500 mL 水,于 37 ℃水浴振搖 45 min,放冷至室溫,搖勻,離心(轉速為 5 000 r/min)10 min,0.45 μm 聚醚砜微孔濾膜濾過,分別棄去 1,2,3,4,5 mL 后,按 2.1 項下色譜條件進樣測定,記錄色譜圖。結果棄去 1,2,3,4,5 mL 后的回收率分別為98.68% ,99.22% ,99.10% ,99.83% ,99.55% ,表明使用0.45 μm 聚醚砜微孔濾膜過濾對左乙拉西坦基本無吸附作用,不干擾測定結果。
管路吸附試驗:在水的溶出曲線的最后1 個取樣點分別進行手動取樣和儀器自動取樣,并進行含量測定,結果2 種溶出液測定峰面積基本一致,表明溶出儀管路對左乙拉西坦基本無吸附干擾。
2.5 溶出度測定
取1 批(批號為195846)左乙拉西坦片原研制劑與4 批(批號分別為 A1802061,A1701202,A1701203,A1701204)左乙拉西坦片仿制制劑(各12 片),按2015年版《中國藥典(四部)》通則0931 第二法進行溶出度測定。分別取2.2 項下4 種溶出介質,依法操作,分別于5,10,15,30,45 min 時取溶出液 5 mL 后補充相同溶出介質,溶出液用0.45 μm 微孔濾膜濾過,取續(xù)濾液作為供試品溶液。取供試品溶液及2.3 項下對照品溶液,按2.1 項下色譜條件進樣測定,并按外標法計算每片樣品在各時間點的累積溶出度,繪制溶出曲線。詳見圖1。
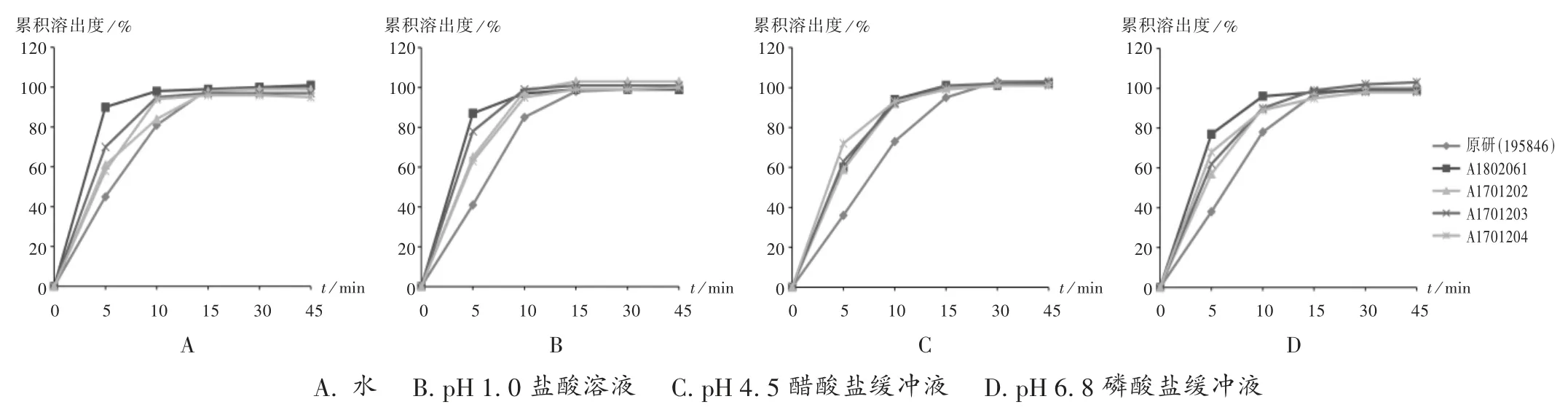
圖1 仿制和原研左乙拉西坦片在4 種溶出介質中的溶出曲線(n =12)A. water B.pH 1.0 hydrochloric acid solution C.pH 4.5 acetate buffer solution D.pH 6.8 phosphate buffer solutionFig.1 Dissolution profiles of generic and original Levetiracetam Tablets in four dissolution media(n =12)
2.6 溶出一致性評價
由圖1 可知,4 批仿制制劑與原研參比制劑在水、pH 1.0 鹽酸溶液、pH 4.5 醋酸鹽緩沖液、pH 6.8 磷酸鹽緩沖液中15 min 時的溶出量均大于85%,可直接判定二者溶出行為相似,故不再計算 f2值[12]。
3 討論
國務院于2012 年發(fā)布的《國務院關于印發(fā)國家藥品安全“十二五”規(guī)劃的通知(國安〔2012〕5 號》中明確提出,要推進仿制藥質量一致性評價,全面提高仿制藥質量[13]。測定在多種溶出介質中仿制藥與參比制劑的溶出曲線,是多國評價口服固體制劑內在質量的重要手段,也廣泛用于預測生物等效性[14]。本研究中選取4 批左乙拉西坦仿制藥與1 批同規(guī)格原研藥在4 種溶出介質中進行溶出度測定試驗,并繪制溶出曲線,對比發(fā)現(xiàn),仿制藥與原研藥在4 種溶出介質中的溶出曲線具有相似性,屬于快速溶出,表明左乙拉西坦仿制藥與原研藥體外溶出行為一致,其質量一致性較好。

