烯烴硼氫化反應機理的進一步探討
張磊,周建國,周永柱,2
1天津城建大學理學院,天津 300384
2天津大學化工學院,天津 300072
烯烴的硼氫化反應是親電加成反應的重要類型之一,所得有機硼產物是一類重要的有機合成中間體,可經氧化、還原和絡合催化反應來實現多種多樣的官能團化。以丙烯與B2H6的反應為例,在圖1中顯示了對硼氫化反應的一般看法:BH3的2pz空軌道與烯烴雙鍵的成鍵π軌道重疊,形成一種π-絡合物;反應不經歷碳正離子中間體,B―H鍵的斷裂以及H和BH2分別加到雙鍵的兩個C原子上是協同完成的,經歷一個四中心環狀過渡態,直接得到加成產物;反應具有反馬氏加成和順式加成的特點[1–5]。
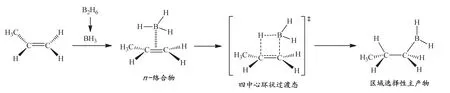
圖1 硼氫化反應及其機理
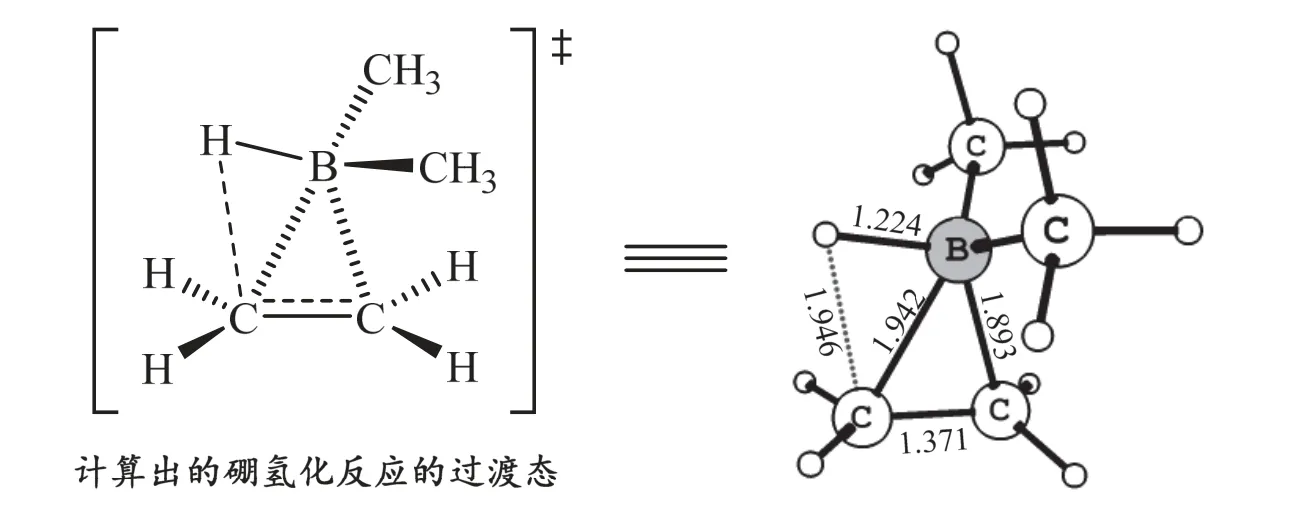
圖2 Schleyer等人采用MP2/6-31G*方法計算出的(CH3)2BH與乙烯反應的過渡態(鍵長以?為單位)
為了深入剖析硼氫化反應機理,我們結合文獻和理論計算,考查過渡態的結構特征,揭示其與傳統的四中心環狀結構的差別,并從分子軌道相互作用的角度解讀此反應機理。
1 硼氫化反應的機理和過渡態結構
我們采用Gaussian 09量子化學軟件、密度泛函理論B3LYP方法[9]和6-31G*基組,模擬了丙烯的硼氫化反應機理。首先,以BH3、BH2CH3和BH(CH3)2為試劑,分別考查它們與雙鍵形成的前體絡合物,圖3(a)給出了三種絡合物的穩定構型示意圖和結合能。由此可見,BH3和BH2CH3都與烯烴形成較強的相互作用,其實質是B原子的2pz空軌道與雙鍵的成鍵π軌道之間的重疊,作用能分別為49.4和15.4 kJ·mol?1。相反,BH(CH3)2與丙烯形成很弱的分子間作用,其強度僅為4.4 kJ·mol?1,這可能是CH3的給電子效應使缺價的B原子趨于穩定以及空間位阻效應所致。
如圖3(b)所示,選擇BH(CH3)2試劑,幾何優化得到此硼氫化反應的唯一過渡態TS,其中B原子與雙鍵的兩個C原子相距分別為1.802和1.943 ?,與圖3(a)的原子間距相比,推斷此時的B原子與雙鍵的兩個C原子均存在一定的鍵合作用,而且B―H鍵的斷裂和C…H鍵的形成在TS中是不明顯的,即是一個早期過渡態,因為它們的原子間距分別為1.245和1.792 ?,前者比正常B―H鍵略長,后者比正常C―H鍵長很多,甚至比某些氫鍵距離還長。從結構上看,該TS與所謂的四中心環狀結構并不相像。以R作為能量零點,圖3(b)繪制了能量–反應進程曲線,容易判斷反應的活化能為26.7 kJ·mol?1,總反應釋放能量116.5 kJ·mol?1。

圖3 密度泛函理論計算出的BH(CH3)2與丙烯之間的反應機理(鍵長以?為單位)
已確認了硼氫化反應的過渡態并不像圖1所示的四中心環狀結構,接下來要探索硼氫化反應是否經歷了類似于四中心環狀結構的瞬間狀態?為此,我們進行了內稟反應坐標的計算,在從TS到P的反應路徑上計算表征了72個點(由于它們出現在過渡態之后,故稱其為后過渡態點),來詳細描繪從TS到P的結構動態改變。圖3(b)的曲線標出了兩個后過渡態點(State I和State II),其中State I的能量已降低至?25.3 kJ·mol?1,B…C2距離(1.943 ?)比B―C1距離(1.631 ?)要長得多,說明B原子主要與C1去鍵合,而且H從B遷移到C2的過程正處于發展期;與TS相比,State I與圖1所示的四中心環狀結構更接近。State II比State I更靠近P,B與C2的原子間距較遠(大于2.0 ?),此結構與四中心環狀結構較為接近。因此,傳統的四中心環狀結構比較貼近于某些后過渡態點,它們是硼氫化反應(從TS到P)所需經歷的瞬間狀態,而不像過渡態TS的結構特征。
此外,我們還計算了生成馬氏加成產物的反應機理和相應的過渡態TSa,發現TSa與TS有類似的結構特征,其活化能為39.0 kJ·mol?1,比反馬式加成路徑的活化能要高12.3 kJ·mol?1。由于區域選擇性不是本文的主要討論點,相關內容不在文中呈現。
2 軌道相互作用分析
本節從分子軌道相互作用的觀點來理解硼氫化反應的機理。由于烯烴是電子給體,硼烷是電子受體,所以需考查的主要分子軌道包括烯烴的成鍵π軌道、B―H鍵的反鍵σ軌道和B原子的2pz空軌道,分別記作π(CC)、σ*(BH)和2pz(B)。π(CC)與σ*(BH)之間的相互作用應該是對稱性禁阻的,而π(CC)與2pz(B)之間的相互作用是對稱性允許的,所以在加成過程中雙鍵的電子云會向硼原子的2pz空軌道轉移,促進雙鍵的兩個C原子與B原子同時成鍵[10],如圖4左側所示。從軌道相互作用的角度分析該反應:2pz(B)與一個C原子的2pz(C)軌道重疊,形成一個sp3–sp2的C―B鍵;B―H鍵斷裂,導致σ(BH)和σ*(BH)演變為1s(H)和sp2(B),1s(H)與另一個C原子的2pz(C)軌道重疊形成C―H鍵,sp2(B)則演變為B原子上的2p空軌道。
此外,我們采用B3LYP/6-31G*方法計算了反應物的前線分子軌道,丙烯的最高占據分子軌道(HOMO)和硼烷的最低空分子軌道(LUMO)在圖4右側給出。這兩個前線分子軌道都是離域分布的,丙烯的HOMO主要是由雙鍵的成鍵π軌道所貢獻,硼烷的LUMO主要是由硼原子的2pz空軌道所貢獻。從能級間隔和對稱性的角度看,它們之間的相互作用應該是最有利的,并且與圖4左側所描繪的軌道相互作用在定性上是一致的。

圖4 硼氫化反應的軌道相互作用分析
3 結語
綜上所述,硼氫化反應是不經歷碳正離子中間體的協同加成機理,但是反應的過渡態并不像一般認為的四中心環狀結構,因為在過渡態中B原子與雙鍵的兩個C原子都存在一定的鍵合,并且H原子從B遷移到C上的趨勢是微弱的。通過理論計算,我們認為反應需經歷某些類似于四中心環狀結構的瞬間狀態,它們在過渡態之后、產物之前出現,比過渡態要穩定得多。此外,從分子軌道相互作用的觀點容易理解反應的本質。本文的討論有助于學生深入理解硼氫化反應的詳細機理,也有助于學生提高有機反應機理的分析能力。

