“鉻”顯神通
——過氧化氫環境下三價鉻的變化探究
吳嘉璇,溫瀚韜,吳鍶敏,梁泳彤,鐵紹龍,李玥
華南師范大學化學學院,廣州 510006
鉻位于元素周期表中d區第一過渡系列,價態豐富,其化合物顏色多變,化學性質多樣,如氧化還原性、配位性和磁性等,是大學基礎無機化學重點考察的特征元素。為了更直觀地了解鉻的物理化學性質,《無機化學實驗》《基礎化學實驗》等教材[1–4]均設計了對鉻化合物性質的驗證實驗,但在進行Cr(III)與過氧化氫反應驗證三價鉻的還原性的實際操作中,接近一半的學生未得到預期實驗結果。通過文獻調研發現[5],Cr(III)與過氧化氫的反應是一個復雜但有趣的反應,在不同的反應條件下,生成的產物不同,呈現的溶液顏色不同,即若反應條件控制不當,往往得不到預期結果。因此,本文針對Cr(III)與過氧化氫反應的影響因素進行了探究,對實驗結果進行了分析。另外,本文介紹了相關實際應用與趣味實驗,以供實驗課教學參考。
1 實驗儀器及藥品
實驗儀器:pHS-3C型精密pH計、電子天平、燒杯(5 mL、50 mL、100 mL)、量筒(5 mL、10 mL、100 mL)、試管、離心試管、離心機、膠頭滴管、玻璃棒。
實驗藥品:0.1 mol·L?1硫酸鉻溶液、30%過氧化氫溶液、硫酸溶液(2 mol·L?1、4 mol·L?1、8 mol·L?1、濃)、氫氧化鈉溶液(2 mol·L?1、4 mol·L?1、8 mol·L?1)。
2 實驗步驟及現象
2.1 探究溶液pH對Cr(III)與過氧化氫反應的影響
2.1.1 實驗步驟
(1) 室溫下,不同pH的Cr(III)溶液的配制:加酸或堿調節0.1 mol·L?1Cr2(SO4)3溶液pH分別為2.00、4.10、5.65、6.75、8.43、10.03、11.72、13.37。
(2) 分別取5 mL上述溶液于8支試管中,然后向其逐滴加入30% H2O2溶液,直至溶液不再發生變化,觀察并記錄實驗現象。
2.1.2 實驗現象及結論
不同pH條件下,Cr(III)與30% H2O2的反應現象見圖1,并由此分析得出pH對該反應的影響,見表1。
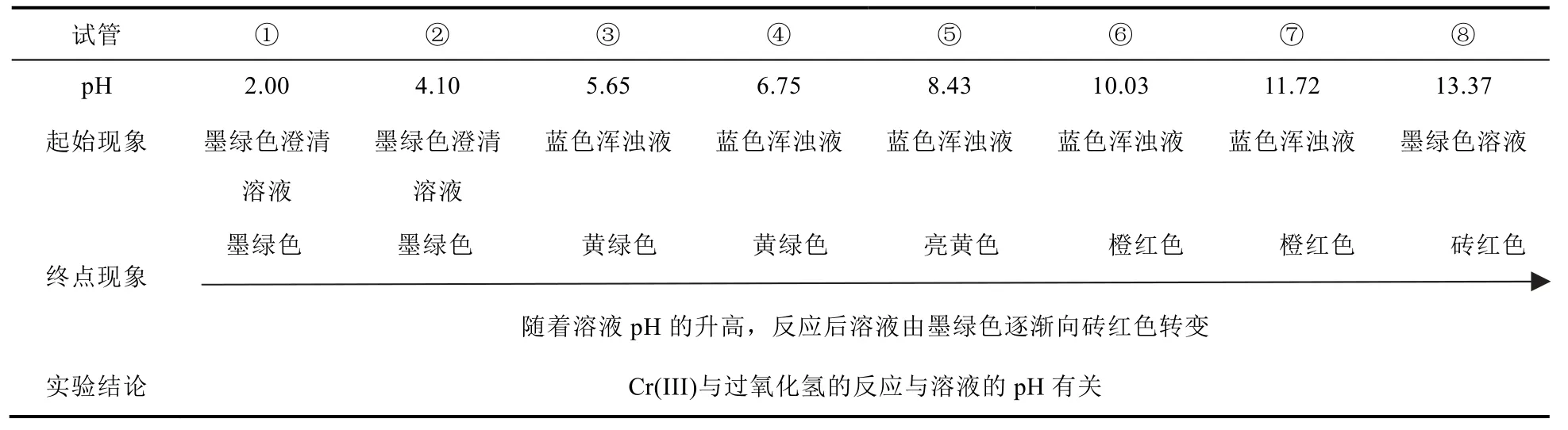
表1 pH對Cr(III)與H2O2反應的影響
2.1.3 實驗原理
(1) 滴加30% H2O2溶液前。
查閱資料[6–8]可知:當c[Cr(III)] = 0.2 mol·L?1時,pH = 4.17時開始生成藍色氫氧化鉻沉淀,pH =5.60時沉淀完全,隨著pH的繼續升高,沉淀會慢慢溶解直至完全。因此,試管①②溶液為墨綠色溶液,試管③–⑦中為藍色渾濁液,試管⑧溶液恢復墨綠色澄清溶液。
(2) 滴加30% H2O2溶液直至過量。
試管①②中溶液未發生明顯變化,即Cr(III)在此環境下不能與H2O2發生反應或者與H2O2反應非常緩慢;試管③–⑤藍色沉淀都消失,溶液變為黃綠色或黃色,在此過程中可能發生以下反應:
2Cr(OH)3+ 4OH?+ 3H2O2= 2CrO42?+ 8H2O
CrO42?的溶液為黃色,但Cr(III)被H2O2氧化成Cr(VI)的過程中消耗OH?,pH降低,Cr(OH)3溶解生成Cr3+,則出現綠色Cr3+和黃色CrO42?混合后的黃綠色溶液。
試管⑥–⑧溶液呈現橙色或者磚紅色,且隨著pH增大,溶液顏色越紅[9]。可能是在堿性條件下,H2O2酸式解離產生的HO2?進攻Cr(III)O2?的氧化產物Cr(VI)O42?,從而過氧根取代氧配體,并伴隨鉻的單電子還原,最終形成磚紅色的[Cr(O2)4]3?或Cr(V)O83?[9–17]:
2CrO42?+ 7H2O2+ 2OH?= 2CrO83?+ 8H2O
其中,由Cr(V)O83?轉化為Cr(V)O83?的可能機理如下[16]:
H2O2+ OH?? HO2?+ H2O
[CrVIO4]2?+ HO2?? [HCrVI(O)4(O2)]3?
[HCrVI(O)4(O2)]3?? [CrVI(O)3(O2)]2?+ OH?
[CrVI(O)3(O2)]2?+ H2O2? [CrVI(O)2(O2)2]2?+ H2O
[CrVI(O)2(O2)2]2?+ H2O2→ [CrV(O2)4]3?+ H2O
值得注意的是,OH?在該反應中至關重要。在酸性條件下,Cr(III)與H2O2反應生成Cr(VI),但未進一步反應生成Cr(V),這可能是與過氧根取代和鉻的單電子還原過程有關。研究發現[10,16],鉻的單電子還原是發生在三個過氧根取代氧配體后,但在酸性條件下,CrO42?被兩個過氧根取代后會發生歧化反應,放出氧氣,不能進一步被還原成CrO83?,所以在該條件下,溶液并沒有由黃色變為磚紅色。而隨著OH?濃度增大,一方面OH?在反應中會與HO2?競爭配位Cr離子,從而抑制過氧根與鉻離子配位;另一方面,在酸性條件下過氧根與鉻配位生成的產物不穩定,容易分解放出氧氣,重新生成沒有過氧根配位的鉻離子,相反,在堿性條件下過氧根鉻配合物是穩定存在的。即從動力學上講,堿性環境對該反應是抑制作用,但同時在熱力學上,堿性條件穩定了最終產物,促進了該反應;另外,HO2?的濃度會隨著pH的升高而增大。因此溶液堿性越強,[Cr(O2)4]3?或Cr(V)O83?的生成量越多,磚紅色越深。
因此,溶液酸堿度的不同,Cr(III)與過氧化氫的反應進行程度不同,產物不同。
2.2 探究H2O2濃度對Cr(III)與過氧化氫反應的影響
通過pH實驗的探究發現,當溶液環境為強堿性時,溶液所經歷的化學反應最豐富,因此探究H2O2濃度對Cr(III)與過氧化氫反應的影響時,選擇pH > 13的Cr2(SO4)3溶液作為該探究反應底物。
2.2.1 實驗步驟
將配制的0.1 mol·L?1Cr2(SO4)3溶液的pH調至13.50后,分別取3 mL該溶液至6支試管中,然后向其逐滴加入濃度分別為3%、8%、13%、18%、23%、30%的H2O2,觀察并記錄每滴后的試管中的實驗現象(圖2),并由此分析出H2O2濃度對該反應的影響,見表2。

表2 反應物濃度對反應的影響

圖2 Cr(III)與不同濃度H2O2反應的實驗現象(pH = 13.50)
2.2.2 實驗原理
隨著過氧化氫濃度的增加,Cr(III)與過氧化氫的氧化還原反應趨向完全,生成物的顏色由亮黃色不斷加深至磚紅色。值得注意的是,無論3%的H2O2過量多少,溶液都停留在亮黃色,不能進一步反應生成磚紅色物質。在pH = 13.50時,Cr(III)與過量的不同濃度過氧化氫發生以下化學反應[9,10]:
Cr3++ 3OH?= Cr(OH)3↓
Cr(OH)3+ OH?= CrO2?+ 2H2O
2CrO2?+ 3H2O2+ 2OH?= 2CrO42?+ 4H2O
2CrO42?+ 7H2O2+ 2OH?= 2CrO83?+ 8H2O
2.3 探究溫度對Cr(III)與過氧化氫反應的影響
2.3.1 實驗步驟
分別取3 mL濃度實驗中配制的pH = 13.50 Cr2(SO4)3溶液于5支試管中,并將其分別置于0 °C、25 °C、50 °C、75 °C、100 °C的水浴中,然后向試管中各滴加過量30% H2O2溶液,觀察并記錄實驗現象(如圖3),并由此分析溫度對該反應的影響,見表3。

圖3 Cr(III)與30% H2O2在不同溫度下反應的實驗現象(反應時間t = 30 min)

表3 溫度對Cr(III)與30% H2O2反應的影響
2.3.2 實驗原理
由以上實驗結果可知,隨著反應溫度的升高,反應后溶液顏色由紅棕色向亮黃色轉變。反應過程與濃度實驗相同,但生成的紅色物質CrO83?不穩定,隨著溫度的上升會逐漸分解為亮黃色的CrO42?[14,16,18]。值得注意的是,生物體內因過量過氧化氫導致生成的紅色物質CrO83?被認為是造成生物體內DNA損傷的重要禍首[19]。
4CrO83?+ 2H2O = 4CrO42?+ 4OH?+ 7O2↑
綜上三個實驗的探究可得,Cr(III)與過氧化氫的反應產物與溶液的酸堿度、過氧化氫濃度和反應溫度密切相關,反應條件不同,化學反應過程不同,中間產物和最終產物也不同,因此,二者的反應溶液呈現出豐富的顏色。
3 鉻離子轉化關系與小結
結合以上探究結果以及文獻調研[5],我們對鉻離子的轉化關系進行了歸納,提出了圖4的鉻離子轉化關系圖。相應的化學反應方程式如下:


圖4 鉻離子轉化關系圖
在強堿條件下,Cr3+與OH?首先反應生成沉淀Cr(OH)3,氫氧化鉻與過量的OH?進一步發生反應,生成CrO2?;而墨綠色的CrO2?在該環境下能與H2O2反應生成黃色的CrO42?,也可能反應生成磚紅色的CrO83?。針對這一過程的探究結果可總結如下:
(2) 不同pH條件下,該反應進行程度不同。隨著pH的增大,Cr3+與H2O2由強酸下不反應,到逐漸能夠反應生成黃色的CrO42?,再到堿性條件下,可進一步生成磚紅色的CrO83?。
在該反應中,OH?至關重要,因為在堿性條件下,H2O2酸式解離產生的HO2?進攻CrO2?的氧化產物CrO42?,從而過氧根取代氧配體,伴隨鉻的單電子還原,才最終形成磚紅色的CrO83?,因此溶液的pH是影響該反應的重要因素。
(3) H2O2的濃度也是影響該反應的因素之一。過量的低濃度H2O2與Cr3+反應只能停留在黃色的CrO42?這一步驟,但高濃度H2O2可與Cr3+進一步反應生成磚紅色的CrO83?,可能是因為低濃度的過氧化氫配位能力較弱,無法與Cr(VI)配位,從而進行下一步反應。
(4) Cr3+與H2O2的反應與反應溫度有關。由于磚紅色的CrO83?對熱不穩定,因此隨著溫度的上升會逐漸分解為亮黃色的CrO42?。
4 相關應用及趣味實驗
4.1 相關應用
堿性環境中,Cr3+很容易被H2O2氧化為CrO42?。因此,利用H2O2處理Cr3+是一種環境友好型技術,在節能、資源綜合利用效率和環境污染等方面具有顯著優勢。
4.1.1 處理鍍鉻溶液的Cr3+[20]
鍍鉻溶液加入雙氧水,在通電的條件下,鍍液中Cr3+含量下降;而不通電時,Cr3+含量上升。利用該現象和原理,通過控制通電時雙氧水的量、溫度、陽極電流密度等實驗條件,實現雙氧水對Cr3+含量的調節。
4.1.2 鉻的快速測定方法[21]
1.推動“三變”改革。以農民為中心,強化農民主體地位,以敢為人先、銳意突破、實事求是的“小崗精神”推動“資源變資產、資金變股金、農民變股東”的“三變”改革。“三變”改革的前提要摸清農村集體資產的家底,做好清產核資、確權頒證工作,盤活農村資源資產,探求農村集體經濟新的實現形式和運行機制。引導農民以土地、參股、手藝參股集體經濟,盤活閑置的農村宅基地和民房,開展民俗、民宿為主的鄉村旅游,增加農民財產性收入,積極發展農業產業化經營聯合體,健全利益聯結機制與分享機制,帶動農民共同富裕。[6]
在生活中對天然和人造革中的鉻進行快速測定時,先用30%的過氧化氫和濃硫酸的混合物分解皮革至透明溶液,再用高錳酸鉀溶液將三價鉻氧化為六價鉻;或者用硝酸和硫酸分解皮革中的有機物,再用氯酸鉀氧化三價鉻為六價鉻。獲得溶液中的六價鉻濃度再用碘量法或滴定法測定,從而實現對化合物中鉻的測定。
4.2 相關趣味實驗
受上述探究啟發,我們設計了下列趣味實驗可以吸引學生的注意力,提高學生的學習興趣,幫助學生理解課堂教學內容,加強學生對鉻的化合物之間相互轉化原理的理解,強化理論認知。
4.2.1 自制過氧化氫濃度試紙
將濾紙浸沒在一定濃度的硫酸鉻的強堿性溶液中,待完全浸透后取出晾干。濾紙剪成條狀,向其滴加不同濃度的過氧化氫溶液,根據其呈現的顏色變化,分辨出不同濃度的過氧化氫溶液。由于過氧化氫易揮發,在測試過程中要注意快速蘸取。
4.2.2 會變色的字
蘸取30%的過氧化氫溶液在4.2.1小節中制得的濾紙上寫字,呈紅色,再及時將試紙用吹風機稍加熱,字可由紅色變為亮黃色。如果再蘸取1–2次30%的過氧化氫溶液,實驗現象會更明顯。
4.2.3 會膨脹的氣球
在試管中加入適量0.1 mol?L?1硫酸鉻溶液,將硫酸鉻溶液的pH調節至強堿性,加入過氧化氫溶液,溶液從墨綠色變為磚紅色。在試管口套上一個氣球,將試管放入80 °C的水中,氣球從干癟變膨脹。
4.2.4 溫度監控器
在試管中加入適量0.1 mol?L?1硫酸鉻溶液,將硫酸鉻溶液的pH調節至強堿性,加入過氧化氫溶液,溶液從墨綠色變為磚紅色。將該試管放入所要測定的熱溶液中,若溶液變成亮黃色則達到設定溫度。
4.3 知識卡片
為了給學生完整的、科學的實驗操作訓練,我們設計了下方的知識卡片(圖5),簡單介紹了鉻的理化性質、注意事項和處理鉻廢液的方法[22]。

圖5 鉻的知識卡片
5 結論和意義
本文探究了pH、反應物濃度以及反應溫度等因素對Cr(III)與過氧化氫反應的影響,并提出了可能的反應機理。實驗結果表明,該反應過程復雜,實驗條件不同,實驗現象不同。因此,在學生進行驗證實驗時,應嚴格控制實驗條件,方可得到預期結果。另外,本文在探究實驗的基礎上,介紹了實際應用,延伸出相關趣味實驗,便于學生對于鉻的化合物氧化還原反應原理的理解,提高學習興趣,以供教學參考。

