芻議質譜技術發現新型蛋白質翻譯后修飾研究在化學與生物學教學中的應用
王志鵬,張璇,車子良,蔣振雄,馬新雨
1 Division of Genetics, Department of Medicine, Brigham and Women’s Hospital, Department of Biological Chemistry and Molecular Pharmacology, Harvard Medical School, Boston, MA 02115, USA.
2 Department of Chemistry, Texas A&M University, College Station, TX 77840, USA.
3清華大學化學系,北京 100084
4清華大學生命學院,北京100084
5 Department of Mathematics, Harvard University, MA 02138, USA.
6 Department of Biology, Texas A&M University, College Station, TX 77840, USA.
質譜技術在最近幾十年間得以突飛猛進的發展與應用,尤其是串級質譜的發展對于化學和生命科學等眾多分支學科起到了極大的推動作用。可以說一系列組學的創立就是以質譜為基礎的,例如蛋白質組學(Proteomics)、表觀遺傳組學(Epigenomics)和代謝組學(Metabolomics)等[1]。其中,基于串級質譜的蛋白質翻譯后修飾及表觀遺傳組學是后基因組時代的重要研究領域。
翻譯后修飾是表觀遺傳學的核心組成之一,在體內的胞質蛋白、膜蛋白和核蛋白上都大量存在。尤其是以組蛋白為代表的核蛋白,其上的各類修飾可能改變DNA分子在組蛋白異源八聚體上纏繞的緊密程度,進而直接影響染色體結構。同時,這些翻譯后修飾還可以影響mRNA轉錄酶復合體II及各種其他轉錄因子(Transcriptional factor)的結合,進而改變基因的轉錄活性[2]。值得一提的是,所有的蛋白質翻譯后修飾均涉及三類蛋白質或酶類,包括“寫錄者(Writer)”,“讀取者(Reader)”和“擦除者(Eraser)”。這三者精密配合,共同調控翻譯后修飾[3]。
質譜本身作為分析化學技術對于蛋白質翻譯后修飾的各個研究領域均有重要作用。而新型蛋白質翻譯后修飾的發現和驗證則可作為極佳的教學素材用于化學、生物學和醫學等交叉學科的基礎教學中,可以融入例如有機化學、生物化學、酶學、化學生物學、分子生物學、遺傳學、生物物理學等一系列二級學科中。而對于新型蛋白質翻譯后修飾這一過程的探索發現極大地體現了化學發現新結構這一永恒的主題,頗有偵探推理“抽絲剝繭”的意味,在將深刻的前沿生物化學知識融入基礎化學的同時可以充分調動學生的興趣[4]。并讓學生從這些研究中看出基礎有機化學和分析化學知識對于前沿生命科學研究仍然具有的重要意義。對培養新時代的創造性跨學科人才有重要作用。本文將從質譜技術原理入手,以若干新型蛋白質翻譯后修飾的發現研究為典例,按照科學哲學的邏輯為基礎,探討結合質譜技術在化學與生物學教學中的意義與重要性,以期對相關領域的教學和研究有助[5]。
1 質譜技術簡述
質譜技術本身的知識屬于分析化學或儀器分析。但可以劃歸入基礎有機化學、生物化學和化學生物學等二級學科中。在基礎教學尤其是非分析化學課程教學中有必要首先講解現代質譜技術的發展與應用。
1.1 質譜概要
質譜作為一種基于分子量的分析化學工具,在過去的20年內發生了很多重大的革新。以電噴霧質譜(ESI)[6]和基質輔助激光離子化(MALDI)[7]為代表的新型離子化手段的出現使得蛋白質分析成為了可能。伴隨硬件的發展,質譜的檢測器也實現了多樣化,發展出飛行時間(TOF)、四級桿(Quadrupole)、離子阱(Ion traps)、軌道離子阱(Orbitraps)和離子回旋共振(ICR)五大類,并使用傅里葉變換(FT)進行數據處理。這些檢測器不僅可以生成被測物的質荷比信號(m/z),還可以得出不同荷質比的相對強度,進而生成最終的質譜圖譜。對于蛋白質這些大分子量生物分子,其可以同時帶有若干電荷,故而人們發展了對應的軟件進行特定峰值的劃歸計算,即去卷積化(Deconvolution)。
當被分析的生物大分子處于復雜的混合物狀態時,我們需要進行液質聯用(HPLC-MS)。經由HPLC先對樣品進行純化分離后,再送入質譜分析。這樣的混合物狀態可以直接來自細胞裂解液或者提純的細胞器或細胞核,還可以是人為進行蛋白質酶解后所得的多肽片段混合物。值得注意的是,在使用C18反相柱色譜進行分離純化的同時,多肽也被富集到具有一定百分比有機溶劑的水相中,適合進一步分析。
1.2 串級質譜概要
串級質譜(Tandem MS或MS/MS)是一種具有分析蛋白質序列這一強有力手段的質譜衍生技術。在檢測荷質比后,具有特定荷質比的前體離子(Precursor ion)將被電磁場分離,并與惰性氣體分子進行碰撞而裂解形成子代離子(Daughter ion)。子代離子進而被下一級質譜檢測。除了與稀有氣體分子的碰撞而導致解離(CID)外,電子轉移(ETD)、電子捕獲(ECD)等也能導致前體離子的解離。
解離涉及到前體離子化學鍵的斷裂,故而鍵能較弱的共價鍵易于斷裂。由于解離過程包含有前體離子的結構信息,故而串級質譜可以反映前體離子的結構。這對于多肽尤其重要,雖然多肽所裂解產生的子代離子可能有多種不同的模式,但都具有逐個氨基酸的信息[8]。故而,將同種前體離子檢測到的所有子代離子的荷質比合并作圖可得串級質譜圖譜。將串級質譜圖譜與同種前體離子可以產生所有的理論子代離子相互對比即可確定多肽的序列。這一過程通過特定的計算機軟件算法得出,之后則需人工進行峰歸屬劃分[9]。隨著檢測需求的增加,相關的配套軟件也進行了不斷的升級和改進。為了進一步提升軟件對于肽和翻譯后修飾(PTM)識別的準確性和靈敏度,趙英明課題組[10]近來開發了PTMap軟件。該軟件包含了峰值選擇、不精確誤差調整和PTM的精確定位等功能。而對于不匹配的峰,該軟件還能自動執行基于手動驗證規則的肽段鑒定,提高了后期修正的效率。
1.3 質譜對翻譯后修飾研究的應用
質譜對于翻譯后修飾領域的發展具有極為關鍵的作用,可以說翻譯后修飾的發現、功能研究都直接或間接與質譜相關。可以分為主要幾個方面。首先,質譜技術可以用于發現和確定新的翻譯后修飾模式,這種定性研究是后續研究的基礎。其次,借助于質譜技術,我們可以對某種翻譯后修飾進行定量研究,以確定某種特定的翻譯后修飾在細胞生理或病理過程中的變化情況。這種定量研究同樣是后續研究的基礎。
之后三個應用都是基于前兩個完成的。第三,對于某種翻譯后修飾定量研究的結論,我們可以追本溯源地尋找其對應的“寫錄者”和“擦除者”,并進行進一步的生物化學和生物物理學研究。第四,同樣是基于某種翻譯后修飾定量研究的數據,我們可以搜尋其上游的“寫錄者”和下游的“讀取者”以明確其在細胞信號傳遞通路中的作用。最后,基于單一翻譯后修飾的定性、定量數據,我們可以進一步研究蛋白質翻譯后修飾之間的交叉感應(Crosstalk)的情況。本文將主要針對質譜與串級質譜技術對于新型翻譯后修飾的發現進行分析。從方法論出發,并列舉若干近年來的主要突破性進展。
2 質譜技術發現新型翻譯后修飾之總論
質譜的進步對新型翻譯后修飾的發現和確認可以算一次技術上的重大革新。這里可以簡單分為三大步驟。值得一提的是,人們通常選用組蛋白作為發現新型翻譯后修飾并研究翻譯后修飾的理想目標。一方面是組蛋白上存在豐富的翻譯后修飾,而這些翻譯后修飾也有重要的生物調控功能。另一方面,組蛋白相比其他胞質蛋白如代謝酶類具有更加豐富的量并易于進行生物化學和化學生物學處理。
2.1 分子量確認
傳統的以組蛋白為典型代表的翻譯后修飾的搜尋可以歸納為偶然的意外發現。而現代的精確質譜法對于新型翻譯后修飾的發現則形成了系統化的流程。高靈敏度的HPLC-MS/MS是檢測出低豐度新型翻譯后修飾的先決條件。而這一分析過程一般是在將目標蛋白質通過胰蛋白酶酶切形成的多肽片段上進行的。在未知理論分子量變化(ΔMr)的情況下,一級質譜算法可以實現無差別的全序列篩查。由于從分子量無法直接推斷序列及結構的信息,故而來自一級質譜的數據并不能直接確定修飾的更多結構信息。即便如此,人們也可以利用高精度的ΔMr數值與原子量的精確數值進行對比而計算出新型翻譯后修飾的分子式。進而通過串級質譜確定該翻譯后修飾所在的氨基酸位置。這可以確定一些可以修飾多種氨基酸殘基的翻譯后修飾的具體位置,例如賴氨酸和精氨酸都可以烷基化,而絲氨酸、蘇氨酸、酪氨酸和組氨酸都可以磷酸化。
2.2 結構確定
在確定分子式后,我們需要對新型翻譯后修飾進行可能的異構體排查以確定其結構式。理想情況下,我們直接將對應的翻譯后修飾蛋白或多肽進行核磁共振(NMR)分析即可,但是一方面我們很難提取到足夠的勻質的翻譯后修飾蛋白,另一方面NMR分析可能過于復雜。故而,我們需要用窮舉法列出所有的可能翻譯后修飾結構。一般說來翻譯后修飾的分子式不會過于復雜,通常在10個碳原子以內,使得可能的結構式也不會過于繁雜。我們進一步合成對應含有新型翻譯后修飾的多肽進行質譜和串級質譜研究,并與天然多肽的圖譜進行對比。利用一些細小的“指紋圖譜”一般能夠確定具體的結構。
2.3 最終確認
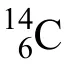
3 質譜技術發現新型翻譯后修飾之分論
在最近的數十年內,人們發現并解析了大量的新型翻譯后修飾。這些翻譯后修飾不僅存在于組蛋白上,還存在于各類胞質蛋白和膜蛋白上。下面分類列舉若干典型案例著重對發現過程進行討論。這部分主要引用芝加哥大學趙英明課題組的近期研究成果,該課題組主要致力于利用串級質譜技術對蛋白質的新型翻譯后修飾進行定性定量研究。
3.1 執果索因:賴氨酸三種二酰化
賴氨酸酰基化是一大類翻譯后修飾。最初人們對其的認識僅僅是乙酰、丙酰、丁酰等簡單的修飾模式[14]。直到二酰化的發現極大地突破了人類的認知。2012年,趙英明課題組[15]在人、小鼠、果蠅和酵母細胞的組蛋白上發現賴氨酸的丁二酰化(Succinylation)與丙二酰化(Malonylation)。與典型的新型翻譯后修飾發現的模式不同,由于丁二酰基在細胞內作為代謝中間體廣泛存在,尤其是在線粒體三羧酸循環中。該課題組之前已經在非組蛋白上鑒定到賴氨酸丁二酰化,進而預測丁二酰化賴氨酸亦存在于組蛋白的前提下對其進行蛋白質免疫印跡的檢定。之后用HPLC-MS/MS的手段檢測并分析出組蛋白上丁二酰化的修飾位點,并最終合成修飾后的多肽進行驗證。基于以上兩種二酰化翻譯后修飾,趙英明課題組[16]又于2014年發現了蛋白質的賴氨酸戊二酰化(Glutarylation)。考慮到結構的相似性,戊二酰基可以視為丙二酰基、丁二酰基的第三種同系物。該課題組同樣從免疫印跡法入手進而用串級質譜進行分析,發現并驗證了該翻譯后修飾在人體蛋白質組中廣泛存在。而重要的代謝酶氨基甲酰磷酸合成酶1 (CPS1)的戊二酰化修飾可以被組蛋白去乙酰化酶Sirtuin5脫除。這三種二酰化賴氨酸的發現極大地拓寬了人們對于翻譯后修飾的認識,不僅消除了賴氨酸在天然狀態下原本的正電荷,還附加了一個額外的負電荷,故而極大地影響了對應的底物蛋白質的結構功能與調控[17]。
3.2 上下求索:賴氨酸苯甲酰化
前三種二酰化賴氨酸的發現可以算是“有的放矢”,即在已經根據細胞代謝過程或其他信息猜想特定結構存在的前提下進行的檢測與驗證。其本身的過程較為直截了當,并不太符合前文所述的“發現–猜想–驗證”的模式。
新型翻譯后修飾層出不窮。直到2018年,趙英明課題組[18]還進一步發現了組蛋白上賴氨酸的苯甲酰化(Benzoylation)。該課題組在將胰蛋白酶處理后的HepG2細胞組蛋白提取物進行串級質譜分析過程中發現其H2B的第五位賴氨酸(K5)上帶有+104.0268 Da的增加。經過精細分子量比對,得出可能的修飾分子式為C7H4O。考慮到其帶有的一個自由價(單電子),且取代賴氨酸時需要脫去一個氫原子,劃歸后的修飾分子式為C7H6O。此分子式的不飽和度是5,推斷只能是“苯甲醛”(圖1)。故而得出該修飾為苯甲酰基修飾。在后續驗證中,合成的多肽和天然多肽,及二者的混合物均展現相似的特征串級質譜圖譜。該修飾是由于服用了作為美國食品藥品監督管理局(FDA)批準作為藥物及食品防腐劑的苯甲酸鈉而促進產生的,并可以進一步作為組蛋白翻譯后修飾參與生理調控。
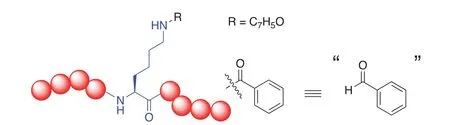
圖1 賴氨酸苯甲酰化的結構發現
從這里可以看出,要想準確確定修飾的分子式,其前提條件是精確測定的分子量增量。類似的還有賴氨酸的甲酰化的發現。雖然對于甲酰化和二甲基化均為+28 Da,但是二者相距0.0364 Da。Wisniewski課題組[19]通過串級質譜精確測定的分子量變化進而確定之,而甲酰基作為最簡單的一個碳原子的酰基化,只有唯一一種可能結構。而這一修飾的來源可能是DNA的氧化損傷[20]。
3.3 左右逢源:賴氨酸羥基異丁酰化(Hydroxyisobutyrylation)
如果說苯甲酰化的發現是一帆風順,而另外一種修飾的發現過程則一波三折。由于細胞內物質與能量代謝中可能產生各種各樣的活性酰基,這些酰基可以以酶促反應或非酶促反應的方式對蛋白質賴氨酸和氮端氨基進行修飾。故而存在各種可能的新型修飾結構。
早在2010年,趙英明課題組[21]就開始對新型蛋白質翻譯后修飾進行發現和研究。他們首先將胰蛋白酶處理后的小鼠睪丸細胞組蛋白提取物用HPLC-MS/MS分離鑒定,發現組蛋白H4第77位賴氨酸(K77)上帶有未知的+86.0354 Da的增加。根據精細分子量比對,得出可能的修飾分子式為C4H7O2,再確定劃歸后的修飾分子式C4H8O2。與前例中“苯甲醛”不同,單純從這一分子式的化學角度看似乎具有太多結構可能性,但接下來需要整合各種信息進行系統性推理并加以驗證。
首先,C4H8O2的不飽和度是1,結合賴氨酸修飾模式,最大可能是被酰基占用。再結合人體細胞代謝產物中一般不具有醚的結構,故而剩下的結構為羥基丙基結構。考慮其碳鏈的構造異構體,具有五種可能。首先是直鏈丙基上的伯碳取代形成羥基正丙基對應4-羥基丁酰(圖2A)、2位仲碳取代形成的2-羥基丙基對應3-羥基丁酰(圖2B)、3位仲碳取代形成的1-羥基丙基對應的2-羥基丁酰(圖2C);其次是支鏈異丙基的伯碳取代形成的2-羥基異丙基對應的3-羥基異丁酰(圖2D)和仲碳取代形成的1-羥基異丙基對應的2-羥基異丁酰(圖2E)。
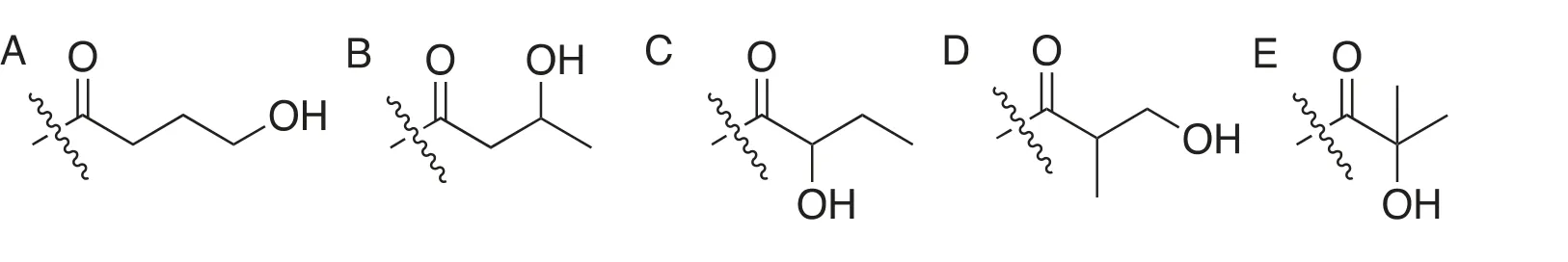
圖2 賴氨酸羥基丁酰化可能結構(1)
為了進一步確認新型翻譯后修飾的結構,Zhao等[22]利用多肽固相合成產生含有以上五種修飾的多肽,進行HPLC-MS/MS分析并與天然對應多肽進行對比。最終發現含有2-羥基異丁酰(圖2E)的多肽與天然修飾多肽具有一致的色譜保留時間及相同的串級質譜指紋圖譜。故而得出結論新型翻譯后修飾為賴氨酸的2-羥基異丁酰化(Khib)。該修飾被證明廣泛存在于細胞質組中。
3.4 前呼后應:賴氨酸β-羥基丁酰化(β-hydroxybutyrylation)
如果說羥基異丁酰化的發現結合了基礎有機化學同分異構體的知識,那么基礎生物化學知識在另一種修飾的發現過程中同樣起到了重要作用。這一典例進一步說明新型蛋白質翻譯后修飾的發現集合了多種交叉學科的知識,是極佳的教學素材。
無獨有偶,2016年趙英明課題組[23]用HPLC-MS/MS對胰蛋白酶處理后的HEK293細胞組蛋白提取物進行分析,在組蛋白H3的第18位賴氨酸(K18)上發現同樣的未知+86.0376 Da的增加。這種修飾雖然與2-羥基異丁酰化具有相同的分子式,但結構并不相同。由于生物體系都具有特定的手性選擇,考慮到手性中心的不同,需要將該列表拓展至8種,即(R/S)-3-羥基丁酰(圖3B1/2)、(R/S)-2-羥基丁酰(圖3C1/2)、(R/S)-3-羥基異丁酰(圖3D1/2) (圖3)。
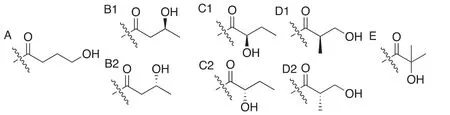
圖3 賴氨酸羥基丁酰化可能結構(2)
為了驗證結構,該課題組合成了分別帶有以上8種可能的修飾模式的多肽,并進行HPLC-MS/MS的鑒定。對于非對映異構體,其具有不同的化學結構,即便在非手性的HPLC柱色譜上也可根據不同的保留時間進行區分。可以將可能性縮小至3-羥基丁基(β-羥基丁基)即的兩種異構體(圖3B1/2)。
這里又需要借助于生物化學的分析。考慮到代謝中β-羥基丁酸(圖4I)是由乙酰乙酸(圖4G)還原而來,而后者又由乙酰輔酶A (Ac-SCoA,圖4F)縮合形成。β-羥基丁酸、乙酰乙酸和其非酶促脫羧產物丙酮(圖4H)這三者共同構成“酮體”(Ketone body)。其中,β-羥基丁酸是乙酰乙酸在3-羥基丁酸脫氫酶催化下還原形成,主要產物為R構象而非S構象。其之的可能代謝路線是形成-羥基丁酰輔酶A (圖4J),并最終酰化賴氨酸。故而可以推測修飾結構為R-β-羥基丁酰化。合成的含有R-β-羥基丁酰化賴氨酸的多肽片段和天然片段具有一致的保留時間和相同的串級質譜指紋圖譜,故而結構(KBhb)得以最終確認。
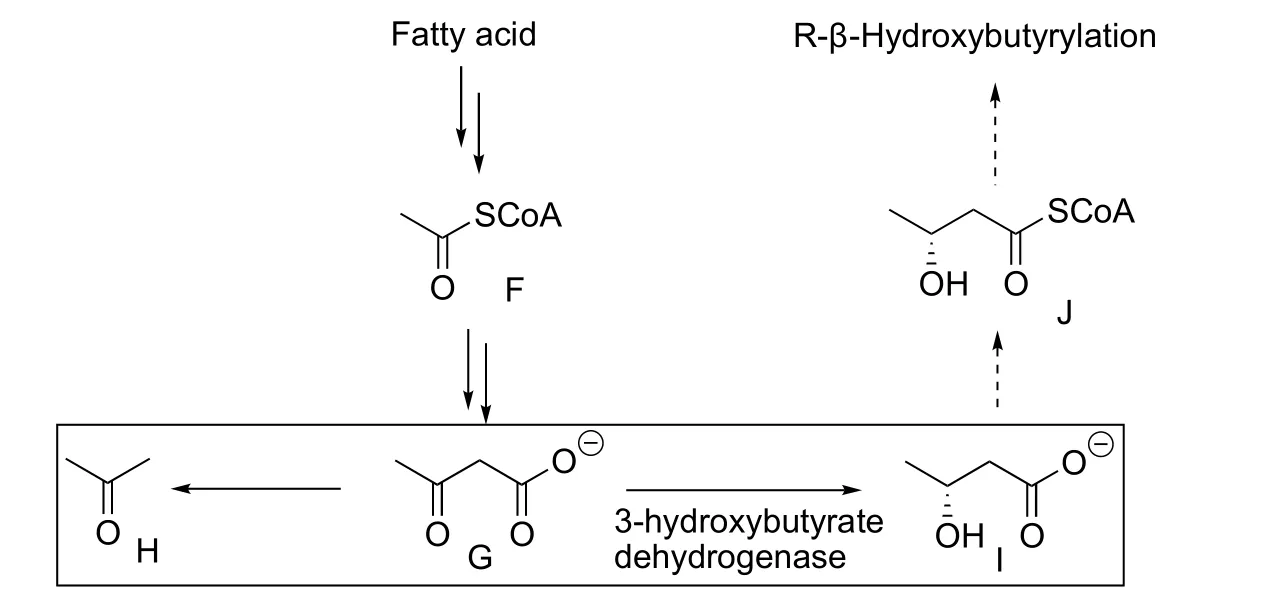
圖4 酮體與β-羥基丁酸的代謝
此外,2011年Zhao等[24]由組蛋白H2B第5位賴氨酸上發現+68.0230 Da,結合分子式的可能性和細胞代謝中間體分析確定為(Crotonylation);2019年由趙英明課題組[25]利用類似方式發現的賴氨酸乳酰化(Lactylation),也是由+72.021 Da的分子量增加入手,結合分子式的有機化學分析與代謝過程的生物化學分析進行確定驗證。
3.5 為果設因:賴氨酸4-氧代-2-壬酰化修飾
在前文所列舉的若干案例中,都是直接用液相色譜-串級質譜聯用直接從正常的培養細胞中提取蛋白質進行分析。而另外一些特別的情況則是讓細胞在人為控制的情況下生長進而進行類似分析。一個典型案例是4-氧代-2-壬酰化(4-ONEylation)的發現。由細胞代謝過程可知,長鏈脂質在氧化代謝過程中會產生多種α,β-不飽和醛類,例如4-羥基-2-壬醛(4-HNE)和4-氧代-2-壬醛(4-ONE)等(圖5)。從有機化學角度看這些α,β-不飽和醛類可以作為極好的邁克爾加成受體(Michael acceptor)并被細胞內的親核基團進攻,例如蛋白質上廣泛存在的賴氨酸、半胱氨酸和組氨酸等。其中,由于4-氧代-2-壬醛存在第2個羰基,故而理論上可以形成穩定的1,2-加成產物。
2014年,Marnett課題組[26]分析了在含有炔基官能化的4-HNE和4-ONE的培養基中生長的細胞,發現這兩類代謝產物會共價修飾組蛋白上的賴氨酸和組氨酸,代表性產物為4-氧代-2-壬酰化賴氨酸(圖5N)。而組蛋白H3第27位賴氨酸(K27)的4-氧代-2-壬酰化修飾甚至會抑制核小體的折疊。這種新型賴氨酸翻譯后修飾同樣被質譜和串級質譜中的分子量之改變所證實。而賴氨酸的4-羥基壬醛化修飾(4-HNEylation)也被證明以多種不同結構(圖5K/L)存在,且與一些重要代謝疾病相關[27]。
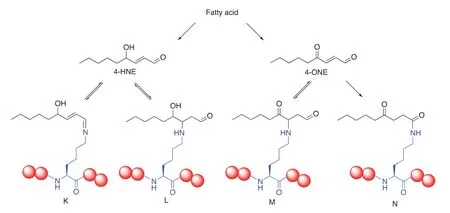
圖5 可能的賴氨酸4-ONEylation與4-HNEylation修飾結構
4 討論
對于翻譯后修飾,其生物化學性質與生物學功能是最為重要的。各類翻譯后修飾對于調控底物蛋白質結構功能至關重要,進而可以影響細胞的整體結構、代謝、功能與活動[28]。而質譜技術對新型翻譯后修飾研究的貢獻還遠不止發現。例如,將新型翻譯后修飾在全蛋白質組進行定位與定量研究、系統地預測可以對蛋白功能產生干擾的修飾位點[29]等。
4.1 教學素材選取
本文著重質譜技術對于輔助新型蛋白質翻譯后修飾的發現過程的討論,并未涉及質譜技術對其進一步的定性定量研究的相關內容,難免有失偏頗。但這部分從教學的趣味性上看是難得的素材。在前沿科學研究中融入了基本的有機化學與生物化學知識,極為生動地給學生們展示了基礎教學內容可以被實實在在用于科研發現中去。
同時,對應的案例教學可以融入五種經典科學研究中可以遵循的研究邏輯:“執果索因”即先有結構后尋覓;“上下求索”即發現導致唯一下游結果;“左右逢源”即發現導致不唯一結果,需要利用窮舉法進行排除試錯;“前呼后應”即與之前的結果相關,但需要借助其他各個學科知識進行分析;“為果設因”即為了探尋假說而認為創造可能情況。
4.2 化學生物學應用
串級質譜對于蛋白質翻譯后修飾的研究的應用與貢獻還遠不止于此。一方面,近年來發現的新型翻譯后修飾遠不止于此。單純以賴氨酸為例,在酶促或非酶促條件下可能的修飾有幾十種,例如通過蛋白質組分析發現,糖酵解中間體1,3-雙磷酸甘油酸酯與蛋白質中的特定賴氨酸殘基的反應不需要酶催化即可形成3-磷酸甘油基賴氨酸(3-phosphoglycerylation)的過程[30]。這里只是與質譜相關的少數典例。
另一方面,由于在研究特定蛋白質翻譯后修飾蛋白質時,我們需要首先獲取足夠量的目標蛋白。而生物學家卻難以直接使用生物工程手段進行表達[31]。故而對于化學生物學家,制備含有特定修飾的蛋白質是一項挑戰[32]。目前已經有非天然氨基酸引入法[33]、蛋白質全合成與半合成法[34]、生物正交反應法[35]等一系列合成手段。在合成后,仍然需要用串級質譜進行分析與驗證。
5 結語
隨著蛋白質翻譯后修飾的逐步發現和深入研究,質譜技術也顯示出其在生命科學領域中廣泛存在的應用價值。尤其是伴隨著一系列串級質譜技術的發展,質譜能提供一系列蛋白質等生物大分子系列、結構和修飾等信息。其中極高的分子量精度更是極大促進了新型翻譯后修飾的發現。
本文首先對質譜特別是串級質譜進行了概述。其次,對質譜技術在發現新型翻譯后修飾方面發揮的作用,包括分子量的確認、結構確定及最終的驗證等方面進行了論述。隨后,我們以五個典型案例為例,包括賴氨酸三種二酰化、賴氨酸苯甲酰化、賴氨酸羥基異丁酰化、賴氨酸β-羥基丁酰化和賴氨酸4-氧代-2-壬酰化修飾,展示了不同邏輯指導下質譜技術如何在新型蛋白質翻譯后修飾發現過程中發揮作用。通過上述對于質譜技術應用案例的研究,筆者為學生生動展示了基礎教學內容與科學研究之間的聯系。在培養學生學習基礎化學和生命科學興趣[36]的同時,為教學研究中解析研究邏輯方面的內容提供了良好的范例,并應用于蛋白質翻譯后修飾的化學生物學研究中去[37]。這對于培養新型創新性交叉學科人才極為重要[38]。
致謝:感謝Texas A&M University博士生Erol Can Vatansever參與討論和提出的建議。

