酸堿滴定中強堿滴定弱酸滴定初始曲線的數(shù)學(xué)解釋
——以NaOH滴定HAc為例
孫樹喆,張澤浩,張斌
1山東大學(xué)化學(xué)與化工學(xué)院,濟南 250100
2山東大學(xué)泰山學(xué)堂,濟南 250100
3山東大學(xué)生命科學(xué)學(xué)院,山東 青島 266237
酸堿中和滴定是無機及分析化學(xué)實驗中常見的基礎(chǔ)實驗操作,在測定復(fù)雜酸(堿)性物質(zhì)含量方面具有廣泛應(yīng)用。在酸堿中和滴定實驗過程中,滴定曲線由于生動形象地反映了整個滴定過程中的關(guān)鍵節(jié)點,對廣大學(xué)生理解和掌握酸堿中和滴定具有不可替代的重要作用。在化學(xué)專業(yè)基礎(chǔ)課分析化學(xué)酸堿滴定法一章的學(xué)習(xí)過程中,通過比較強堿滴定強酸(以氫氧化鈉滴定同濃度鹽酸為例)的滴定曲線與強堿滴定弱酸的滴定曲線(以氫氧化鈉滴定同濃度醋酸為例),可以發(fā)現(xiàn)二者的滴定曲線走勢在滴定初始階段存在差異,《分析化學(xué)》(武漢大學(xué)主編,第6版,上冊,以下簡稱教科書)中僅給出定性分析和解釋[1]。國內(nèi)外分析化學(xué)教學(xué)中使用影響力較高的教科書對此也都給出類似的定性敘述[2–4]。借鑒當前通過數(shù)學(xué)解析和曲線繪制建立滴定分析模型的經(jīng)驗[5],本文嘗試利用酸堿滴定過程中的平衡關(guān)系式,建立數(shù)學(xué)模型模擬氫氧化鈉滴定醋酸的反應(yīng)過程。結(jié)合計算機繪圖工具在精確繪制酸堿滴定曲線中的應(yīng)用[6],本文將通過函數(shù)圖像的直觀走勢針對教科書中相關(guān)定性解釋給出定量驗證。
1 氫氧化鈉(NaOH)滴定醋酸(HAc)滴定曲線的數(shù)學(xué)推導(dǎo)
1.1 基本公式的回顧
在滴定過程中,反應(yīng)體系中存在以下幾個平衡關(guān)系式。對于HAc的解離過程HAc ?H++ Ac?,其平衡常數(shù)表達式為:

忽略該酸堿滴定時的放熱情況,室溫25 °C時存在:

由電荷守恒可知:

由物料平衡可知:

由pH的定義可知pH = ?lg[H+]。
1.2 必要假設(shè)的引入
為方便推導(dǎo),在不影響滴定曲線總體形狀的基礎(chǔ)上引入以下假設(shè):作為滴定標準液的NaOH溶液濃度較大,以至于其加入HAc溶液后不對體系體積產(chǎn)生影響。由此推出上述平衡式(4)中c即為HAc的初始濃度,參照教科書[1]上數(shù)值,設(shè)c為0.1000 mol·L?1,(4)式即可化為:

由于假設(shè)滴定過程中體積不變,所以[Na+]與加入NaOH的物質(zhì)的量成正比,即可以用[Na+]來表示加入NaOH的物質(zhì)的量。
1.3 相關(guān)方程的推導(dǎo)
在以上基本公式、假設(shè)和推論的基礎(chǔ)上,進行如下合理推導(dǎo)。
設(shè)滴定過程中,

由平衡式(2)可知:
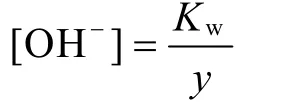

由推論(5)可知

將式(6)、(7)、(8)代入平衡式(1),得:
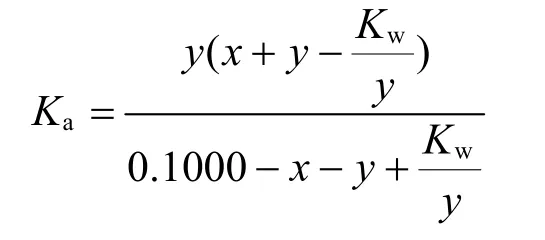
整理可得,

注意到Kw/y<< 0.1000Ka/(y+Ka)-y,合理忽略最后一項,可得:

由pH = ?lg[H+]及式(6)可得:

將式(1)、(6)、(10)代入式(9)得:
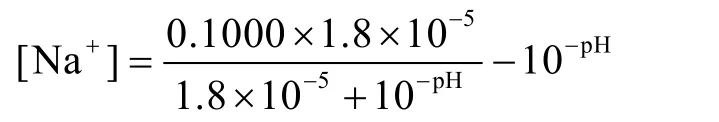
1.4 函數(shù)圖像的驗證
以pH為自變量、[Na+]為因變量作函數(shù)圖像,即圖1所示。
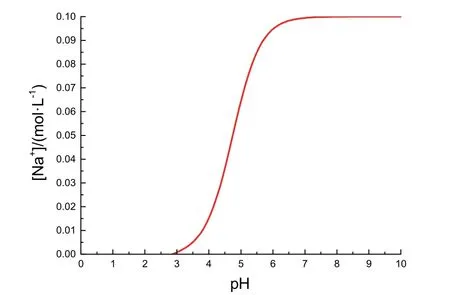
圖1 [Na+]關(guān)于pH變化的函數(shù)圖像
以[Na+]為自變量、pH為因變量作函數(shù)圖像,由函數(shù)對稱性可知,該函數(shù)與圖1中函數(shù)互稱反函數(shù),兩者圖像關(guān)于y=x對稱,即圖2所示。
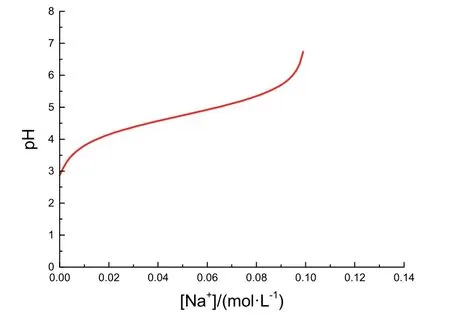
圖2 pH關(guān)于[Na+]變化的函數(shù)圖像
1.5 圖像差異的解釋
圖2中大致反映了滴定過程中pH變化與[Na+],即加入NaOH物質(zhì)的量的關(guān)系。觀察圖2,可以看出滴定開始前體系pH約為3,經(jīng)過一個坡度傾斜程度先大后小的pH變化過程,在接近滴定終點時產(chǎn)生一個突變,后愈發(fā)平緩增大。與教科書原圖比較,本圖存在如下兩點差異。
第一,本圖開始時圖像坡度更大,是因為忽略加入NaOH后的體積變化,[OH?]迅速增大,pH升高速度較快。第二,終點過后的pH并非原圖中隨NaOH過量加入而趨近13,是因為我們假設(shè)忽略了加入NaOH溶液后的體積改變。
由于初始階段(2.9 ≤ pH ≤ 6.0)的研究更為重要,因此在圖像形狀基本相符的情況下,此兩點差異不影響我們對其圖像成因的描述。
2 圖像理論解釋的數(shù)學(xué)驗證
2.1 理論解釋
我們注意到,在教科書中對于曲線初始部分的坡度變化進行了如下解釋:“滴定開始之后,曲線的坡度比滴定HCl更傾斜,這是因為HAc的解離度很小,一旦滴入NaOH后,部分的HAc被中和而生成NaAc,由于Ac?的同離子效應(yīng),使HAc的解離度變得更小,因而H+濃度迅速降低,pH較快增大。”
2.2 數(shù)學(xué)驗證
針對教科書中所給理論的定性解釋,結(jié)合以上對滴定曲線的數(shù)學(xué)推導(dǎo)過程,我們也采用數(shù)學(xué)方法進行合理性驗證。
2.2.1 解離度與氫離子濃度的關(guān)系推導(dǎo)
定義α為HAc在整個滴定過程的解離度,依然采用上述對c的賦值,即c= 0.1000 mol·L?1。滴定過程存在以下兩個反應(yīng):

假設(shè)(11)迅速完全反應(yīng),可得:

將式(1)、(2)、(6)、(7)、(9)、(10)代入得:
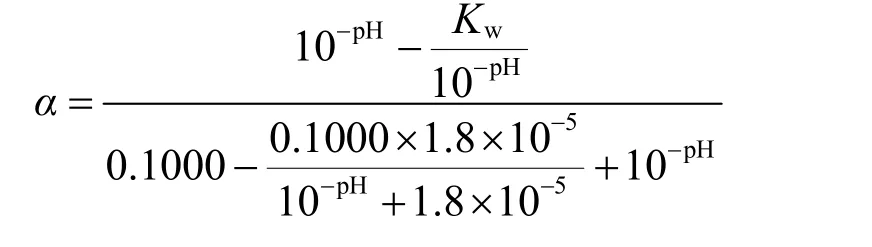
2.2.2 解離度與氫離子濃度關(guān)系的圖像驗證
以pH為自變量、α為因變量作圖,即圖3所示。
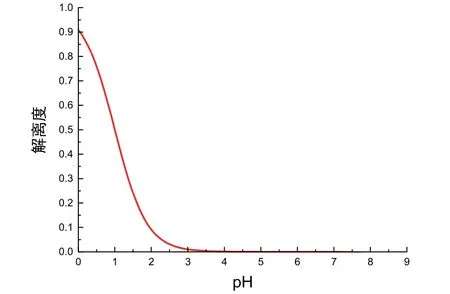
圖3 解離度關(guān)于pH變化的圖像(c= 0.1000 mol·L?1)
由于僅在α和pH大于0時圖像具有化學(xué)意義,故我們僅需要觀察第一象限中曲線的變化規(guī)律。觀察圖3容易看到,隨著滴定進行,[H+]逐漸降低,pH逐漸升高,α數(shù)值先迅速降低后趨于平緩。即HAc解離度隨pH的升高先迅速減小后趨于0,這與教科書書中對初始階段滴定曲線坡度變化的定性解釋相符。
2.2.3 實驗條件與圖像的優(yōu)化
事實上,當我們令c=1.000 mol·L?1時,此時NaOH濃度更大,上述1.2節(jié)中體積不變的假設(shè)更加合理,因此其圖像變化趨勢更符合上述解釋。以pH為自變量、α為因變量作圖,如圖4所示。觀察發(fā)現(xiàn)其走勢更為明顯,同時證明該數(shù)學(xué)模型對初始階段曲線斜率變化解釋的合理性。
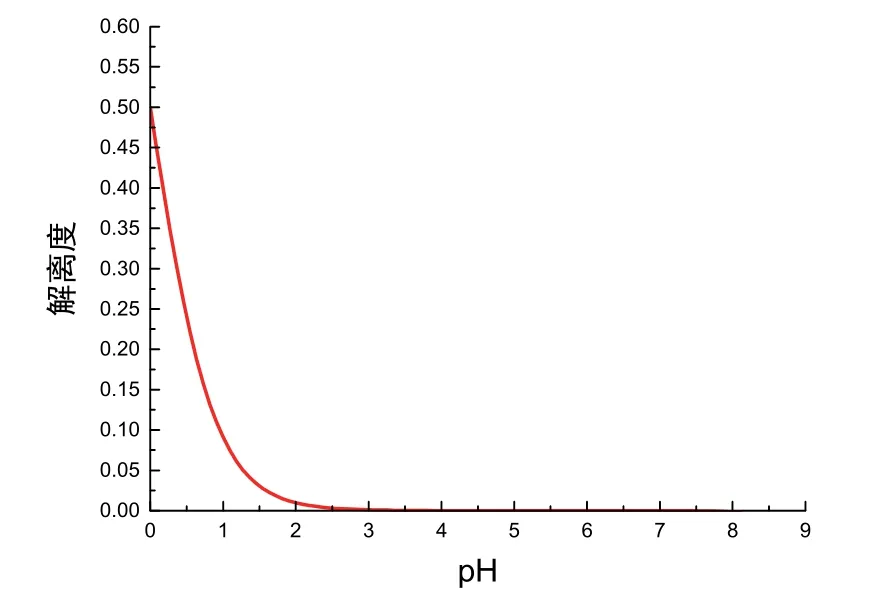
圖4 滴定初解離度關(guān)于pH變化的圖像(c= 1.000 mol·L?1)
2.2.4 pKa對滴定初始解離度影響的初步模擬
對于不同強度的弱酸而言,其滴定曲線在初始階段的變化情況不盡相同。為說明弱酸強度對于初始階段解離度的影響,我們研究了不同強度的弱酸的解離度隨著pH變化的變化趨勢。分別以pH為自變量,以α為因變量,利用2.2.1節(jié)中推得表達式作圖,如圖5所示。觀察圖5,推測不同強度弱酸的解離度在滴定初始階段隨pKa的增大而下降,其對應(yīng)滴定曲線坡度越大。
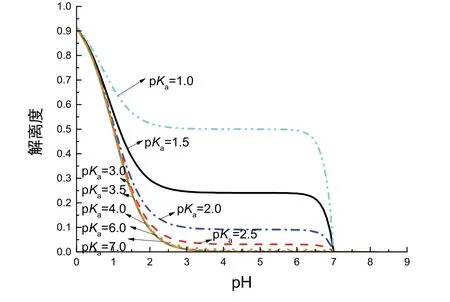
圖5 滴定初始階段不同弱酸解離度關(guān)于pH變化的圖像(c= 0.1000 mol·L?1)
3 結(jié)語
本文用數(shù)學(xué)方法從pH變化定量解釋了其圖像前半部分與強酸強堿滴定曲線不同的原因。NaOH滴定HAc曲線初始階段特殊的原因是忽略加入NaOH后的體積變化,[OH?]迅速增大,pH升高速度較快。與此同時,從解離度變化角度驗證了教科書中定性解釋的合理性。隨著滴定進行,[H+]逐漸降低,HAc解離度隨pH的升高先迅速減小后趨于0,體系pH先迅速變化后趨于平緩。與此同時,通過數(shù)學(xué)曲線模擬pKa和濃度不同時滴定初解離度的變化,我們發(fā)現(xiàn)當弱酸初始濃度較大、pKa較大(pKa≥ 3.0)時,初始階段解離度驟降程度越大、滴定曲線pH變化越明顯,這是下一步虛擬實驗建立的理論基礎(chǔ)。
當前以學(xué)科交叉為核心的虛擬大學(xué)化學(xué)實驗教學(xué)探索不斷推進,在節(jié)省實驗時間、提高學(xué)生興趣、鞏固理論基礎(chǔ)等方面成效顯著[7],我們也會借助于此進行其他滴定曲線差異性的相關(guān)研究。這為本科生和分析化學(xué)愛好者深入理解該酸堿滴定過程提供了一種新的思路和方法,并可以調(diào)整條件擴展到絡(luò)合滴定、沉淀滴定等多種滴定操作中,有助于教師在教學(xué)中采用定量的方法對學(xué)生在酸堿滴定中的疑問進行解釋,并有利于提高學(xué)生利用基本數(shù)學(xué)知識和工具處理化學(xué)問題的思考能力。

