最大泡壓法測定溶液表面張力實驗條件的優化
董金龍,劉雪娟,趙婷婷,文斌,韓紅斐
太原師范學院化學系,山西 晉中 030619
最大氣泡壓力法是大學物理化學實驗中測定溶液表面張力的一個經典方法[1–3]。由于最大泡壓法測定溶液表面張力實驗裝置較為簡單,學生也易于理解其原理,且不用測定液體密度ρ和接觸角θ,因而成為測定溶液表面張力的一個基本物理化學實驗[4]。通過實驗可以鞏固及加深理解有關溶液表面吸附的理論知識,通過數據處理可以熟練掌握其有關方程式。但由于各方面條件的局限,學生所測試的實驗數據與文獻值不能較好吻合。鑒于此,在已有的實驗裝置下,對實驗進行了細致的條件探索,如:更換測試物,變換溫度和細化溶液的濃度等,以期得到與文獻較吻合的實驗數據,從而為教師及本科生等相關實驗人員提供一定的理論指導。
1 實驗部分
1.1 主要儀器與試劑
主要儀器:DP-AW-I型表面張力實驗裝置,南京桑力電子設備廠;CH1006型超級恒溫槽,上海恒平科技儀器有限公司。
主要試劑:正丁醇,無水乙醇,均為分析純,天津光復試劑有限公司。
1.2 存在問題
實驗改進主要以濃度、溫度、物質等分別作為變量,進行正交實驗,從而得到較為符合常理的實驗結果。導致實驗存在較大偏差的原因可能如下:
(1) 在低濃度下,偏差可能來自于體積小時的量取誤差;在高濃度時,誤差則可能是來源于實驗是以易揮發的乙醇及正丁醇為研究對象[5],濃度增大,溶液的揮發性增大;最后,在配制溶液時,溫度不可能完全一樣,導致試劑密度變化,因而帶來誤差。
(2) 實驗所用的樣品管為套管試管,內管放置待測液,外管則是由橡膠管而來的恒溫水,用于營造恒溫環境。一般情況下為保證實驗儀器的穩定及整潔,恒溫水槽及樣品管距離較遠,橡膠管較長,恒溫水到外管時水溫有微小變化,從而造成實驗誤差。
1.3 改進
(1) 濃度:為保證濃度的準確,文獻報道[6]:① 由于待測溶液濃度極稀,可采用等體積滴定方法[5];② 每測完一組都洗凈毛細管,再用待測液潤洗吹干后進行測定;③ 先配制一系列標準溶液,精準測定其折光率后得出工作曲線,再由此確定實驗溶液濃度。本實驗選擇配制一系列濃度溶液,在每次實驗時,都進行潤洗操作,減小由于濃度的不準確而帶來的誤差。
(2) 溫度:溫度是實驗結果是否準確的關鍵影響因素。改進溫度的方法有:① 將待測液置于支管燒瓶內,再將支管燒瓶直接置于恒溫水浴槽內;② 盡量縮短橡膠管長度或選擇保溫性較好的橡膠管。本實驗采取了保溫性較好的橡膠管,并設置了25 °C和30 °C兩個溫度,有效降低了結果的偶然性。裝置如圖1所示。

圖1 表面張力實驗裝置圖
(3) 物質:本實驗采用了正丁醇和乙醇為實驗對象,進行多次實驗,降低了實驗結果的偶然性。正丁醇和乙醇屬于短鏈烷基醇類(碳鏈長度小于8),隨著濃度的增加,表面張力下降,但不呈完美的線性關系。且在接近溶解度時,由于其密度小于水,達不到完全溶解,造成測量失準,因此對高濃度的溶液存在測量偏差。
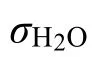
(5) 其他:① 將表面張力儀樣品管所連接的毛細管外部加設一個可旋動的活塞,可以通過旋轉毛細管外部的旋鈕來調節毛細管高度,進而靈活方便地調節毛細管與液面的相切;② 將橡膠塞改為磨口玻璃塞,保證密封性,且可以使毛細管與液面保持垂直,從而減少用橡膠塞固定毛細管所引起的誤差。
2 數據分析與討論
水在不同溫度下的表面張力:Harkins經驗公式(在10–60 °C適用):
σH2O= 75.796 ? 0.145T? 0.00024T2
其中T為攝氏溫度;表面張力σ:mN·m?1。
298 K (25 °C)時,σH2O= 0.0720 N·m?1
303 K (30 °C)時,σH2O= 0.0712 N·m?1
通過實驗條件改進后,得出以下數據,介紹如下。
2.1 25 °C時乙醇表面張力
實驗數據及處理,如表1所示。
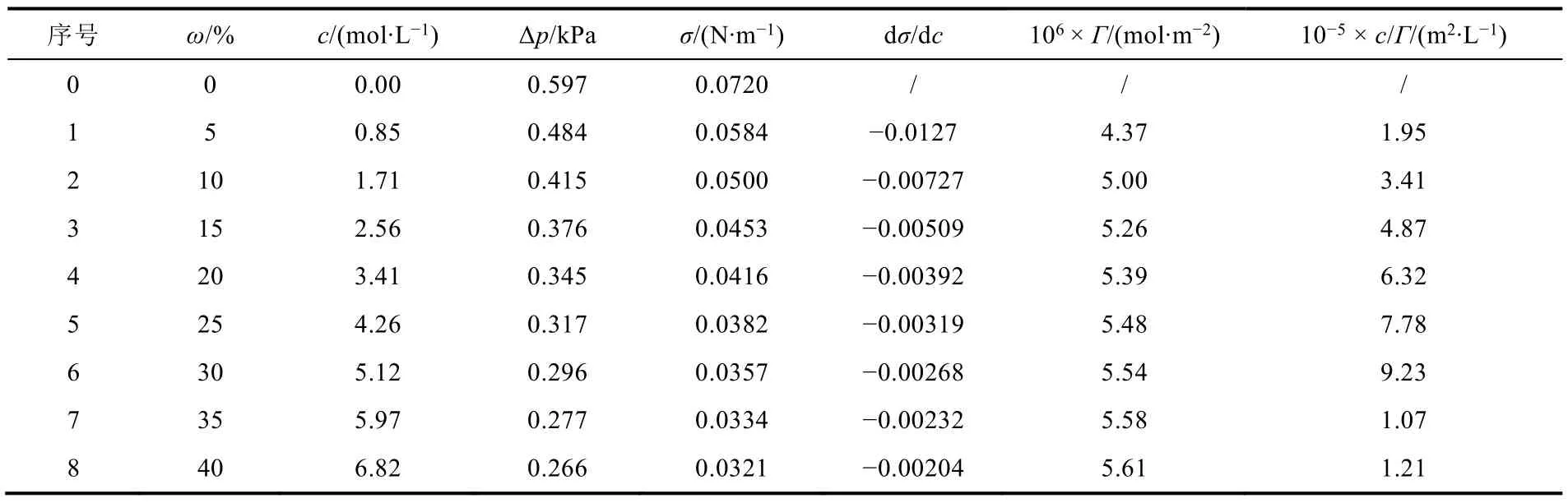
表1 25 °C時最大泡壓法測定乙醇溶液表面張力的數據
由表1中數據作σ–c圖,如圖2(a)所示。
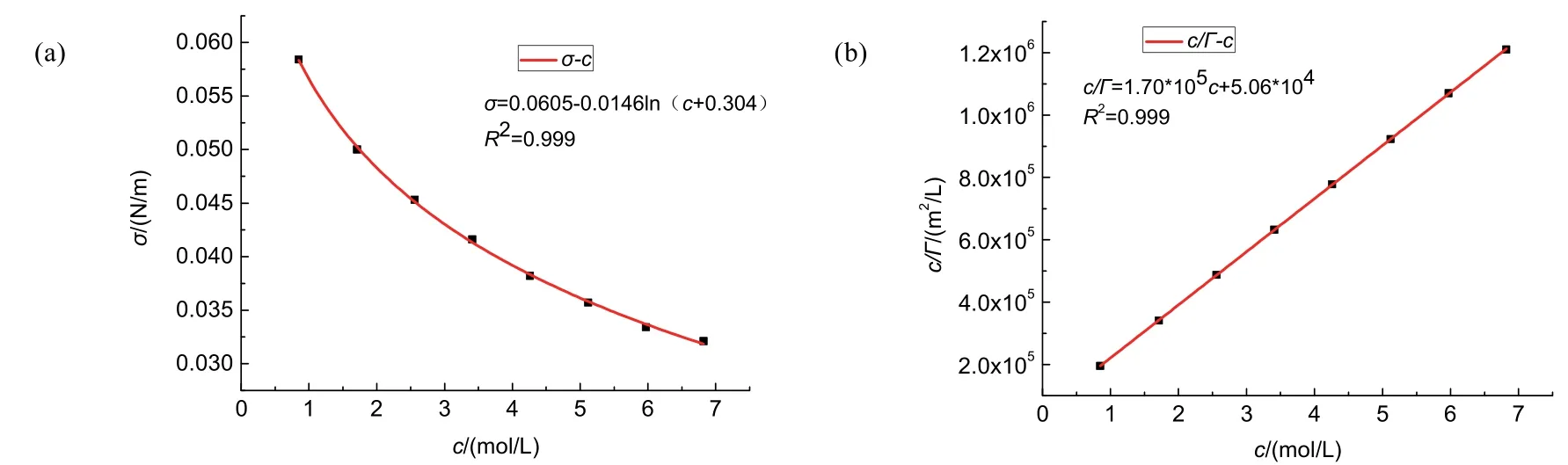
圖2 (a) 25 °C時乙醇溶液表面張力隨濃度的變化曲線;(b) 25 °C時乙醇溶液c/Γ與濃度的關系曲線
經擬合曲線可得:c/Γ= 1.70 × 105c+ 5.06 × 104,回歸直線的倒數即可得:Γ∞= 5.85 × 10?6。
2.2 30 °C時乙醇表面張力
實驗數據及處理,如表2所示。
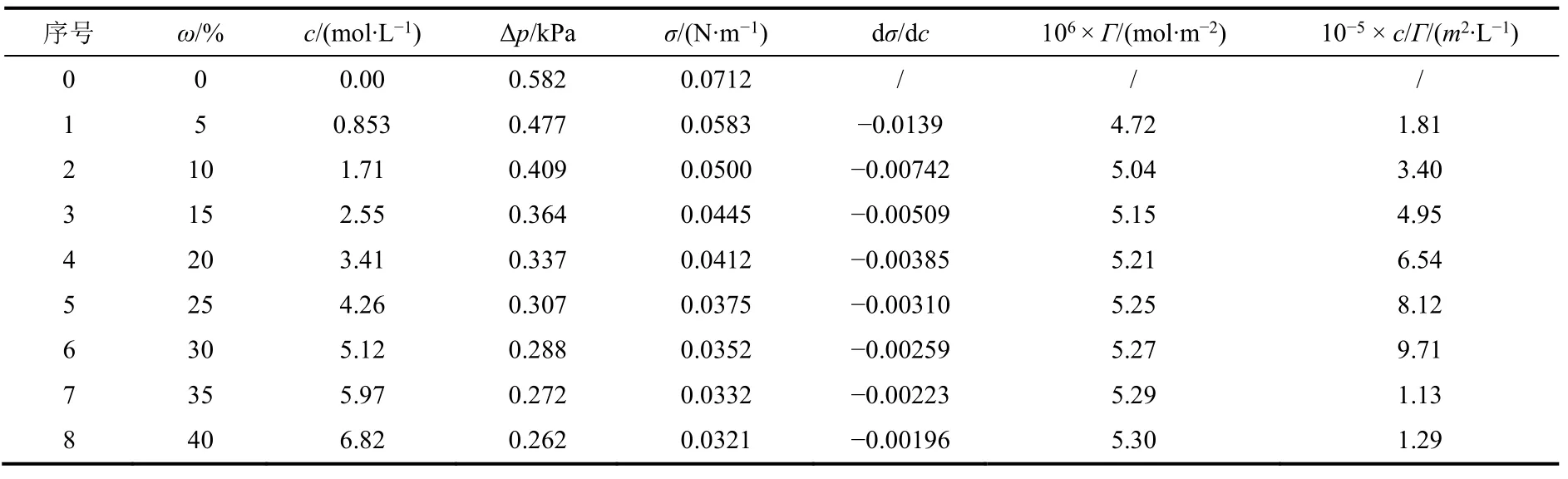
表2 30 °C時最大泡壓法測定乙醇溶液表面張力數據
根據表2中數據作σ–c和c/Γ–c圖,如圖3所示。
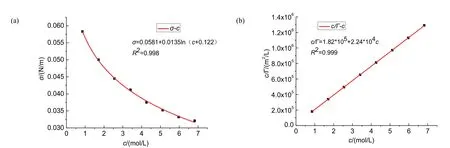
圖3 (a) 30 °C時乙醇溶液σ–c圖;(b) 30 °C時乙醇溶液c/Γ–c圖
由擬合曲線可得:c/Γ= 1.82 × 105c+ 2.44 × 104
回歸直線的倒數即可得:Γ∞= 5.49 × 10?6,可得被測物橫截面積:S0= 3.03 × 10?19m2,與文獻值2.03 × 10?19m2較為吻合[5]。
2.3 25 °C時正丁醇表面張力
實驗數據及處理,如表3所示。
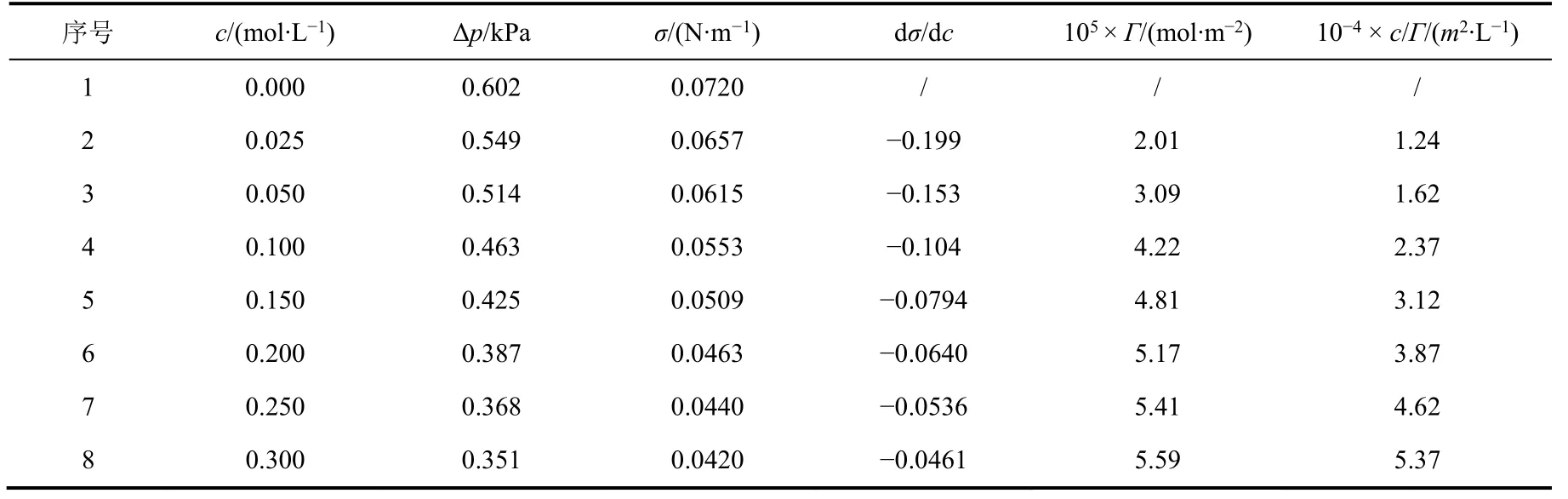
表3 25 °C時最大泡壓法測定正丁醇溶液表面張力數據
根據表3中數據作σ–c和c/Γ–c圖,如圖4所示。
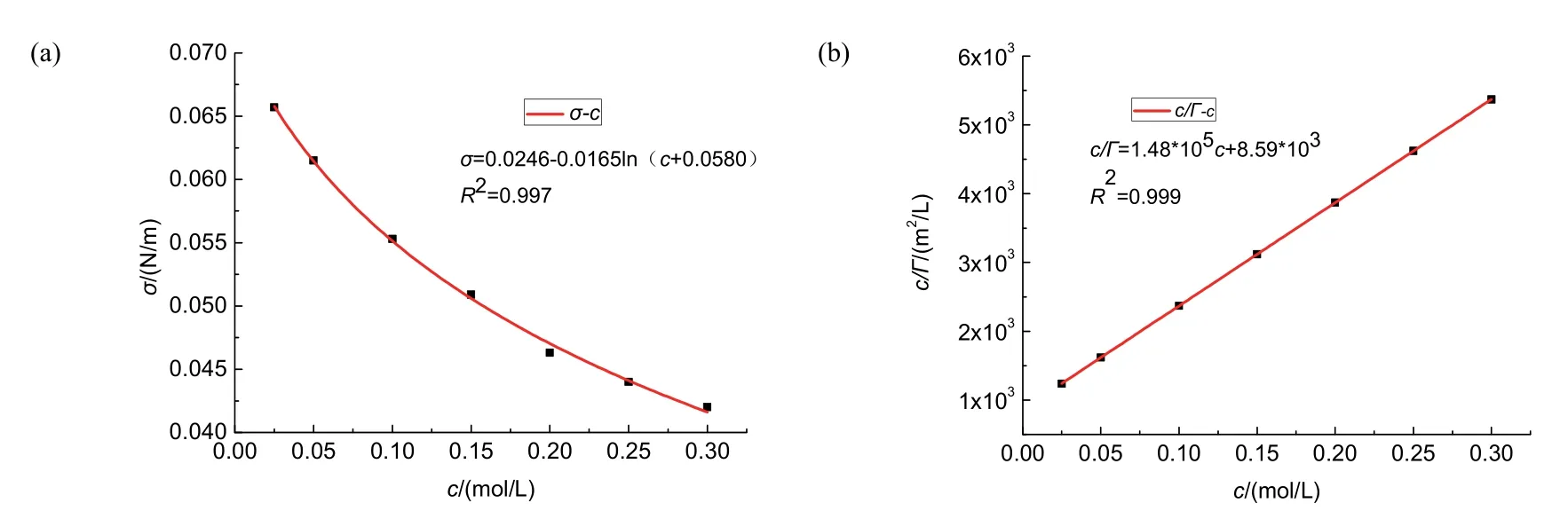
圖4 (a) 25 °C時正丁醇溶液σ–c圖;(b) 25 °C時正丁醇溶液c/Γ–c圖
由擬合曲線可得:c/Γ= 1.48 × 105c+ 8.59 × 103。
由圖可得回歸直線的倒數即:Γ∞= 6.74 × 10?6。
2.4 30 °C時正丁醇表面張力
實驗數據及處理,如表4所示。
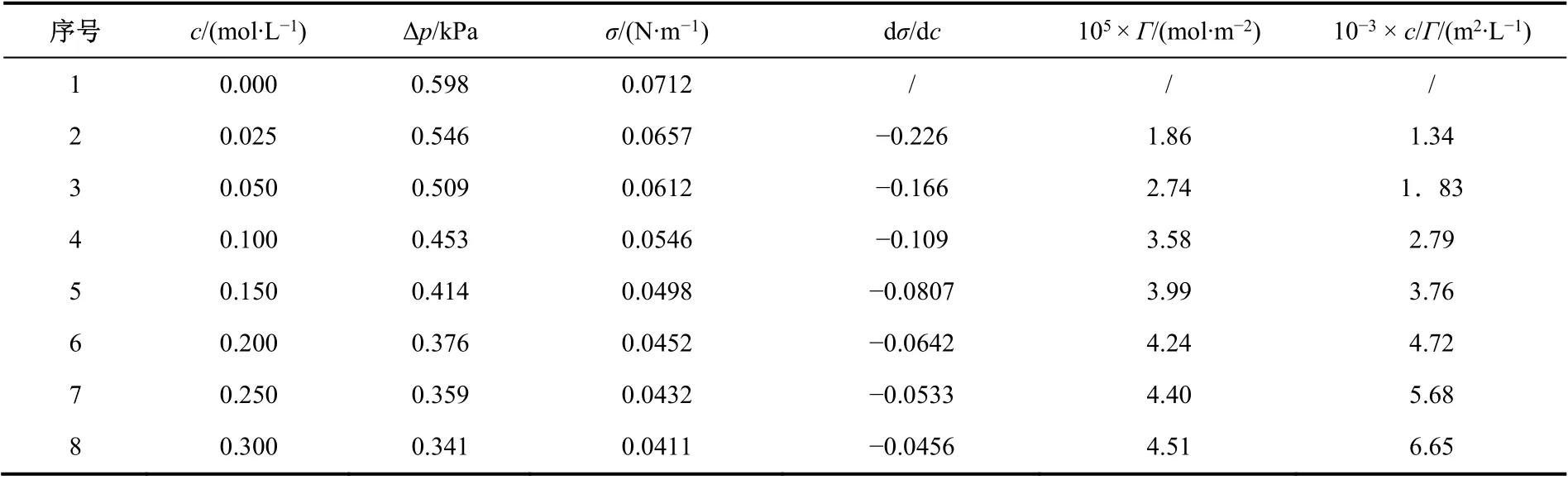
表4 30 °C時最大泡壓法測定正丁醇溶液表面張力數據
根據表4中數據作σ–c和c/Γ–c圖,如圖5所示。
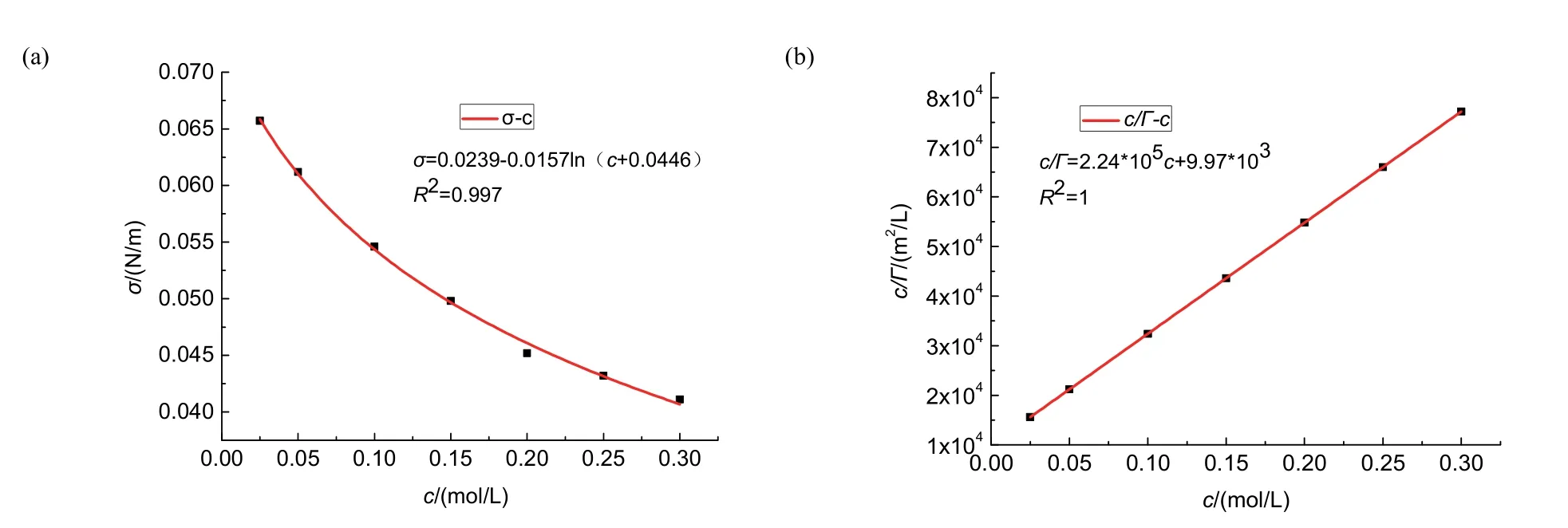
圖5 (a) 30 °C時正丁醇溶液σ–c圖;(b) 30 °C時正丁醇溶液c/Γ–c圖
回歸直線的倒數可得:Γ∞= 4. 46 × 10?6。
2.5 誤差分析[8]
實驗時,手動調節旋塞可能導致毛細管與液面為非絕對垂直狀態,會帶來微小的誤差;公式中的Δp為大氣壓力與系統壓力的差值,因此,室內氣溫、氣流的變化會造成大氣壓力的變化,故而使實驗測得的數據產生偏差,但在實際測量過程中,該偏差往往較小(±0.1 kPa),所以一般可忽略;還應特別注意在較高濃度時溶液易揮發,而造成實驗結果的不準確,因此可適當舍棄不準數據;另有溶液粘度對表面張力的測定有影響。
在實驗條件下,毛細管末端形成的并非絕對完美氣泡;此外,還有其他一些實驗事實與理論情況相背離,如重力的影響、氣泡與毛細管的粘附、空氣攜帶的水分顆粒以及氣泡自身生長所產生的湍流等。因此若需更加準確的計算,還要引入修正因子,并且在操作中使氣泡產生的速度均勻,大小一致是實驗準確的關鍵。
3 結語
理論上,在達到飽和吸附時,溶液表面上的溶質分子是定向排列的。但事實上,由于醇類分子的―OH具有較強的極性,表面層的溶質分子周圍必然會吸附同樣極性較大的水分子。因此,即使是吸附達到飽和,實驗所得分子橫截面積也將會始終大于實際橫截面積,實驗結果的數據證實確實如此。經過此次實驗條件的改進,準確測得正丁醇與乙醇直鏈醇類的橫截面積,并且結果與文獻值較為符合。由實驗可得,在測試乙醇時,選擇25 °C,濃度在7.00 mol·L?1以下時可得到更為準確的結果;而在測試正丁醇時,選擇25 °C,0.300 mol·L?1以下更為準確。結果顯示,正丁醇所得數據吻合度優于乙醇數據,且正丁醇溶液濃度低,所需母液少,所以推薦使用正丁醇為實驗對象,且在實驗過程中應控制加壓的速度,過快會導致壓強變化迅速,數據誤差大;太慢會延長實驗時間,拖延實驗進度。

