藍藻FBP/SBPase的制備及其與配體相互作用的分析
——科研轉化的化學生物學綜合實驗設計
馮玲玲,陳瓊,李玉夢,梁景晗,王舟
華中師范大學化學學院,農藥與化學生物學教育部重點實驗室,武漢 430079
人類活動的加劇和全球氣候的變暖使得世界各地湖泊富營養化程度日益嚴重,藍藻水華事件頻繁爆發。藍藻水華產生的高密度藻類危害水域中其他生物的生存與發展、破壞水域生態景觀,給漁業、旅游業、人類生活等帶來嚴重的危害[1,2]。使用化學殺藻劑抑制藍藻生長或殺滅藍藻是快速有效解決藍藻水華問題的重要防治手段。現有的化學殺藻劑,如硫酸銅、高錳酸鉀及過氧化物等不是針對藻類特異設計的,存在選擇性差、對其他生物毒性大等缺點,極大地限制了化學殺藻劑防治藻害效能的充分發揮[3],因此,獲得選擇性高、毒性小的殺藻劑是現代殺藻劑創制研究的一個發展趨勢,研發新型的殺藻劑具有重要意義。
化學生物學的一個重要研究內容是以生物體中重要調控酶為靶酶,通過研究靶酶與配體之間的相互作用機理,進而建立基于靶酶的農藥或醫藥篩選模型,獲得作用于新靶點的具有自主知識產權的醫藥及農藥制劑[4–9]。運用化學生物學研究策略和技術,以藻類光合作用系統中重要調控酶為靶標進行抑制劑的設計與篩選是獲得新型殺藻劑的有效途徑之一。果糖-1,6-/景天庚酮糖-1,7-二磷酸酶(Fructose-1,6-/sedoheptulose-1,7-bisphosphatase,Cy-FBP/SBPase)是藍藻光合作用中重要的調控酶,是尋找殺藻劑治理藍藻水華污染問題的一個潛在靶標。研究Cy-FBP/SBPase的酶學性質、酶與配體的相互作用,是建立基于靶酶的殺藻劑篩選模型的關鍵。
化學與生物學、醫學等學科的交叉融合大大促進了化學生物學學科的建立與發展。明顯的標志是國際上著名大學如哈佛大學、耶魯大學、康奈爾大學等紛紛將化學系改名為化學與化學生物學系[10]。我國自2000年由國家自然科學基金委化學部主持召開“化學生物學”研討會以來,化學生物學科學研究得到了飛速發展,化學生物學專業人才的需求也急劇增加,因此國內多所高校相繼設立了化學生物學本科專業或化學生物學特色人才培養基地[11–13]。化學生物學本科教學的理論課程體系得到了迅速發展和逐步完善,但化學生物學實驗課程建設和發展相對滯后[14–17]。因此開發適合本科生高階發展所需要的化學生物學創新實驗項目,是建設及完善高等院校化學生物學本科實驗教學課程體系亟需解決的問題。
前期我們報道了Cy-FBP/SBPase的晶體結構、酶學性質、酶與配體的相互作用、抑制篩選等研究成果[18–20]。基于此,本文結合化學專業高年級本科生的知識背景、發展需求,將我們在科研領域中取得的系列研究成果設計轉化為一個化學生物學綜合實驗。實驗內容包括通過異源蛋白的表達、純化獲得靶酶Cy-FBP/SBPase,然后測定靶酶的純度及含量,測定底物、金屬離子及抑制劑等配體對靶酶活性的影響,探討靶酶的酶學性質、酶與配體之間的相互作用。通過本實驗項目的訓練,學生可以掌握以生物體重要調控酶為靶標建立抑制劑篩選模型的研究思路、研究方法及重要實驗技術,拓展思維視野,提高分析問題及解決問題的能力,提升綜合運用化學生物學知識的能力,為今后從事化學生物學科學研究活動及其他相關領域的研究工作奠定基礎,同時有助于增強科研服務社會的意識及社會責任感。
1 實驗目的
(1) 學習并掌握通過異源蛋白的表達、純化獲得靶酶的原理及方法,掌握運用十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳技術(SDS-PAGE)分析蛋白純度及大小的方法以及Bradford法測定蛋白質含量的方法。
(2) 學習無機磷法測定Cy-FBP/SBPase活性的方法,掌握酶學性質、酶與配體相互作用的實驗分析方法。
(3) 掌握紫外-可見分光光度計、酶標儀、冷凍離心機及蛋白質電泳儀等儀器設備的基本原理及使用方法。
(4) 學習基于靶酶建立抑制劑篩選模型研究中相關實驗的設計,提升分析及解決問題的能力,增強對化學生物學實驗技術的綜合應用能力,增強科研服務社會的意識及社會責任感。
2 實驗原理
2.1 Cy-FBP/SBPase的制備
以大腸桿菌為代表的原核表達系統具有操作方便、需時短、表達量大等優點,成為生物合成外源蛋白的首選。通過基因重組技術,將Cy-FBP/SBPase基因fbp克隆到帶有組氨酸標簽(His-tag)的pET-28a(+)載體上獲得重組載體pET-fbp,然后轉入大腸桿菌中,在異丙基-β-d-硫代半乳糖苷(isopropyl-β-d-thiogalactoside,IPTG)的誘導下生物合成目標蛋白。
Ni-NTA瓊脂糖樹脂是一種通過親和層析法分離純化帶有His-tag重組蛋白的介質,His-tag中組氨酸殘基與鎳離子結合具有較高的特異性和親和性。親和純化時含有His-tag的蛋白與Ni-NTA結合,而不帶His-tag標簽的蛋白則被洗滌下去。結合在介質中的目標蛋白再用高濃度的咪唑洗脫,從而得到高純度的目的蛋白。
2.2 Cy-FBP/SBPase的純度、大小及含量分析
SDS-PAGE法不受蛋白質本身所帶電荷、形狀的影響,電泳結果只與蛋白質的相對分子質量有關,可以根據蛋白的分子量不同將蛋白質各組分分開,從而定性及半定量地分析Cy-FBP/SBPase蛋白的純度及大小。
Bradford法測定蛋白質含量的原理是蛋白質與染料考馬斯亮蘭G-250結合后,染料顏色由棕黑色變為藍色,染料的最大吸收峰從465 nm變為595 nm。基于595 nm下測定的吸光度值與蛋白質濃度成正比,從而計算得出樣品中蛋白質的含量。這一方法操作簡單,靈敏度高。
2.3 Cy-FBP/SBPase的酶活性測定、酶學性質、配體與酶相互作用
采用磷試劑顯色法直接測定Cy-FBP/SBPase催化底物果糖-1,6-二磷酸(Fructose-1,6-biphosphate,FBP)產生的無機磷,方法簡單、高效快捷,適合用于Cy-FBP/SBPase抑制劑的高通量篩選。通過測定底物、金屬離子濃度(鎂離子和錳離子)、抑制劑對Cy-FBP/SBPase活性的影響,探討Cy-FBP/SBPase酶學性質、酶與配體的相互作用[18–20]。
3 實驗試劑和儀器
3.1 實驗試劑
抑制劑D7為本實驗室篩選獲得的化合物小分子。Imidazloe、MgCl2·6H2O、MnCl2·4H2O、NaCl等為分析純,購自國藥化學試劑有限公司(中國)。酵母提取物、胰蛋白胨、瓊脂粉、Tris-Base、IPTG、氨芐青霉素、二硫蘇糖醇(DTT)、sodium lauryl sulfate (SDS)、過硫酸銨等為分析純,購自Biosharp。金屬離子溶液儲存濃度為10 mmol·L?1,使用時用去離子水稀釋至所需實驗濃度。底物FBP、親和樹脂Ni-NTA、SDS-PAGE蛋白分子質量Marker及其他試劑在保證實驗效果的前提下盡量購買國產可替代產品,比如廣州鼎國生物、合肥博美生物學科技、新海基因等國內廠家生產的相關試劑。實驗過程中使用水均為去離子水。
3.2 實驗儀器
冷凍高速離心機5810R (Eppendorf)、凝膠成像儀(BIO-RAD),酶標儀SpectraMax M5 (Molecular Device),紫外分光光度計Smart SpecTMPlus (BIO-RAD),DYY-8C型雙穩定時電泳儀電源(北京市六一儀器廠)。
4 實驗內容
4.1 重組酶Cy-FBP/SBPase的制備
首先挑取有重組表達質粒的單菌落,接種于50 mL LB液體培養基(含氨芐青霉素100 μg·mL?1),37 °C振蕩過夜,培養12–16 h。然后取過夜的培養液按1%比例接入新鮮LB培養基(含氨芐青霉素100 μg·mL?1)中,37 °C振蕩培養至OD600達到0.6–0.8。加入終濃度為0.3 mmol·L?1的IPTG,22 °C振蕩誘導培養8–10 h。然后,離心收集大腸桿菌細胞,加入裂解液(10 mmol·L?1Tris-HCl,pH 8.5,0.5 mol·L?1NaCl)將菌體重懸,超聲破碎細胞,釋放蛋白。離心制備用于親和層析純化所需要的上清粗酶提取液。
將制備好的上清粗酶提取液與Ni-NTA親和樹脂在冰浴條件下孵育2–3 h,然后依次分別在50 mmol·L?1、250 mmol·L?1咪唑溶液洗脫,再經過脫鹽處理得到目標蛋白,?20 °C存儲在50%甘油溶液中備用[18,19]。
4.2 蛋白質的純度、大小及含量分析
用SDS-聚丙烯酰胺電泳(SDS-PAGE)檢測Cy-FBP/SBPase的純度和大小[18,19]。實驗步驟大致為:(1) 制備15 mL 12%的分離膠(H2O 4.9 mL,30%丙烯酰胺6.0 mL,pH 8.8 Tris-HCl緩沖液3.8 mL,10% SDS 150 μL,10%過硫酸銨150 μL,6 μL TEMED);(2) 制備5%的積層膠:H2O 3.4 mL,30%丙烯酰胺0.84 mL,pH 6.8 Tris-HCl緩沖液0.63 mL,10% SDS 150 μL,10%過硫酸銨50 μL,TEMED 5 μL;(3) 蛋白及菌液樣品的制備。取蛋白質樣品8 μL,加入10 ×蛋白上樣緩沖液2 μL,混勻后95 °C溫育10 min變性。(4) 上樣,電泳,電壓100 V。(5) 染色及脫色:電泳結束后,取出蛋白膠,置于考馬斯亮藍染色液中染色20 min左右。然后將蛋白膠置于脫色劑中脫色結束(脫色時間根據脫色效果確定)。(6) 分析:凝膠成像儀分析SDS-PAGE結果。
蛋白含量用Bradford蛋白質定量試劑盒(Tiangen Biotech)提供的標準方法來測定。首先取1 mg·mL?1的牛血清蛋白(BSA) 0、1、2、3、4、5 μL BSA標準溶液,然后加入PBS補齊總體積為15 μL,混合均勻后加入考馬斯亮藍染色劑285 μL,反應10 min,以每孔100 μL加入到96孔板中,測定595 nm處的吸光度,制作蛋白標準曲線。然后取1 μL、3 μL待測目標蛋白溶液,用PBS補齊體積15 μL,按上述方法,測定595 nm處的吸光度,根據蛋白標準曲線擬合的方程計算目標蛋白含量。
4.3 Cy-FBP/SBPase酶活性的測定、酶學性質、酶與配體相互作用的分析
以100 μmol·L?1磷酸二氫鉀溶液作為標準溶液,測定單位時間內Cy-FBP/SBPase催化特定底物FBP釋放出無機磷量,計算酶的活性[18,19]。
首先取100 μmol·L?1磷酸二氫鉀溶液0、10、20、30、40、50 μL,然后分別加入去離子水補齊總體積為100 μL。混勻后,取37.5 μL至干凈的1.5 mL離心管。每個離心管中加入375 μL顯色劑(鉬酸銨溶液與孔雀綠溶液的體積比1 : 3配制,現配現用),顯色10 min后,以每孔100 μL加入到96孔板中,測定620 nm處的吸光度,制作磷標準曲線。
實驗項目“改變底物濃度對Cy-FBP/SBPase活性的影響”的操作步驟為:在反應體系里加入MgCl215 mmol·L?1,DTT 10 mmol·L?1,pH 8.5 Tris-HCl 50 mmol·L?1,0.04 μg Cy-FBP/SBPase,加水補足22.5 μL,混勻后,分別加入底物FBP 0,0.05,0.1,0.25,0.5,1,2 mM啟動反應,分別反應10 min。然后加入12.5 μL HClO4終止反應,再加入375 μL顯色劑顯色10 min,以每孔100 μL加入到96孔板中,測定620 nm處的吸光度,根據磷標準曲線擬合方程計算Cy-FBP/SBPase催化產生的無機磷的量,從而計算酶的活性。Cy-FBP/SBPase活力單位U的定義是每分鐘催化產生1 μmol·L?1無機磷所需要的Cy-FBP/SBPase酶量為一個酶活力單位。
然后通過單一因子變化分析法,分別改變金屬離子濃度(鎂離子和錳離子)、抑制劑濃度,測定金屬離子、抑制劑對Cy-FBP/SBPase活性的影響。
5 實驗結果與討論
5.1 Cy-FBP/SBPase的制備、純度及含量的分析
為了分析通過生物合成法獲得Cy-FBP/SBPase的純度,以未經pET28a(+)載體誘導的細胞的粗酶液為對照,通過SDS-PAGE分析重組載體未誘導細胞的粗酶液、重組載體誘導細胞的粗酶液、重組細胞裂解后的上清液、純化時的流川液、50 mmol·L?1咪唑洗脫液及250 mmol·L?1咪唑洗脫液中Cy-FBP/SBPase的含量情況(圖1)。從圖1中可以看出,載體pET28a(+)未誘導細胞的粗酶液中沒有目標蛋白的表達(條帶1),重組載體pET-fbp沒有IPTG誘導則沒有目標蛋白的明顯表達(條帶2)。IPTG誘導之后,目標蛋白大量表達(條帶3),而且大部分表達的蛋白存在上清液中,呈現可溶性狀態(條帶4)。流穿液及50 mmol·L?1咪唑洗脫液中只有少量的目標蛋白(條帶5和6),說明有His-tag的目標蛋白和Ni-NTA親和樹脂結合效果比較好;而250 mmol·L?1咪唑洗脫液中有非常純的Cy-FBP/SBPase,純度達到95%以上(條帶7)。因此可以說明異源蛋白的表達及純化是成功的,而且通過蛋白含量的測定,結果顯示1 L培養基可以獲得30 mg Cy-FBP/SBPase。

圖1 用12% SDS-PAGE分析Cy-FBP/SBPase的表達及純化情況
5.2 底物FBP對Cy-FBP/SBPase活性的影響
底物濃度是影響酶活性的直接因素。為了分析底物濃度對Cy-FBP/SBPase活性的影響,在一定酶濃度下,改變底物濃度,測定酶活性。結果如圖2所示。酶活性與底物濃度的關系可以通過Hill方程擬合,得到Cy-FBP/SBPase最大反應速度Vmax為15.02 ± 0.51 U·mg?1,米氏常數Km為0.083 ±0.01 mmol·L?1。米氏常數是酶的特征常數,可表征酶與底物的結合能力。Hill指數為2,說明一個酶單體分子可能結合2個底物分子,這和我們獲得的晶體結構是相符的[19]。
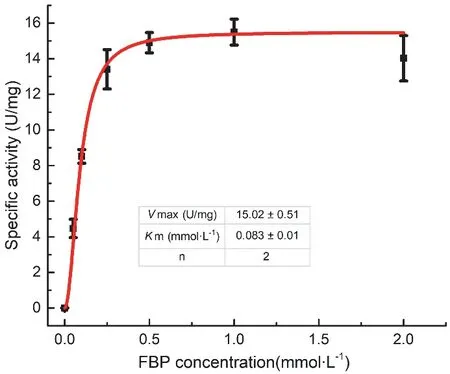
圖2 底物FBP對Cy-FBP/SBPase活性的影響
5.3 金屬離子對Cy-FBP/SBPase活性的影響
根據金屬離子與酶結合的緊密程度,可以將酶分為金屬酶和金屬激酶。對于金屬酶而言,金屬離子和酶緊密結合,蛋白形成過程中金屬離子就已經存在于酶中。而對于金屬激酶,金屬離子和酶結合并不那么緊密,但酶發揮催化作用時,加入金屬離子,可以使酶的活性極大的提高。如圖3所示,當加入金屬鎂離子及錳離子時,Cy-FBP/SBPase的催化活性迅速提高,說明Cy-FBP/SBPase是金屬激酶,但鎂離子及錳離子對Cy-FBP/SBPase的影響又是不同的。隨著鎂離子濃度的增加,Cy-FBP/SBPase的催化活性逐漸升高,然后達到最大值,之后再提高鎂離子濃度,對酶的活性影響不是很明顯。但是錳離子在很低濃度下可以迅速提高酶的活性,之后錳離子濃度的升高則會抑制酶的活性,預示著鎂離子、錳離子與Cy-FBP/SBPase有著不同的作用方式[18,19]。

圖3 金屬離子對Cy-FBP/SBPase活性的影響
5.4 抑制劑對Cy-FBP/SBPase活性的影響
通過以上實驗,我們獲知Cy-FBP/SBPase的酶動力學參數,Cy-FBP/SBPase與不同金屬離子之間的關系。基于對Cy-FBP/SBPase酶學性質的認識,可以建立以Cy-FBP/SBPase為靶點的抑制劑篩選模型,研究抑制劑對Cy-FBP/SBPase的抑制動力學。如圖4所示,我們篩選獲得的化合物小分子D7能抑制Cy-FBP/SBPase的催化活性,隨著化合物濃度的升高,抑制效率逐漸增大,IC50為31.19 ±3.45 μmol·L?1。在此基礎上,可以設計實驗,比較不同抑制劑的IC50,分析抑制劑的結構與抑制活性的關系,獲取抑制劑構效關系的規律,為篩選基于靶酶 Cy-FBP/SBPase 的殺藻劑奠定了基礎[20]。

圖4 抑制劑對Cy-FBP/SBPase活性影響
6 實驗教學模式、教學設計及教學安排
本綜合設計實驗的主題面向社會需求,結合化學生物學科研成果,易于激發學生科研服務社會的意識及增強社會責任感。在強大內動力和社會需求的驅動下,學生帶著目標學習,可以很好地綜合運用所學知識,建立并掌握化學生物學思維方式、實驗技術。本實驗設計為28學時,每組學生最多8人。每組8名學生可以自由組合,分2人一小組完成相應的實驗項目。教學模式、教學設計及教學安排建議如下:
(1) 閱讀文獻:閱讀靶向酶的藥物篩選模型建立的相關文獻并繪制思維導圖,本部分設計為4個學時。首先實驗教師準備10篇靶向酶的藥物篩選方面的最新研究性文獻,然后每位學生至少閱讀其中2篇,這樣可以保證文獻的質量和提高學生選擇文獻的效率,也給學生一定的自主選擇的機會。通過文獻的閱讀,繪制思維導圖,總結靶向酶的藥物篩選模型建立的研究思路、技術路線、關鍵技術及方法,初步構建藥物篩選模型的思維框架,完成信息輸入過程,并以小組討論和個人匯報的形式完成信息輸出過程,教師或助教參與并引導信息輸出過程。通過這4個學時的學習,學生可以提升閱讀科研文獻的能力、了解化學生物學的最新研究進展、研究思路和涉及的實驗技術,同時還可以提升邏輯思維能力、傾聽能力及語言表達能力。
(2) 多個實驗項目的靈活安排與自主選擇相結合。本部分為24學時。實驗項目設置2個必選實驗項目(14學時)、2個任選實驗項目(8學時)及2個說課形式完成的實驗項目(2學時)。
必選實驗項目1為重組酶Cy-FBP/SBPase的制備。這部分實驗是后續所有實驗的基礎,但耗時較長、步驟較多、間隔時間較長。建議這部分內容中挑取單菌落、接種,培養12–16 h;再擴大培養操作,繼續培養3 h左右;然后誘導操作、誘導培養8–10 h,收集細胞、破碎細胞,直至制備出用于親和層析純化所需要的上清粗酶提取液等實驗內容由教師或助教完成。學生可以現場觀摩這部分的操作,或者由教師或助教將操作制作短視頻,發給學生線上觀看學習。
然后,學生可以從親和層析純化蛋白開始進行蛋白制備的實驗操作。由于親和層析法制備蛋白制備這一步是后續實驗的基礎,同時,Ni-NTA親和層析法獲得蛋白的技術也是化學生物學實驗必備技能,重要且耗時較長,所以建議這一必選實驗項目為8學時。
必選實驗項目2為用SDS-聚丙烯酰胺電泳(SDS-PAGE)檢測Cy-FBP/SBPase的純度和大小,這是判斷制備蛋白的質量及設計后續實驗的關鍵環節,這一實驗項目應設定為必選實驗,耗時較長,建議6學時。
2個任選實驗項目是從Braford方法測定蛋白質含量、底物濃度對Cy-FBP/SBPase酶活性的影響、金屬離子對Cy-FBP/SBPase酶活性的影響、抑制劑對Cy-FBP/SBPase酶活性的影響等項目中任選2個實驗項目作為實操實驗項目,完成需要的相關實驗操作,分析、討論實驗結果,提交實驗報告。建議每個項目4學時,共8學時。如果學生能自己合成并表征抑制劑D7,從而對化學生物學綜合實驗會有更為完整的認識,凸顯化學生物學交叉學科的特性,建議和有機合成組的教師進行協商,盡可能讓有機合成實驗項目和化學生物學實驗項目相互銜接,讓學生在有限的學習時間中獲得更多的技能訓練和能力提升。
剩余2未選的實驗項目以說課形式展示實驗原理、實驗設計、預期的實驗結果及分析實驗結果的思路等,建議每個項目1學時,共2學時。
(3) 實驗管理為開放式管理模式。以每組8名學生為單位,其中可以自由組合組成2人小組,學生可以根據自己的時間自主設計實驗、安排實驗項目的開始時間、實驗進度及完成時間。教師對學生設計實驗的合理性進行審核,實驗采用預約制,以便實驗教師提前統籌安排和協調,準備實驗材料并進行指導,確保實驗的順利進行,及時解決實驗中的問題。
(4) 多元化考核評價方式。在本實驗進行過程中學生為主體,教師在每個環節進行必要的引導。考核評價方式采用過程評價和最終實驗結果相結合,以及教師評價、小組互評及個人自評相結合的形式,全方位提高學生的實驗能力、思維能力、表達能力、評價能力及團隊精神。
7 結語
本綜合設計實驗以學科發展及專業人才需求為牽引,立足化學生物學科研前沿,結合化學學院本科三年級學生的知識背景、成長特點,將科研成果轉化為本科教學實驗項目,不斷完善并充實本科實驗教學內容,符合華中師范大學實驗課程教學改革的基本思路。學生通過這一綜合創新實驗項目的訓練,拓展思維視角,提高分析問題及解決問題的能力,提高綜合運用知識的能力,為今后從事化學生物學科研活動及其他相關領域的研究工作奠定基礎。這種將前沿科技成果、先進的科研理念及實驗技術等轉化為本科生高階實驗教學內容的科研與教學的交叉融合將有助于促進化學生物學本科實驗教學課程的建設及完善。

