高效液相色譜法結合主成分分析法分析云芝胞內糖肽中核苷和核堿的組成
張 圓,孫玉娣,石蓓佳,陸益紅*
1 江蘇省食品藥品監督檢驗研究院 生物技術藥品檢驗一室,南京 210019;2 中國藥科大學 藥學院,南京 210009
云芝胞內糖肽是運用現代生物工程技術,從雜色云芝菌(Polystictus versicolor(L).Fr.)經深層培養,由菌體提取獲得的糖肽類物質[1]。
核堿(Nucleobase)是指一類含氮堿基,是在DNA 和RNA 中起配對作用的部分,包括嘌呤堿和嘧啶堿。核苷(Nucleoside)是核堿與核糖或脫氧核糖縮合而成,是核酸和核苷酸的主要組成成分,參與RNA和DNA 組成。核苷和核堿的組成對于評價真菌類藥材及其提取物具有重要的意義。核苷和核堿類成分是生物細胞的基本組成元素,參與DNA 代謝過程、維持生命活動,具有抗腫瘤、抗病毒、基因治療等生理作用[2]。研究核苷和核堿組成對云芝胞內糖肽質量控制有著積極作用。本文采用HPLC-UV 法,對云芝胞內糖肽中核苷和核堿組成和含量進行了測定[3]。
1 儀器與藥品、試劑
儀器:島津LC20AD-UV 檢測器。
對照品:11 種核苷和核堿對照品,見表1。
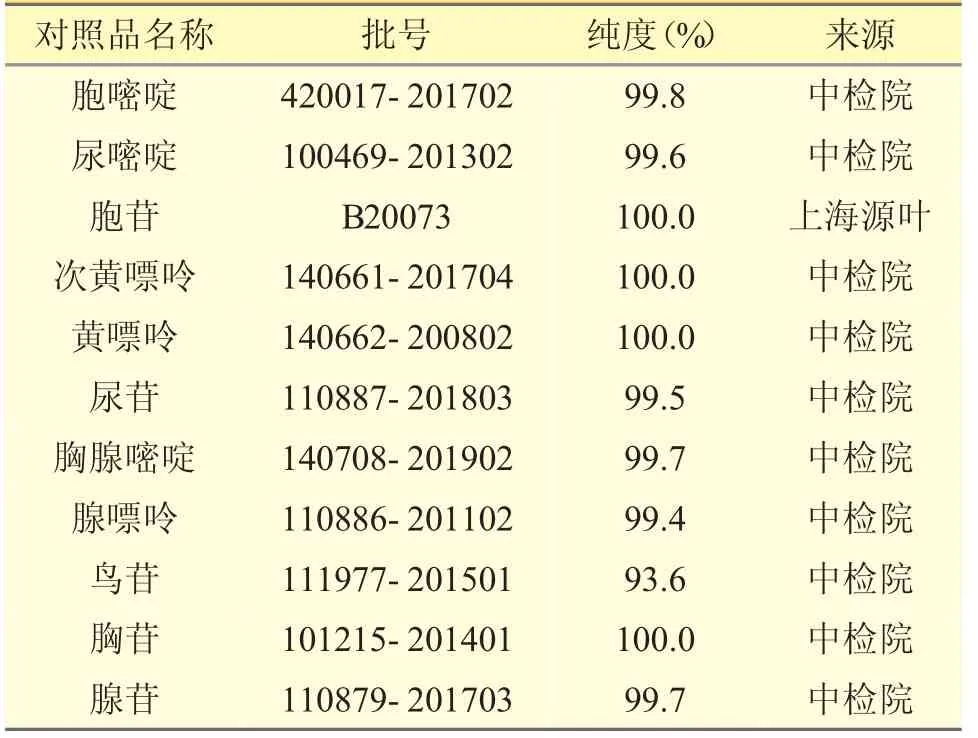
表1 11 種核苷和核堿對照品信息表
樣品:云芝胞內糖肽對照品(批號140692-200301,中國食品藥品檢定研究院);云芝胞內糖肽原料:A 公司(批號S-30200601),B 公司(批號20200101);C 公司云芝胞內糖肽膠囊(批號190203,含量0.5 g);云芝胞內糖肽膠囊、云芝胞內糖肽片樣品共計54 批(含量0.5 g 原料均來自B 公司,制劑處方中無輔料或輔料無干擾)。B 公司提供菌絲體水提醇沉產物(產物1)和培養液濾液醇沉產物(產物2)。A 公司提供的原料中僅含有菌絲體水提醇沉產物。
化學計量學軟件:ChemPattern 2020 版,科邁恩(北京)科技有限公司。
2 方法與結果
2.1 色譜條件色譜柱:月旭AQ-C18(4.6 mm×250 mm,5 μm);流動相A 為水,流動相B 為甲醇,按表2 進行梯度洗脫;檢測波長:260 nm;柱溫:30 ℃;流速:1 mL·min-1;進樣體積:20 μL。
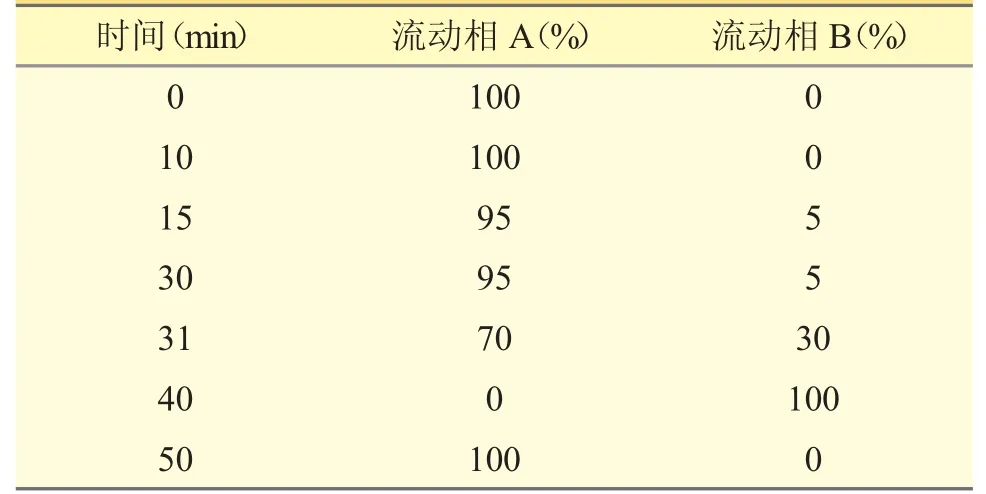
表2 流動相梯度洗脫程序
系統適用性:在對照品溶液(1 μg·mL-1濃度)的色譜圖中,理論板數按腺嘌呤峰計算不低于2000,各核苷和核堿色譜峰之間的分離度應>1.5。
2.2 溶液的制備
2.2.1 對照品溶液 精密稱取表1 中11 種核苷和核堿對照品適量,加水溶解并稀釋成每1ml 中各含1、2、5、10、20、50、100 μg 的系列混合對照品溶液。
2.2.2 供試品溶液 取云芝胞內糖肽膠囊內容物、云芝胞內糖肽片研細,精密稱取200 mg,置20 mL量瓶中,加水15 mL,超聲振蕩30 min,冷卻至室溫后用水稀釋至刻度,5000 r·min-1離心10 min,取上清液,用0.22 μm 濾膜過濾,即得。
2.3 含量測定
精密量取對照品溶液、供試品溶液各20 μL,注入高效液相色譜儀,記錄色譜圖,以標準曲線法計算出各樣品中核苷和核堿的含量。
2.4 方法學驗證
2.4.1 線性范圍 取11 種混合對照品溶液,用水稀釋,配制成含11 種核苷和核堿各1、2、5、10、20、50、100 μg·mL-1的標準曲線溶液,以峰面積(Y)對濃度(X)進行線性回歸,得各組成分在1~100 μg·mL-1范圍的回歸方程和相關系數(r>0.9940)。表明各組分線性關系良好。測定結果見表3;分離圖譜見圖1。
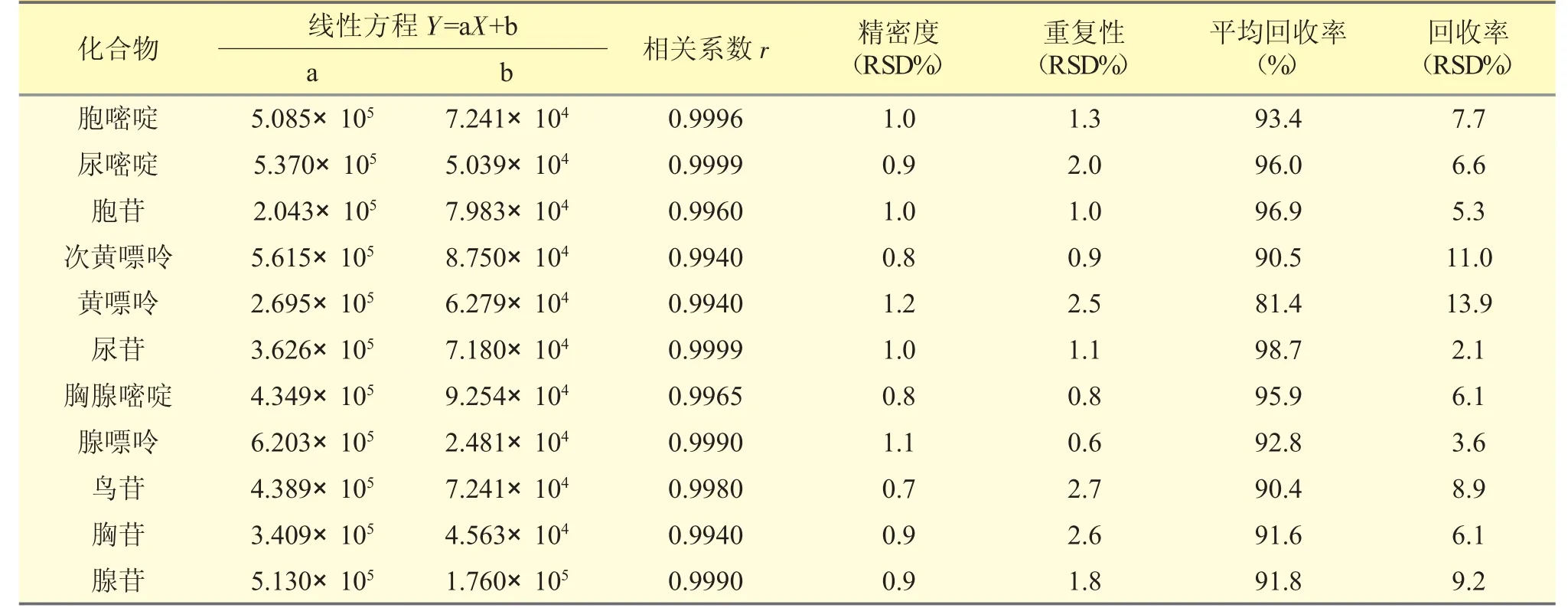
表3 11 種核苷和核堿的分析方法驗證結果(n=6)
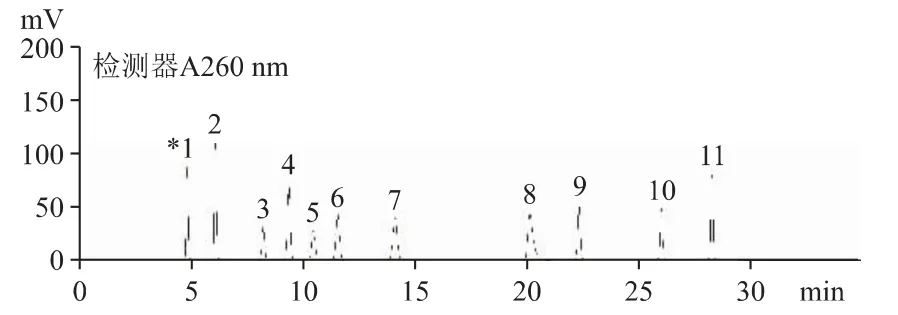
圖1 混合對照品核苷和核堿的HPLC 色譜圖
2.4.2 進樣精密度試驗 取同一濃度混合對照品溶液,連續進樣6 次,計算峰面積相對標準偏差RSD%,計算各峰峰面積的RSD%(n=6)。精密度考察結果顯示,各峰峰面積的RSD 均<1.0%,精密度良好。結果見表3。
2.4.3 重復性試驗 取同一批樣品6 份,按“2.2.2”供試品溶液的制備方法,從“加水15 mL 起”同法處理,測定重復性。各峰峰面積的RSD 均<3.0%。結果見表3。
2.4.4 加樣回收率試驗 取同一批已知含量的樣品6 份,精密稱取200 mg 置20 mL 量瓶中,分別加入含各核苷和核堿100 μg·mL-1的對照品溶液1 mL,按“2.2.2”供試品溶液的制備方法,從“加水15 mL 起”同法處理,測定其峰面積,按標準曲線法計算加樣回收率%和RSD%。各成分回收率分別在81.4%~98.7%。結果見表3。
2.4.5 穩定性試驗 取對照品溶液和供試品溶液,分別于0、4、8、12、16、24 h 進樣,各峰峰面積的RSD均<0.5%,對照品溶液和供試品溶液在24 h 內穩定。
2.5 各樣品核苷和核堿總量見表4。

表4 核苷和核堿組成和含量結果(%,云芝胞內糖肽含量)
2.6 檢品成分說明
2.6.1 在B 公司原料及54 批云芝胞內糖肽膠囊/片中含有較多的尿嘧啶、尿苷、腺嘌呤、鳥苷、腺苷及少量胞嘧啶、尿嘧啶、次黃嘌呤等。B 公司原料(批號20200101)和C 公司云芝胞內糖肽制劑(批號190203)的HPLC 圖分別見圖2 和圖3。
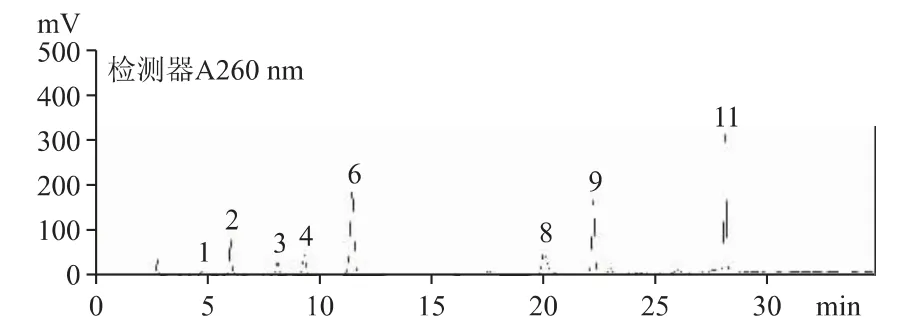
圖2 B 公司原料(批號20200101)核苷和核堿的HPLC 色譜圖
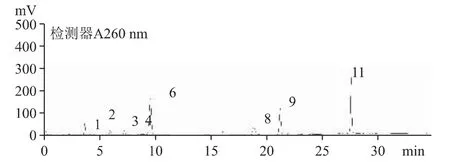
圖3 C 公司云芝胞內糖肽膠囊(批號190203)(原料由B 公司提供)核苷和核堿的HPLC 色譜圖
2.6.2 A 公司來源的原料和中檢院對照品含有較多的尿苷、鳥苷和腺苷,為優勢代謝成分及少量胞嘧啶、尿嘧啶、次黃嘌呤等,中檢院對照品核苷和核堿總量約為B 公司來源的原料的兩倍,種類和含量均有明顯區別,見圖4、圖5。
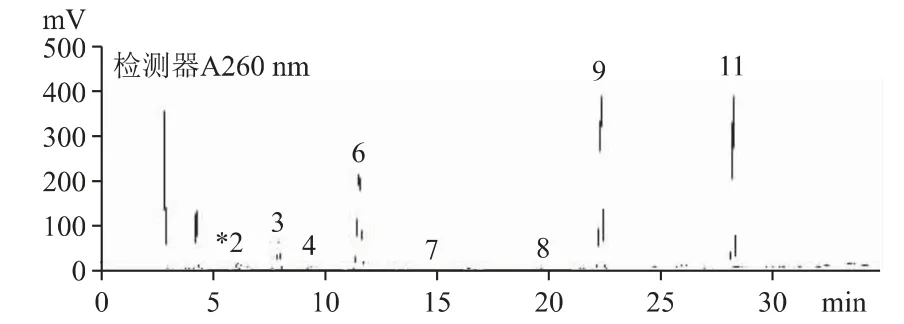
圖4 云芝胞內糖肽對照品(中檢院,140692-200301)核苷和核堿的HPLC 色譜圖
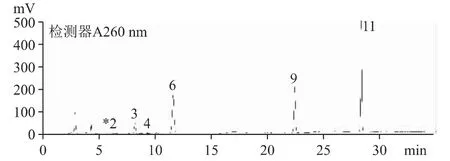
圖5 A 公司原料(S-30200601)核苷和核堿的HPLC 色譜圖
2.6.3 菌絲體(產物1)中的核苷種類與B 公司原料一致(見圖6)。B 公司的培養液(產物2)中未檢出核苷,與細胞外無生命活動有關(見圖7)。
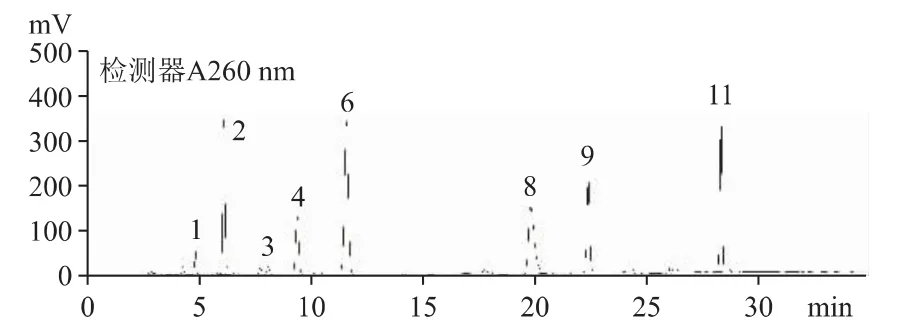
圖6 產物1 核苷和核堿的HPLC 色譜圖
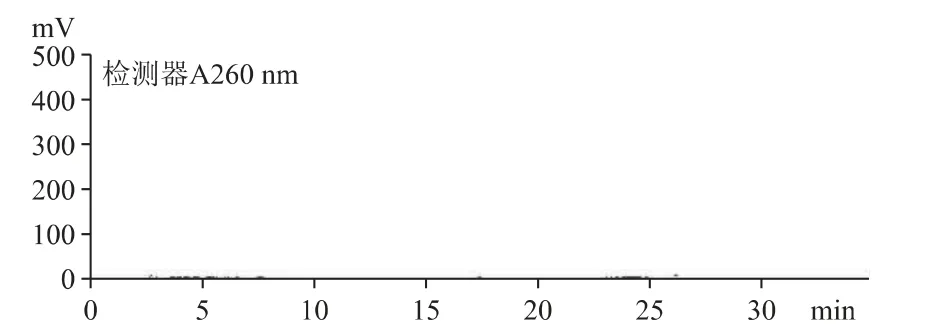
圖7 產物2 核苷和核堿的HPLC 色譜圖
2.6.4 多元統計分析技術-主成分分析法區分不同生產工藝樣品 采用ChemPattern 2020 版軟件[4]的多元統計分析技術-主成分分析法,以9 批B 公司膠囊樣本中各核苷和核堿的含量建立共有模式,對樣本間的相關性和主成分貢獻率進行分析。
各樣本多元統計分析獲得的主成分分析聚類得分圖和載荷圖(PCA 圖)見圖8。2D PCA 圖顯示:其他廠家共45 批膠囊/片樣本游離糖組成與自建的共有模式同群,產物1、中檢院對照品、A 公司原料、產物2 與自建的共有模式離群。
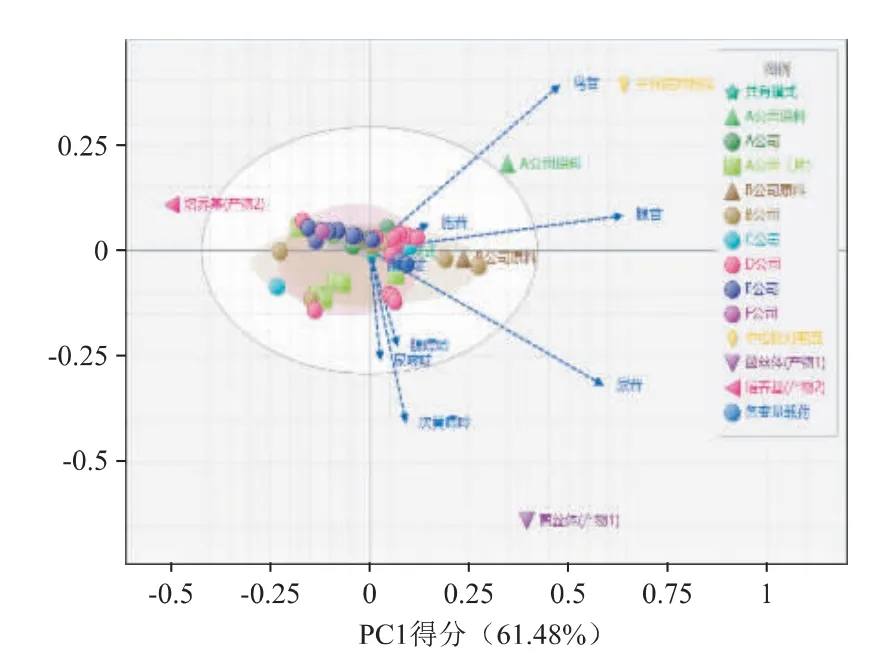
圖8 核苷和核堿組成測定主成分分析聚類得分圖和載荷圖(PCA 圖)
結合載荷圖可知,尿苷、腺苷為樣本識別的主要因素;其次為鳥苷、次黃嘌呤。產物2 因不含核苷成分而離群,中檢院對照品、A 公司原料因鳥苷、腺苷等含量高而離群,產物1 因次黃嘌呤、尿苷含量較高而離群。
綜合聚類得分圖和載荷圖的結果,不同原料來源的聚類區分,可在核苷和核堿的含量差異、比例差異上得到體現:如A 公司來源的對照品和原料含有較多的鳥苷和腺苷,產物1(菌絲體成分)含有較多的尿苷、次黃嘌呤、腺嘌呤、尿嘧啶、鳥苷和腺苷。產物2(培養基成分)不含核苷成分,如將其與產物1 混合作為原料,可能導致藥效的下降。
3 討論
3.1 考察了不同色譜柱的耐用性,如月旭AQ-C18柱(4.6 mm×250 mm,5 μm),Luna-C18柱(4.6 mm×250 mm,5 μm),Waters Xbridge C18柱(4.6 mm×250 mm,5 μm),結果各色譜峰分離度均良好。
3.2 對提取溶劑、提取方式、超聲時間等進行了考察。結果表明,以水為溶劑,超聲提取30 min 時,核苷和核堿提取效率較高,且含量較為穩定。
3.3 對新建立的核苷和核堿檢測方法進行了方法學驗證,線性關系良好,相關系數均>0.9940,11 種成分的線性均在1~100 μg·mL-1,儀器精密度良好(RSD<2%)、樣品回收率在81.4%~98.7%,均能滿足云芝胞內糖肽中測定核苷和核堿成分的要求。該方法前處理簡單,檢測方法靈敏,結果準確。

