癥狀性非急性期大腦中動脈閉塞血管內再通治療研究進展
黃銳 賴賢良 熊元元 程祖玨
癥狀性非急性期大腦中動脈閉塞(symptomatic non-acute middle cerebral artery occlusion,SNMCAO)是指經積極內科治療仍然有癥狀波動或惡化的大腦中動脈粥樣硬化性閉塞,經血管影像學檢查無前向血流信號(TIMI分級為0)且閉塞時間超過24 h[1]。目前對于SNMCAO最新的治療方法是血管內再通治療,通常采用單純球囊擴張術(percutaneous transluminal angioplasty,PTA)或經皮球囊支架置入術(percutaneous transluminal angioplasty and stenting,PTAS)。但對于SNMCAO影像學評估,患者選擇及血管內治療術式沒有一個統一的標準,對血管內治療SNMCAO預后情況也缺乏長期效果的肯定。本文就對SNMCAO血管內再通治療最新進展作一綜述。
1 SNMCAO影像學評估
傳統的SNMCAO影像學評估包括經顱多普勒超聲(transcranial doppler,TCD)、經顱彩色多普勒超聲(transcranial colorcoded duplex ultrasonography,TCCD)、CT 灌注成像(computed tomography perfusion,CTP)、磁共振灌注成像(perfusion weighted imaging,PWI)、數字減影血管造影技術(digital subtraction angiography,DSA)等。通過這些檢查可評估大腦中動脈(middle cerebral artery,MCA)管徑大小和腦組織血流灌注情況,反映腦血管解剖上的改變,動態顯示腦循環由動脈至靜脈的變化過程[2-4]。相比較CTP、PWI等評估腦灌注的手段,動脈自旋標記(arterial spin labeling,ASL)是一種比較新的檢測方式,利用動脈水中磁標記質子作為內源性示蹤劑,然后通過減去標記和控制信號得到灌注圖,是一種無創、可重復評估腦灌注的方法[5]。ASL聯合血管壁高分辨率磁共振(high-resolution vessel wall magnetic resonance imaging,HR-MRI)還可以對 SNMCAO 的血管管徑、血管內膜炎癥情況、管壁特點、管壁厚度、斑塊特征、血管壁結構及血管周圍附近側支循環等進行評估[6-9],同時根據血管壁的差異及灌注的特征可有效的鑒別煙霧病[10]。但TIAN等[11]研究認為與CTP相比,ASL傾向于高估嚴重慢性大腦中動脈(middle cerebral artery,MCA)狹窄患者的灌注缺陷。磁敏感加權成像(susceptibility-weighted imaging,SWI)可通過檢測鐵的變化,量化鐵的含量來診斷責任血管供血區域是否有微出血及出血傾向[12-13]。
目前 GAO等[14]通過 DSA提出 SNMCAO新分型(圖1):I型,MCA M1段主干閉塞,閉塞長度≤10 mm,在 M1遠端或分叉處可見遠側側枝逆行充盈;II型,MCA M1段主干閉塞,閉塞長度>10 mm,M1遠端分叉處可見遠側側枝逆行充盈;III型,MCA M1段主干閉塞,M2段可見遠端側支逆行充盈,但M1遠端及分叉未見。
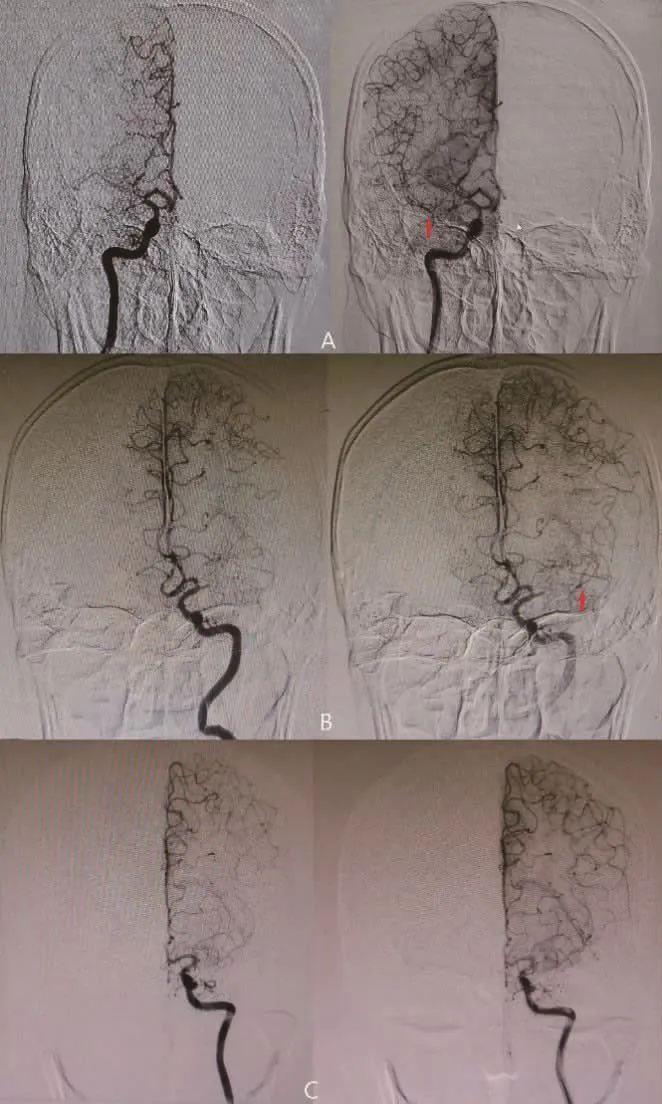
圖1 SNMCAO的血管造影示意圖 A.I型,MCA M1段主干閉塞,閉塞長度≤10 mm,在M1遠端或分叉處可見遠側側支逆行充盈;B.II型,MCA M1段主干閉塞,閉塞長度>10 mm,M1遠端分叉處可見遠側側支逆行充盈;C.III型,MCA M1段主干閉塞,M2段可見遠端側支逆行充盈,但M1遠端及分叉未見。M1遠端分叉的可定義為在血管造影圖像上通過遠端側支逆行觀察MCA上至少兩個主要分支[14](紅色箭頭表示M1遠端分叉)。
通過多種影像學評估聯合SNMCAO分型可很好地選擇患者進行血管內治療。
2 SNMCAO血管內治療病例選擇
2.1 適應證及禁忌證目前多數學者[14-17]認為血管內治療SNMCAO手術適應證:①盡管進行積極地治療,患者病情仍然惡化;②腦梗死面積不超過供血動脈面積的1/5;③低灌注區大,梗死面積與CTP、ASL、DSA不匹配度>50%;④被阻塞的MCA直徑估計超過2 mm,長度小于15 mm;⑤未見明顯微出血灶及出血傾向。手術禁忌證除一般手術禁忌證還包括:①已知對阿司匹林、氯吡格雷、肝素、造影劑過敏;②非動脈粥樣硬化性閉塞,如煙霧病或血管炎等;③側支循環發育良好,動脈自旋標記檢測MCA區域灌注充足。
2.2 根據SNMCAO新分型篩選在GAO等[14]研究中I型病變血管再通率最高(95.5%),圍手術期并發癥發生率較低(4.5%)。II型再通成功率83.3%和圍手術期并發癥11.1%。III型病變,顯示再通率(60%)低,圍手術期并發癥發生率(40%)高。I型是對于仍有血流動力學障礙及藥物治療效果較差患者最適合開通類型。II型開通比I型更困難,閉塞段較長(>10 mm),但由于不累及M1遠端分叉,閉塞段仍局限于M1段主干。對于藥物難治性II型病變患者,需要綜合考慮血管內治療作為替代治療的風險和效益。III型由于累及M1遠端分叉,以及閉塞長度、分支間夾角和分支直徑的不確定性,這些病例血管內再通的手術風險顯著增加,應謹慎進行血管內再通手術。
3 SNMCAO血管內治療的技術處理
3.1 術前準備①患者均接受100 mg/d阿司匹林和75 mg/d氯吡格雷,至少口服5 d以上,不足5 d患者在再通治療前給予300 mg負荷劑量的阿司匹林和氯吡格雷。完善血栓彈力圖指導抗血小板的治療,手術前必須控制好血壓、血糖、膽固醇和其他與動脈硬化相關的危險因素[14-15];②術前2h可使用尼莫地平預防術中腦血管痙攣[16]。
3.2 血管內治療方法對于開通SNMCAO手術方式是選擇PTAS還是選擇PTA,目前沒有相關性的研究。在理論上,PTAS比PTA具有更大的優勢,可以防止早期彈性后縮、負性重塑和急性夾層,但CHIMOWITZ等[18]發現,接受PTAS聯合藥物治療的顱內嚴重動脈粥樣硬化患者卒中復發率和死亡率明顯高于單純接受單純藥物治療的患者。PADALIA等[19]認為PTAS可用于在顱內動脈閉塞時血流動力學不穩定或多次調整藥物治療失敗的患者。CHEN K等[17]認為在腦梗死體積小、低灌注面積大的情況下,即使腦梗死發病時間較長,再通仍是可行的。當在小動脈分支附近的狹窄血管上進行血管成形術時,應謹慎決定是否使用支架置入術,以免被壓碎的斑塊堵塞穿支動脈[20]。
IARED等[21]對鎖骨下動脈狹窄治療的研究認為目前還沒有足夠的證據來確定支架治療比單純血管成形術更有效。LEVY等[22]對基底動脈狹窄的研究認為直接放置支架可能會導致動脈粥樣硬化碎片移位或破裂導致穿支動脈閉塞造成醫源性神經功能缺損和腦橋梗死的影像學表現。對于復雜的、高度癥狀性的病變,可先行單純球囊擴張,1個月后隨訪再行支架置入術可以提供最大的成功率,同時最小化神經系統疾病的風險。DERDEYN等[23]認為減少血管內治療的術中及術后風險可單純行PTA而不是PTAS,或者使用HR-MRI來制定治療計劃或選擇患者,使支架置入后發生穿支動脈卒中的風險可以降低,但對于有證據表明在穿支血管段附近存在不穩定或破裂斑塊的患者,積極的危險因素管理可能比機械干預更有效。對于是否考慮支架置入可根據血管開通后觀察半小時判斷血管是否回彈,如果達到重度狹窄(70%~99%)甚至再次閉塞,可以考慮支架置入。
3.3 血管內治療技術要點目前多數學者[14-17,24-25]認為SNMCAO血管內治療成功技術要點:①微導絲能否順利通過閉塞段,需判斷閉塞血管的性質、閉塞長度、角度和閉塞時間。閉塞節段長度越長,角度越彎曲,微導絲探查時血管穿孔和剝離的可能性越大。血管閉塞時間越長,閉塞段鈣化、纖維化越嚴重,再通過程越困難;②術中動作輕柔,避免使用粗暴手法,遇到難以通過的迂曲或閉塞需及時終止手術,避免嚴重并發癥的發生;③微導絲微導管小心通過閉塞段并造影觀察遠端管腔形態,確認位于血管真腔內;④當梗塞段出現夾層的情況需置入支架。
3.4 術后處理①所有患者治療后立即行頭顱CT檢查,排除顱內出血。對于再通成功的患者,如果排除顱內出血,則靜脈輸注 0.15 μg/(kg·min)替羅非班 24~36 h,以預防急性血栓或血栓栓塞[16]。②服用雙聯抗血小板藥物(阿司匹林100 mg/d;氯吡格雷 75 mg/d),未置入支架者服用 3個月,置入支架者服用6個月,然后根據隨訪情況繼續終生服用兩種抗血小板藥物中的一種。同時給患者他汀類藥物治療[16]。③嚴格控制患者血壓,預防高灌注綜合征(hyperperfusion syndrome,HPS),將血壓控制在術前血壓的80%或控制在 100~120 mmHg/60~80 mmHg[15-16]。④術后 3~7 d常規行頭部MRI檢查,以發現遠端栓塞或出血改變。⑤對患者進行控制其他危險因素(血壓、高脂血癥、血糖等)的教育。
4 血管內治療SNMCAO效果評價
4.1 成功率和復發率10項研究共涉及115例SNMCAO患者(表 1),這些患者接受了 PTA 或 PTAS[14-17,24-29],閉塞至再通時間跨度為 4 d到168 d,其中 98例(85%)患者成功實現了血管再通,7例(7/95)患者3~12月隨訪中出現卒中復發或死亡,與中國顱內動脈粥樣硬化(CHINESE INTRACRANIAL ATHEROSCLEROSIS,CICAS)研究中顱內動脈閉塞卒中的復發率(7%)相當[30]。
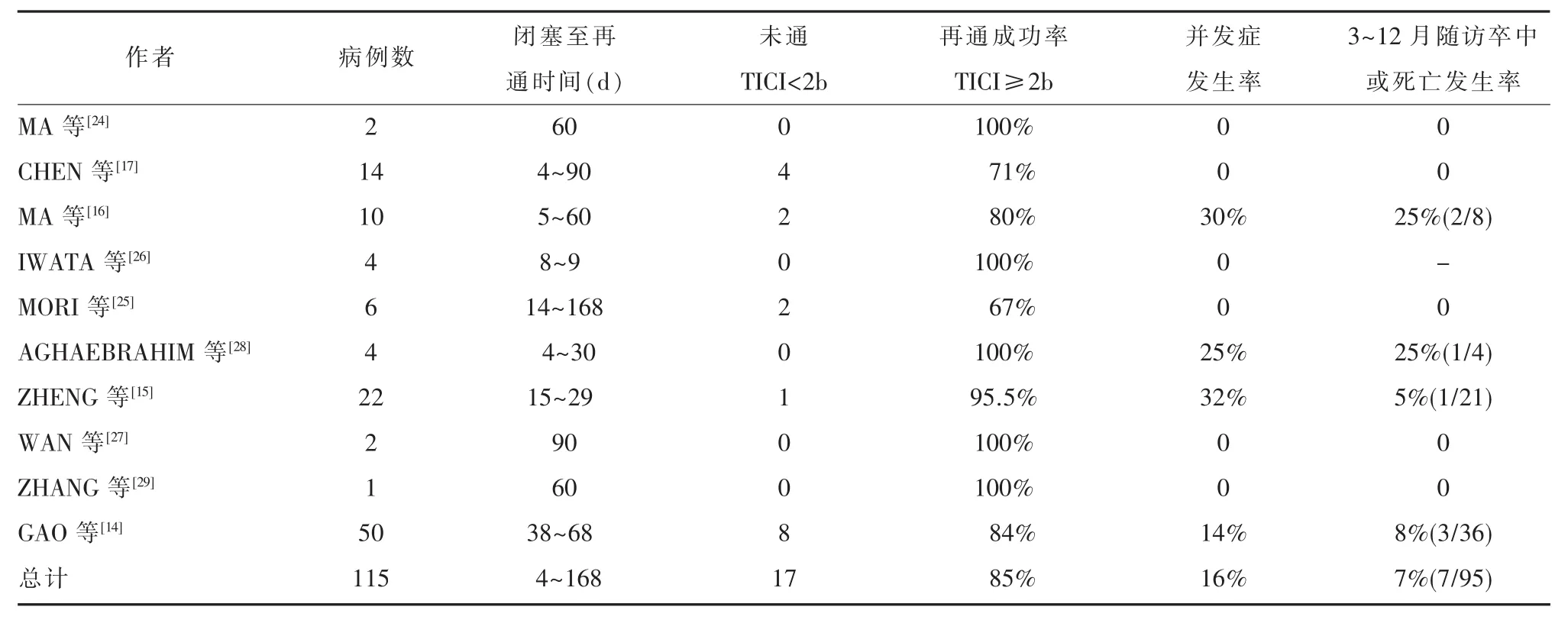
表1 國內外相關研究的病例特征
4.2 并發癥的處理非急性期大腦中動脈閉塞血管內治療因技術難度大,并發癥發生率較高。常見并發癥包括血管穿孔,蛛網膜下腔出血,高灌注綜合征,穿支梗塞等[31]。血管穿孔及蛛網膜下腔出血:術中可發現造影劑滲出,可在MCA近端充盈球囊暫時堵住破口,起到止血的作用,必要時可予以覆膜支架或彈簧圈栓塞進行治療[32]。高灌注綜合征:主要以預防為主,血管開通過后,必須嚴格控制血壓,為基礎血壓水平的80%或控制在100~120 mmHg/60~80 mmHg,必要時鎮靜、脫水等治療[15,33]。穿支梗塞:術中可根據造影情況判斷梗塞分支,微導管內注射低劑量(0.25~1 mg)替羅非班[34]。血管夾層形成:微導絲通過閉塞段時容易導致血管夾層形成,微導管造影確定在真腔內后,根據術中情況可置入支架以消除夾層[35]。血管再通失敗見于閉塞節段較長(>10 mm),閉塞時間較長(>90 d),閉塞段累計M1段分叉及M2段,路徑迂曲或成角等[14-16]。
5 結語
從已有的研究結果看,血管內再通治療SNMCAO技術上是可行的,相對安全的,并且可以改善患者的缺血癥狀。然而目前對SNMCAO的治療仍缺乏高水平的多中心前瞻性隨機對照研究作為臨床證據。相信隨著介入材料、技術更新及進步,血管內再通治療可能成為SNMCAO患者改善神經功能,提高生活、生存質量的一個新選擇。

