湖南懷化地區豬源大腸埃希菌耐藥性及耐藥基因檢測
陳 良 , 鄧 煒 , 陳 告 , 王水蓮 , 朱國華 , 邱小燕
(1.懷化市農業科學研究所 , 湖南 懷化 418000 ; 2.湖南農業大學動物醫學院 , 湖南 長沙 410000 ; 3.懷化學院生物與食品工程學院 , 湖南 懷化 418000)
豬大腸埃希菌病是由致病性大腸埃希菌(Escherichiacoli)引起的豬的一種細菌性傳染病,廣泛存在于世界各地,給養豬業帶來嚴重損失[1],常引起仔豬白痢、仔豬黃痢和仔豬水腫等疾病。治療該病的藥物主要為抗菌類藥物,但是藥物長期不合理的使用,使得大腸埃希菌耐藥程度和多重耐藥性問題愈發突出[2-6],并且大腸埃希菌血清型復雜,交叉免疫保護力不高,免疫效果不理想,導致其防治日益嚴峻,形勢不容樂觀[7-8]。
為了掌握湖南省懷化地區中小規模養豬場的大腸埃希菌耐藥現狀,建立該區域針對性的防治措施,本試驗在轄區20個中小規模養殖戶采集120份樣品,依托本單位畜牧實驗室進行藥敏試驗和耐藥基因檢測。為指導該地區養殖戶針對該病正確防治和相關獸藥監管提供參考。
1 材料與方法
1.1 試驗材料
1.1.1 試驗菌株 試驗用大腸埃希菌分離自2019年3—7月從懷化地區的溆浦縣、中方縣、洪江區、鶴城區、洪江地區、芷江縣、新晃縣、辰溪縣、麻陽縣和會同縣10個縣(地區、區)內的20個中小規模養豬場采集的120份糞便拭子。
1.1.2 主要試劑及藥敏紙片 麥康凱瓊脂、伊紅美藍培養基、TSA營養瓊脂粉、MH瓊脂培養基,均購自青島海博生物有限公司;2×TaqMaster Mix、DL2 000 DNA marker,均購自天根生化科技(北京)有限公司;引物由北京擎科新業生物技術有限公司合成;10種藥敏紙片購自杭州微生物試劑有限公司,藥敏紙片及濃度分別為:紅霉素(15 μg/片)、諾氟沙星(10 μg/片)、環丙沙星(5 μg/片)、復方新諾明(25 μg/片)、氯霉素(30 μg/片)、青霉素(10 U/片)、氨芐西林(10 μg/片)、頭孢唑啉(30 μg/片)、丁胺卡那霉素(30 μg/片)、慶大霉素(10 μg/片)。
1.2 大腸埃希菌的分離鑒定
1.2.1 樣品采集與初步分離鑒定 采用直腸拭子法采集樣品,放入盛有0.9%生理鹽水的EP管中,冷藏運輸。將采集的樣品無菌操作劃線于麥康凱培養基上,37 ℃ 培養18~24 h后,將圓形、光滑、隆起、濕潤、紅色疑似菌落在伊紅美蘭培養基上37 ℃再培養18~24 h,然后選取紫黑色帶有金屬光澤疑似大腸埃希菌,用革蘭染色法進行染色和鏡檢。根據觀察結果,將其純化培養,4 ℃冷藏備用。
1.2.2 PCR擴增檢測 參照文獻[9-11]提取大腸埃希菌DNA。16S rRNA通用引物序列為F:5′-AGAGTTTGATCCTGGCTCAG-3′;R:5′-GGTTACCTTGTTACGACTT-3′,以提取的細菌DNA為模版,反應體系為25 μL:DNA模版1 μL、上下游引物各1 μL、2×TaqMaster Mix 12.5 μL,加ddH2O補足至25 μL。 PCR反應條件為35個循環,預變性94 ℃ 5 min, 進入循環94 ℃ 50 s,58 ℃ 50 s,72 ℃ 50 s,72 ℃延伸10 min,4 ℃保存或將PCR產物在1%瓊脂糖凝膠電泳檢測。將含有目的片段的凝膠回收送北京擎科新業生物技術有限公司進行測序,將測序結果與GenBank中大腸埃希菌參考基因進行比對。
1.3 藥敏試驗 采用K-B紙片瓊脂擴散法對分離菌株進行10種常用抗菌藥物的敏感性試驗[12]。將分離菌株分別接種于營養肉湯,37 ℃ 培養18 h,用生理鹽水調節菌液至0.5麥氏濁度(含菌量1×108CFU/mL),然后量取100 μL菌液,用涂布棒在MH瓊脂培養基均勻涂布,待干后,在培養基上分別將藥敏紙片均勻粘貼,37 ℃ 培養16~18 h。結果參照《抗菌藥物敏感性試驗執行標準》2012版[13-14]進行判定。
1.4 耐藥基因擴增 參考相關文獻[15-16]擴增大壞內酯類(emB、emC、emF)、磺胺類(Sul1、Sul2)、氨基糖苷類[aadA1、aac(3′)-Ⅱa]和酰胺醇類floR共4類8種耐藥基因,引物信息見表1,引物由北京擎科新業生物技術有限公司合成。以提取的細菌DNA為模版進行PCR擴增。反應體系為25 μL:模版1 μL、上下游引物各1 μL、2×TaqMaster Mix 12.5 μL,加ddH2O 補足至25 μL。PCR反應條件為35個循環,預變性95 ℃ 5 min,進入循環94 ℃ 50 s,按各引物Tm值退火50 s,72 ℃ 50 s,72 ℃ 延伸10 min,結束后用1%瓊脂糖凝膠電泳鑒定。

表1 耐藥基因引物信息Table 1 The primers of PCR for antibiotic genes
2 結果
2.1 菌株初步鑒定 從120個糞便拭子中分離86株疑似大腸埃希菌,其在麥康凱培養基中表現為邊緣光滑整齊、分布均勻的粉紅色、扁圓形的菌落;伊紅美藍培養基表現為大小一致、具有金屬光澤的黑色菌落。經革蘭染色后在顯微鏡下觀察為革蘭陰性菌,單個或成對存在,有菌毛、無芽胞,兩端鈍圓的粗短桿菌。
2.2 PCR鑒定 用16S rRNA的通用引物對86株分離菌株進行PCR檢測,其片段大小為1 474 bp目的條帶,產物的測序結果與GenBank中大腸埃希菌參考基因序列同源性為99%,進一步驗證本試驗分離菌株為大腸埃希菌,部分菌株PCR結果見圖1。
圖1 大腸埃希菌16S rRNA PCR鑒定Fig.1 16S rRNA PCR identification of Escherichia coliM:DL2 000 DNA marker; N:陰性對照; 1~10:分離菌株M:DL2 000 DNA marker; N:Negative control; 1-10:Isolated strains
2.3 藥敏試驗 將分離鑒定出的86株豬源大腸埃希菌進行7類10種抗菌藥物的敏感試驗,試驗結果表明,該批次分離的大腸埃希菌對參試的部分抗生素藥物耐藥率高,如紅霉素、復方新諾明分別為93.02%、86.05%,但丁胺卡那霉素敏感率最高,為86.05%,中敏率介于4.65%~32.56%,見表2。
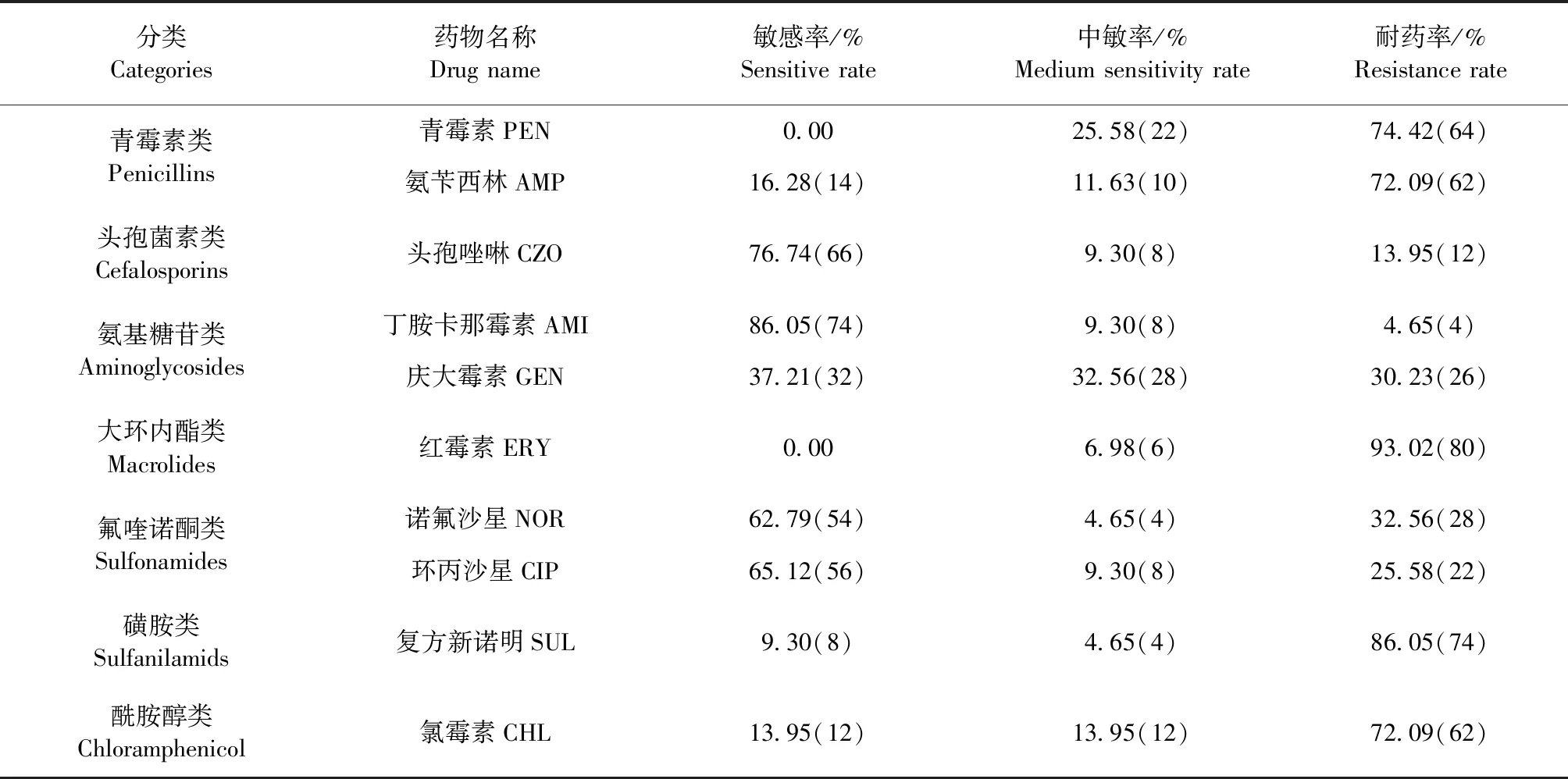
表2 藥物敏感性試驗Table 2 Drugs sensitivity test
2.4 耐藥基因檢測 對86株分離菌株進行了4類8種耐藥基因檢測,8種耐藥基因[aadA1、aac(3′)-Ⅱa、floR、Sul1、Sul2、emB、emC、emF]電泳檢測和抽樣測序結果顯示,擴增的片段大小與預期基本一致,且電泳檢測結果顯示,各基因陰性對照成立。耐藥基因檢出率顯示,Sul2的檢出率最高,為86.05%,其他依次為emF、floR、emB、aac(3′)-Ⅱa、aadA1、Sul1和emC,見表3。
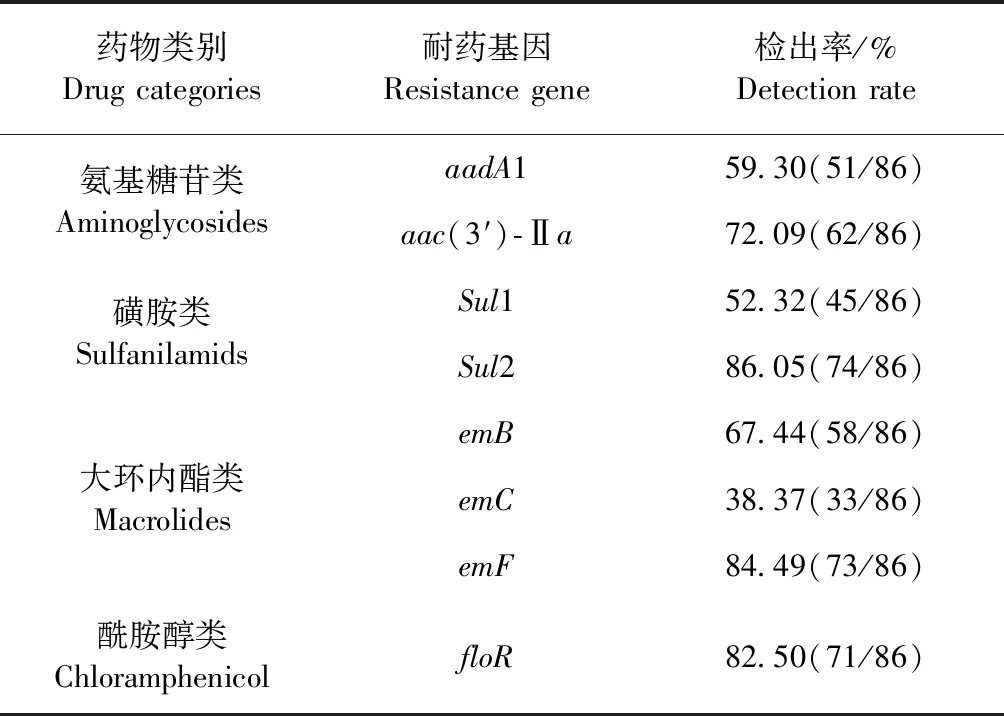
表3 86株豬源大腸埃希菌耐藥基因檢出率Table 3 The drug resistance genes detection rate of 86 Escherichia coli strains isolated from swine
3 討論
本試驗對成功分離和鑒定出的86株Escherichiacoli開展的7類10種抗菌藥物的藥敏試驗,結果顯示,分離菌株對部分抗菌藥物的耐藥性嚴重,其中紅霉素耐藥率最高,為93.02%;復方新諾明、青霉素、氨芐西林和氯霉素耐藥率也比較嚴重,介于72.09%~86.05%;諾氟沙星、環丙沙星、頭孢唑啉的耐藥率在13.95%~32.56%;但對丁胺卡那霉素耐藥率最低,為4.65%,該結果與其他動物源Esche-richiacoli的部分耐藥率有所差異,這可能與地域、菌株來源、動物種類、藥物使用習慣等藥物使用背景等因素有關。戰曉微[17]開展了47株大腸埃希菌中檢出產超廣譜β-內酰胺酶29株對四環素、環丙沙星、慶大霉素耐藥性試驗,其耐藥菌株檢出率分別70.21%、20.27%、14.89%;吳立婷[18]對揚州地區臨床分離獲得的226株寵物源大腸埃希菌菌株進行體外抑菌試驗,其耐藥檢出率分別為慶大霉素28.32%、氨芐西林72.12%、氯霉素為32.30%;葛晨玲等[15]對廣西豬源大腸埃希菌進行31種抗菌藥物的藥敏試驗,結果顯示,對青霉素、磺胺甲惡唑、慶大霉素等耐藥性均高達87.10%;張莉莉等[19]對122株奶牛乳房炎大腸埃希菌的分離菌株進行青霉素藥敏試驗,其耐藥率高達99.19%。值得注意的是,氯霉素在本試驗中的耐藥率是吳立婷[18]試驗結果的2.2倍,提示在日常的用藥過程中盡量避免使用酰胺醇類藥物。同時,所有參試的藥物中敏率居于4.65%~32.56%,可能長期使用同類藥物或短時期內高頻率的使用同類藥物。為此,在本地區的畜牧生產應避免使用紅霉素和青霉素,并盡量少使用復方新諾明、氨芐西林和氯霉素等耐藥性較強或敏感性低的藥物,應合理用藥、輪換用藥。
耐藥基因檢測結果表明,懷化地區中小型養豬場耐藥基因檢出率整體水平較高,其中Sul2、emF、floR相對較高,其檢出率分別為86.05%、84.49%、82.50%;其次為耐藥基因aac(3′)-Ⅱa、emB、aadA1、Sul1和emC,依次為72.09%、67.44%、59.30%和52.32%;而emC的檢出率最低,為38.37%。這與在對本地區養殖戶實地走訪中了解到的情況基本相符,當地養殖戶常使用磺胺類、酰胺醇類和大環內酯類藥物,可能的原因是此類藥物價格便宜、療效較好、抗菌譜廣,作為藥物或飼料添加劑深受養殖戶青睞。該試驗結果與其他動物源Escherichiacoli部分結果存在差異,特別是耐藥基因floR、sul2遠遠高于其他研究結果。湯景元等[20]開展氨基糖苷類的耐藥基因aadA1的檢測,檢出率為65.89%;張炳亮等[21]對洛陽地區氨基糖苷類的耐藥基因aac(3′)-Ⅱa進行檢測,檢出率為88.20%;馬超[11]對寧夏地區抗生素類藥物的耐藥基因Sul1、Sul2、aac(3′)-Ⅱa、aadA1進行檢測,檢出率分別為31.8%、37.4%、27.1%、19.3%;索朗斯珠等[22]對西藏6個不同地區的200株牦牛源大腸埃希菌耐藥基因檢測,其中floR、Sul1、Sul2檢出率分別為25%、7%、7%。本試驗中,多數病原菌株的耐藥率與基因檢出率情況大致相同,但是氨基糖苷類結果差距較大,可能存在下面幾點原因:(1)本試驗所檢測的氨基糖苷類的耐藥基因偏少,沒有對其他可能的耐藥基因進行檢測;(2)目前已知氨基糖苷類耐藥機制有3種,可能是由于其他或新的非耐藥基因介導機制造成耐藥表型與耐藥基因的符合率存在較大差異;(3)樣品采集的局限性,如樣品量、動物的年齡、用藥習慣、樣品保存條件等,導致大腸埃希菌遺傳背景多樣化,導致的耐藥基因檢出率與耐藥率不符。
懷化地區中小型規模養豬場的大腸埃希菌對紅霉素、復方新諾明和青霉素耐藥嚴重,磺胺類藥物的耐藥基因Sul2檢出率為86.05%。建議本地區養殖戶對致病性大腸埃希菌所引發的疾病進行防治時應首選氟喹諾酮類、氨基糖苷類藥物。

