腹腔鏡肝切除在肝細胞肝癌中的應用價值分析
劉雙池,談 燚,龐 青,金 浩,范龍飛,段家康
在我國,肝細胞肝癌(hepatocellular carcinoma,HCC)是最常見的肝臟原發性惡性腫瘤,因其轉移性強、惡性程度高,導致病死率較高[1]。手術是徹底根治HCC的首選。自1991年首例腹腔鏡肝切除術(laparoscopic hepatectomy,LH )的成功實施,LH以其局部創傷小,病人全身炎癥反應輕、術后恢復快等特有優勢深受外科醫生青睞,近年來LH技術在國內外廣泛開展[2-3]。我院自2011年開展此手術,目前已成為肝癌切除的主要術式。本研究對我院2016年6月至2018年6月行LH與開腹肝切除術(open hepatectomy,OH)的病人資料進行比較,探討LH在HCC中的應用價值。現作報道。
1 資料與方法
1.1 一般資料 選擇2016年6月至2018年6月蚌埠醫學院第一附屬醫院收治的169 例原發性HCC病人,術前影像學檢查明確病變部位,確定臨近器官未受侵犯、肝門部淋巴結無轉移、無遠處轉移灶。同時,行血液學腫瘤指標檢測,術前明確診斷為可切除原發性HCC病例,術后病理證實為HCC。術前彩超提示169例原發性HCC病人中122例有不同程度的肝硬化表現,術前肝功能Child評分A級142例,B 級 27例,心肺功能均正常,無明確手術禁忌證。排除標準:(1)腹腔鏡中轉開腹者;(2)存在明確手術禁忌證者;(3)術前肝癌破裂出血不宜行腹腔鏡手術者;(4)術中發現腫瘤侵犯肝門或發生腹膜后淋巴結轉移及出現脈管癌栓者;(5)術后病理證實為轉移性肝癌、良性腫瘤等非原發性HCC病人。按手術方式將病人分為LH組78例和OH組91例,2組病人圍術期一般資料差異均無統計學意義(P>0.05)(見表1),具有可比性。

表1 病人基線資料比較(n)
1.2 手術方法 LH組與OH組均由相對固定級別相同的同組醫生組完成。手術過程均嚴格按照根治性完整切除腫瘤原則,切緣至少保證2 cm。LH組:全麻完畢后,在麻醉師輔助下將病人擺出合適體位,一般為仰臥位,呈“大”字形,扶鏡手站于病人兩腿之間。右后葉肝腫瘤時為方便顯露,常規將病人右季肋區抬高 30°,術中視手術情況合理調整體位。觀察孔常規置于臍下1.0~2.0 cm,穿刺針進入腹腔建立氣腹后拔出,沿穿刺孔置入直徑10 mm Trocar,建立穩定氣腹,壓力維持在 12~14 mmHg。觀察孔置入腹腔鏡探查,依據探查結果及術前影像學檢查,按照利于手術操作的基本原則合理布局Trocar位置,一般以腫瘤為中心呈扇形分布。解剖第一肝門后,常規預置手套橡皮筋阻斷帶,以Hem-o-lock夾夾住阻斷帶兩端,無張力包繞第一肝門,待需要阻斷肝門時,提起阻斷帶用Hem-o-lock夾夾閉,阻斷入肝血流,具體阻斷方式與阻斷時間與開腹手術相同。我中心開展的LH主要有腹腔鏡局部肝切除、肝左外葉切除、左半肝及右半肝切除以及Ⅴ/Ⅷ段解剖性肝切除及尾狀葉腫瘤切除。復雜的半肝切除手術步驟:(1)游離肝臟。超聲刀離斷肝圓韌帶、鐮狀韌帶后視腫瘤具體部位及手術方案游離相應肝臟周圍韌帶。對于含有大血管的肝周韌帶如馬庫奇韌帶應先上Hem-o-lock夾再離斷,對于特殊部位的肝周韌帶應小心分離,如離斷肝腎韌帶時應避免損傷黏連的腸管及腎上腺組織。(2)解剖肝門。對于第一肝門而言,降低肝門板后,肝外打開Glisson鞘解剖出肝動脈、門靜脈分支。左半肝切除時可沿肝圓韌帶根部左側解剖 Glisson 鞘,第一支動脈一般為左肝動脈,對于右半肝切除,常規切除膽囊,沿膽總管右側解剖Glisson鞘,尋膽囊動脈可順利解剖右肝動脈,對于深部的右肝管常不做處理;在分離門靜脈右支時,注意勿撕脫門短靜脈,可先予以結扎[3]。處理第二肝門時,如肝左、右靜脈易于解剖,則小心分離后予以阻斷,可以減少出肝血流反滲,更好的控制出血。如右肝靜脈隱窩等解剖困難則在離斷肝實質至第二肝門時以血管切割閉合器在肝內切斷肝左、右靜脈。(3)離斷肝實質。用電鉤沿肝缺血線燙出預切線,超聲刀沿預切線快速離斷肝表面乏血區,采用“小步快走、單臂震蕩”的方式進一步解剖肝內管道、離斷肝實質。小的肝靜脈分支可以用超聲刀直接離斷,對于直徑大于3 mm的血管,應先用超聲刀裸化,鈦夾或小Hem-o-lock夾夾閉兩端后再予離斷。而對于較粗大的肝靜脈可先結扎兩端后離斷或用直線型切割閉合器直接離斷。(4)標本取出與肝斷面處理。用一次性取物袋裝好標本后從橫向延長的觀察孔切口取出[4]。充分沖洗肝斷面,明確無活動性出血后覆蓋止血材料,放置引流管。OH組開腹手術大致步驟:取上腹部正中切口或向右L型切口,逐層入腹,充分游離肝臟后,沿腫瘤外緣2 cm切開肝臟實質(局部肝腫瘤切除),或離斷左/右肝臟入肝血流后沿缺血線切除左/右半肝(半肝切除),第二肝門解剖及切肝過程中大血管的處理策略與LH組相同。手術過程中可視情況選擇阻斷第一肝門,具體阻斷方法同LH組。
1.3 觀察指標 記錄腫瘤直徑、腫瘤數量、術前肝功能、炎性及腫瘤標志物水平、手術時間、術中出血量、術后鎮痛藥使用率和術后3、7、30 d肝功能、術后并發癥發生率、術后住院時間及住院費用、術后2年腫瘤復發率。
1.4 統計學方法 采用t檢驗和χ2檢驗。
2 結果
2.1 2組病人手術相關資料的比較 2組病人手術方式差異無統計學意義(P>0.05)。LH組與OH組相比,手術時間較長,但術中出血明顯減少(P<0.05和P<0.01)(見表2)。
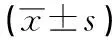
表2 2組病人手術相關資料
2.2 2組病人術后一般情況 LH組術后鎮痛藥使用率明顯低于OH組(P<0.01),住院時間明顯短于OH組(P<0.01)。2組住院費用、術后總體并發癥發生及術后2年內腫瘤復發率(影像學、介入造影檢查評估有無復發)差異均無統計學意義(P>0.05)(見表3)。

表3 2組病人術后一般情況比較[n;百分率(%)]
2.3 2組病人術后血清學指標比較 LH組術后3、7 d外周血ALB水平均高于OH組(P<0.01),術后3、7、30 d外周血ALT、AST水平均低于OH組(P<0.01)。2組術后不同時間TBIL水平及術后1個月ALB水平差異均無統計學意義(P>0.05)。
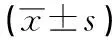
表4 2組病人術后血清中血指標變化情況比較
3 討論
近年來,雖然介入技術及靶向藥物[5]在HCC的治療上得到廣泛應用,但手術切除仍是治療HCC的首選方法。隨著腹腔鏡技術快速發展,LH不再僅適用于質地良好的肝臟良性病變或轉移性腫瘤,而是逐漸成為肝切除的常規術式[6]。KIM等[7]認為,與開腹手術相比,LH在治療左HCC時能夠獲得與開腹相同的腫瘤學治療效果。CHO等[8]研究表明,腹腔鏡下肝切除對于大體積肝切除而言也是行之有效的。金浩等[3]對腹腔鏡下肝外Glisson鞘內解剖的肝切除方式研究發現,LH用于肝葉及半肝的切除是安全可行的。
本研究中在術前相關資料無明確統計學差異的情況下,LH組平均手術時間較OH組長,可能與我中心腹腔鏡開展較晚及缺乏先進的腹腔鏡器械有關。徐繼威等[9]研究表明,腹腔鏡與開腹肝切除手術時間并無差異。LH組能夠有效降低術中出血量。氣腹建立后,手術操作空間及可視范圍較開腹組大,術野的充分暴露減少了對粗大肝靜脈(如肝短靜脈、中肝靜脈)的損傷[10],大出血發生率下降。同時,腹腔鏡的放大效應使得在斷肝過程中細小的靜脈及膽管容易被發現,肝創面滲血能夠得到及時處理。LH組與OH組在住院費用上無明確差別,而LH組病人平均術后住院時間縮短,較OH組存在顯著優勢。同時,與OH組相比,LH組出現術后ALB降低的風險更低。在我國,HCC病人多繼發于肝炎后肝硬化,常伴有肝臟合成與分泌功能降低,肝部分切除后肝臟合成白蛋白能力可能進一步下降,導致術后嚴重的低蛋白血癥,增加全身炎癥反應綜合征及其他術后并發癥的發生率[11-12]。LH組因腹壁損傷較小,在同樣應用鎮痛泵的前提下,病人術后痛感減輕,使得抗炎鎮痛藥物的使用率明顯減少,進一步弱化了術后對胃腸功能的影響,更加符合現代外科快速康復理念。2組病人術后總體并發癥發生率及術后2年內腫瘤復發率無統計學差異,這可能與樣本量較少及隨訪時間短有關。本研究還發現,LH組術后短期ALT、AST升高的最大值較OH組低,且能更快地恢復到接近術前正常水平,而術后3、7 d ALB水平明顯較高,對降低病人術后并發癥發生及死亡風險有著重要預防作用[13-14]。
結合國內外經驗,LH治療HCC是安全可行的[3,7-8]。對于復雜的肝臟切除,術前可行肝臟三維重建,在充分評估腫瘤毗鄰解剖關系及殘肝剩余體積的基礎上,有助于制定個性化的手術方案,降低術中出血及中轉開腹率,縮短手術時間[15]。控制術中出血是腹腔鏡肝切除的關鍵部分,我中心采用的肝外 Glisson 鞘內解剖的肝切除方式阻斷入肝血流,既能做到安全有效,又節省手術時間[3]。在阻斷入肝血流的同時,限制輸液速度降低中心靜脈壓可有效控制肝靜脈出血[16]。對于LH初學者而言,應在熟練掌握腹腔鏡器械使用技巧及肝臟解剖關系的基礎上,逐步增加手術難度,先做肝臟淺表腫瘤的局部切除,逐步過渡到半肝切除以及Ⅴ、Ⅶ、Ⅷ段等特殊部位肝切除。
綜上所述,采用腹腔鏡下肝切除治療HCC不僅能減少術中出血,還能在有效切除肝腫瘤的基礎上減輕術中損傷,促進病人術后快速恢復,減少術后住院時間,值得全面推廣。雖然腹腔鏡手術治療HCC有著獨特優勢,但如何在基層醫院順利開展還需進一步摸索。

