北京市昌平區耐多藥結核分枝桿菌對新抗結核藥品的耐藥情況分析
劉新宇 張倩 孫倩
耐多藥結核病(multidrug-resistant tuberculosis,MDR-TB)及廣泛耐藥結核病(extensively drug-resistant tuberculosis,XDR-TB)是我國結核病疫情控制的主要障礙,加劇了對我國公共衛生的威脅。因此,迫切需要改進現有的治療方案和開發新的抗結核藥品。基于有效性與安全性,世界衛生組織于2018年發布了新的MDR-TB治療指南,將藥物重新歸為三類[1]。但關于這幾種藥物在北京市昌平區MDR-TB患者中的耐藥特點仍然未知。本研究通過分析A組藥品中的左氧氟沙星(levofloxacin,Lfx)、莫西沙星(moxifloxacin,Mfx)、貝達喹啉(bedaquiline,Bdq)和利奈唑胺(linezolid,Lzd),B組藥品中的氯法齊明(clofazimine,Cfz),以及C組藥品中的德拉馬尼(delamanid,Dlm)對MDR-TB臨床分離株的體外抑菌活性,初步了解北京市昌平區耐多藥結核分枝桿菌菌株對這幾種藥品的敏感性和耐藥突變類型,為藥品的臨床應用提供實驗室依據。
材料和方法
一、研究材料
2011—2015年北京市昌平區結核病防治所從收治的結核病患者痰標本中分離培養及菌種鑒定后共獲得1099株結核分枝桿菌臨床分離株,收集其中耐多藥結核分枝桿菌(83株,占7.6%)作為研究資料。結核分枝桿菌標準株H37Rv(ATCC27294)由國家結核病參比實驗室提供。
二、研究方法
1. 最小抑菌濃度(minimum inhibitory concentrations,MIC)藥物敏感性(簡稱“藥敏”)檢測:對耐多藥結核分枝桿菌按照文獻[2]的標準進行Lfx、Mfx、Lzd、Bdq、Cfz和Dlm的MIC檢測。每種藥品的臨界濃度見表1[3-5]。
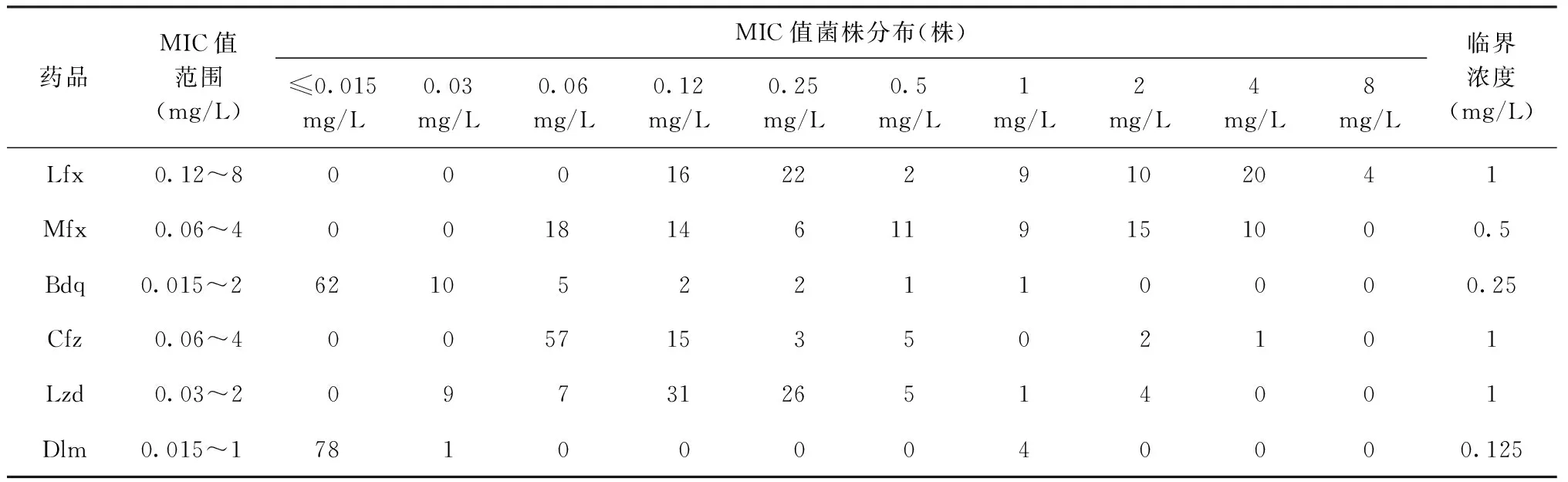
表1 藥物最小抑菌濃度范圍和臨界濃度
2. DNA提取和耐藥基因檢測:將結核分枝桿菌臨床分離株接種于L-J培養基,37 ℃培養4~8周,至有菌落生長后,取一接種環菌于400 μl TE緩沖液(pH 值為8.3)中懸菌,100 ℃煮沸15 min,在8 cm離心半徑下以12 000 r/min離心10 min,取上清-20 ℃保存備用[6]。耐藥基因用相應的引物進行擴增(表2)。25 μl反應體系:包括2×PCR TaqSuperMix預混液12.5 μl、引物(10 mol/L)各 0.5 μl,模板5 μl,去離子水6.5 μl。PCR 擴增條件:94 ℃ 變性 5 min;94 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min,共 35個循環,72 ℃再延伸 10 min。PCR陽性產物測序均委托北京擎科生物有限公司完成。采用Bioedite軟件將耐藥基因測序結果與標準株進行比對分析。

表2 擴增和測序引物序列
三、統計學處理
采用 Excel 2010錄入數據,通過 Backlink程序轉換為Whonet文件,導入 Whonet 5.6軟件,采用數值比例法對耐藥數據進行分析。
結 果
一、耐多藥結核分枝桿菌菌株耐藥特征
83株耐多藥結核分枝桿菌對不同藥品的耐藥情況見表3。耐多藥結核分枝桿菌對Lfx和Mfx的耐藥率最高,均為41.0%;其中,39株對Lfx或Mfx耐藥,29株對Lfx和Mfx交叉耐藥。耐多藥結核分枝桿菌對Bdq的耐藥率最低,為2.4%。對Cfz的耐藥率為3.6%;3株Cfz耐藥菌株中有2株對Bdq耐藥。

表3 83株耐多藥結核分枝桿菌對不同藥品的耐藥情況
二、耐多藥結核分枝桿菌耐藥基因突變情況
1. 氟喹諾酮類藥品耐藥基因突變:39株對Lfx或Mfx耐藥的菌株中,gyrA基因的第94位密碼子的堿基替換是最常見的突變類型,占87.2%(34/39);其中13株(33.3%,13/39)突變類型為Asp94Gly,11株(28.2%,11/39)突變類型為Asp94Tyr,6株(15.4%,6/39)突變類型為Asp94Ala,4株(10.3%,4/39)突變類型為Asp94Asn;第90位密碼子的Ala90Val為第二常見的突變類型。所有耐藥菌株均在gyrA基因的第95位密碼子存在Ser95Thr突變類型,但Ser95Thr突變與耐藥無關。在gyrB基因中未發現非同義突變。見表4。

表4 耐藥菌株的耐藥基因突變類型
2. 其他藥品耐藥基因突變:3株Cfz耐藥菌株在rv1979c基因中均未發現突變。在Bdq耐藥菌株中也未發現atpE基因突變。2株Cfz-Bdq交叉耐藥菌株均在Rv0678基因中存在突變,1株突變類型為Gln31Arg,另一株突變類型為Ser53Pro。在4株 Lzd耐藥菌株中,有2株在rplC基因中存在突變,突變類型為Cys154Arg,而在23SrRNA基因和rplD基因中均未發現突變。在4株Dlm耐藥菌株中,1株突變發生在fbiC基因的第318位密碼子,2株突變發生在ddn基因的第81位密碼子,而在fbiA、fbiB和fgd1基因中均未發現突變。
討 論
目前,MDR-TB已成為阻止全球結核病控制的一大障礙。根據世界衛生組織發布的MDR-TB治療方案,筆者分析了A、B和C組常用藥品的耐藥特點,并闡明了這些耐藥菌株的遺傳突變特征,為臨床用藥提供指導意義。
本研究結果顯示,北京市昌平區耐多藥結核分枝桿菌對Lfx和Mfx耐藥率均為41.0%。來自中國東部地區的一項研究表明,耐多藥結核分枝桿菌對氟喹諾酮類藥品的耐藥率為37%[7]。中國南方地區的一項研究發現,結核分枝桿菌對Lfx和Mfx的耐藥率分別為76%和73%[8]。另一份來自上海的報告顯示,在耐氟喹諾酮類藥品的結核分枝桿菌中,44%為耐多藥結核分枝桿菌[9]。我國氟喹諾酮類藥品的耐藥率高,可能是由于患者在治療未確診的細菌感染時存在過度使用,表明在臨床實踐中需要采取迫切行動來控制氟喹諾酮類藥品的濫用。Mokrousov等[10]的研究顯示,87.2%的氟喹諾酮類藥品耐藥菌株在gyrA基因的耐藥決定區存在突變,其中第94位密碼子是最常見的突變位點,但未發現gyrB基因突變。第94位密碼子的突變頻率(87.2%)與俄羅斯報道的83%相似,但高于中國香港的75%[11]和盧旺達的75%[12],表明gyrA基因的耐藥決定區突變是導致北京市昌平區結核分枝桿菌耐氟喹諾酮類藥品的關鍵因素。
本研究中,95%以上的耐多藥結核分枝桿菌對Bdq和Cfz敏感。盡管目前這兩種藥品是MDR-TB治療方案的組成部分,但研究發現Rv0678基因突變能夠促進外排泵MmpS5-MmpL5過表達,導致這兩種藥品出現交叉耐藥[13],與文獻[14]的研究結果一致。本研究的數據表明,3株Cfz耐藥菌株中有2株存在Rv0678基因突變,且對Bdq存在交叉耐藥。而在無Rv0678基因突變的Cfz耐藥菌株中,未發現Rv1979c基因突變。因此,需要通過鑒定新的突變位點來增強對Cfz耐藥機制的深入了解。雖然孫晴等[14]的研究表明,atpE基因突變與Bdq耐藥有關,但在本研究中未發現atpE基因突變,其他的機制可能參與Bdq耐藥。
Lzd可有效治療MDR-TB,根據以往的研究表明,rplC基因的T460C突變是Lzd耐藥菌株中最常見的突變類型[15]。本研究中,50%的MDR-TB臨床分離株中存在rplC基因突變,這與之前報道的一致。此外,Schena等[5]研究表明,ddn、fgd1、fbiA、fbiB和fbiC任一基因的多態性均可導致Dlm體外耐藥。其中,ddn基因編碼一種依賴于F420的分枝桿菌硝基還原酶,與前藥激活有關[14]。最近一項研究表明,10株耐多藥結核分枝桿菌菌株中有5株在ddn基因中存在突變[16]。而在本研究中共鑒定了2株含有ddn基因突變的耐多藥結核分枝桿菌。FbiC基因作為輔酶F420生物合成途徑的重要成員[17],也參與了Dlm的耐藥。在本研究中,3株 Dlm耐藥菌株中,有1株在FbiC基因中存在突變,表明FbiC基因突變是導致Dlm耐藥的重要因素。
綜上所述,北京市昌平區耐多藥結核分枝桿菌對氟喹諾酮類藥品耐藥率較高,而對Bdq、Lzd、Dlm和Cfz表現出較好的敏感性。研究結果可為MDR-TB患者選藥時進行參考,為北京市昌平區應用新型抗結核藥品治療MDR-TB提供理論依據。

