應用CRISPR/Cas9技術敲除SERPINF2基因對牛病毒性腹瀉病毒復制的影響
付強 陳俊貞 郭妍婷 姚剛 冉多良 史慧君
(新疆農業大學動物醫學學院,烏魯木齊 830052)
牛病毒性腹瀉病毒(Bovine viral diarrhea virus,BVDV)是引起牛病毒性腹瀉/黏膜病(Bovine viral diarrhea/mucosal disease,BVD/MD)的主要病原[1],主要感染牛、羊和駝科動物,感染后常呈現體溫升高、腹瀉、黏膜充血及蹄葉炎等臨床癥狀[2]。此外,BVDV還會引起母牛流產、死胎及牛群持續性感染,給牛群健康管理造成危害[3]。BVDV可通過血液、排泄物等途徑水平傳播,感染BVDV的牛發病率高、病死率低;還可以通過懷孕母牛垂直傳播,感染孕牛產下的犢牛終身帶毒,持續排毒,是重要傳染源,同時也是生物制品、凍精、血清等主要污染源,BVDV是反芻動物最嚴重的病原體之一,會對養牛業造成嚴重的經濟損失,危害極大[4]。探明該病毒胞內復制的關鍵因子途徑將為BVD的診斷和防控提供理論依據[5]。
α2抗纖溶酶(serpin peptidase inhibitor clade F member 2,SERPINF2)是編碼絲氨酸蛋白抑制劑SERPINF2家族的一員[6]。這個分子在1969年由Aoki等[7]發現,其主要的功能是能夠有效抑制纖溶過程,1976年Moroi和Aoki[8]從人血漿中成功分離并鑒定了這個纖溶抑制劑。因為它能夠迅速抑制纖溶酶活性并且免疫電泳遷移速度與α2球蛋白相當,因此命名為 α2-plasmin inhibitor[9]。
本課題組前期使用BVDV TC株感染Cajal間質細胞(interstitial cells of Cajal,ICC)建立轉錄組差異表達譜,發現SERPINF2基因表達量顯著性上調[10],該基因是否是BVDV胞內復制的關鍵因子,對BVDV的胞內復制有何影響尚未見研究。本研究應用CRISPR/Cas9基因編輯技術敲除SERPINF2基因,研究SERPINF2基因對BVDV復制的影響。
1 材料與方法
1.1 材料
1.1.1 病毒、質粒及細胞 BVDV新疆分離株TC由新疆農業大學傳染病實驗室冉多良教授惠贈[11];pSPAX2(12260)、pMD2.G(12259)、lentiCRISPR v2(53961)質粒購自美國Addgene;MDBK細胞和HEK-293T細胞購自中國科學院典型培養物保藏委員會細胞庫;大腸桿菌Stbl3感受態細胞購自北京博邁德基因技術有限公司。
1.1.2 試劑和儀器 聚乙烯亞胺(polyethylenimine,PEI)購 自 美 國 Polysciences公 司;TRIzol購 自Ambion公司;BsmB I、和T4 DNA Ligase購自New England Biolabs公 司;聚 凝 胺(TR-1003)購 自Sigma公司 ;Endofree Plasmid Miniprep Kit(PD1212)購自BIOMIGA公司;高糖DMEM、胎牛血清FBS、山羊血清和0.25% Trypsin-EDTA購自BI公司;PrimeScriptTMRT Master Mix(Perfect Real Time)試劑盒(RR036A)購自TaKaRa公司;嘌呤霉素購自上海碧云天生物技術有限公司;Marker Ⅰ(MD101)、PCR MIX、D2000 DNA Marker(MD114)、SuperReal PreMix Plus(SYBR Green)、細胞基因組DNA提取試劑盒、普通瓊脂糖凝膠DNA回收試劑盒(DP210)購自天根生化科技(北京)有限公司;常規的化學試劑購自上海生工生物工程股份有限公司;ABI 7500 Fast Real-Time PCR System購自美國ABI公司;倒置熒光顯微鏡(Nikon TE2000U)購自Nikon公司。
1.2 方法
1.2.1 sgRNA序列設計、合成 根據GenBank數據庫中SERPINF2(登錄號:282522)基因序列用Benchling(https://benchling.com)設計,由蘇州金唯智生物科技有限公司合成,序列見表1。分別取10 μL sgRNA正、反單鏈(100 μmol/L),混勻后置于37℃孵育30 min,95℃孵育5 min,以5℃/min速度降溫至25℃,置于-20℃保存。
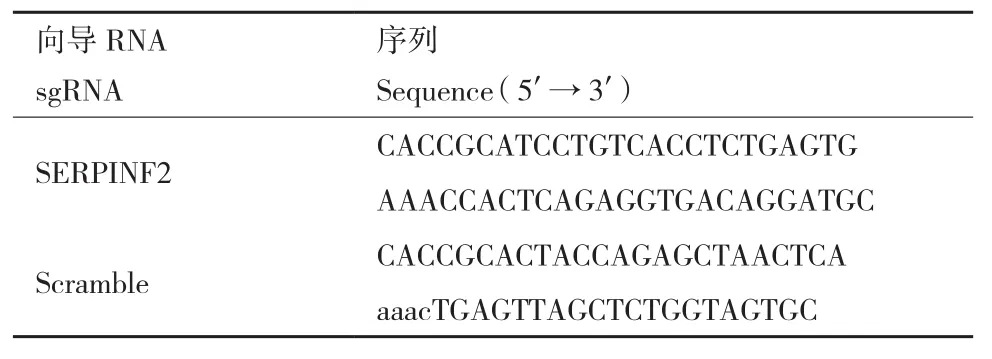
表1 sgRNA序列Table 1 SgRNA sequences
1.2.2 lentiCRISPR v2-SERPINF2-sgRNA質 粒 構建 用BsmB I限制性內切酶酶切lentiCRISPR v2質粒后,用1% DNA凝膠電泳檢測結果。該質粒酶切后會得到兩條不同大小的DNA片段,將12 988 bp大小的目的條帶用TIANGEN普通瓊脂糖凝膠DNA回收試劑盒回收。將回收產物和sgRNA雙鏈用T4 DNA連接酶4℃過夜連接,連接產物轉化至Stbl3感受態細胞中,涂板后培養過夜,次日挑取單克隆菌落,PCR和測序鑒定。
1.2.3 SERPINF2 KO細胞建立 六孔細胞培養板每孔用500 μL的0.1%明膠包被30 min后棄明膠,接種5×105個HEK-293T細胞,置于細胞培養箱中培養。待細胞密度達到80%時,分別取3 μg lentiCRISPR v2-SERPINF2-sgRNA 質粒、3 μg pSPAX2質粒和 1.5 μg PMD2.G 質粒與 38.5 μL PEI(1 mg/mL)混勻,轉移至細胞培養液中。孵育3 h后更換正常細胞培養液,置于細胞培養箱中繼續培養48 h,收集培養液1 500 r/min離心5 min,收集上清液懸浮感染MDBK細胞,同時加入聚凝胺(8 μg/mL)增加感染效率。感染24 h后更換新鮮細胞培養液,繼續培養48 h后加入嘌呤霉素(4 μg/mL)篩選4代獲得陽性細胞。
1.2.4 SERPINF2敲除效率檢測 收集SERPINF2 KO細胞,使用基因組DNA提取試劑盒提取細胞基因組DNA,通過PCR擴增目的片段,將目的片段回收后連接到pMD18-simple T載體上,轉化至大腸桿菌Stbl3感受態細胞中,單克隆菌落經PCR后,隨機挑選30個單克隆菌落送至蘇州金唯智生物科技有限公司進行測序。PCR擴增所用引物序列為F :5′-AGTACAGGGGCTTTGAAGGAAATCT-3′,R :5′-TCCAGTCCAAAAGAGACACTGGAAC-3′。
1.2.5 qRT-PCR檢測SERPINF2基因和BVDV RNA水平 將MDBK細胞按照5×105個細胞/孔接種至6孔細胞培養板中,待細胞匯合度達到70%時,加入1 000 TCID50BVDV感染細胞,分別于感染后36 h、48 h時,收集細胞和培養液并加入TRIzol裂解液裂解,提取總RNA,反轉錄1 μg總RNA成cDNA;以cDNA為模板,使用qRT-PCR檢測SERPINF2 mRNA水平[10]。
分別接種等量的SERPINF2 KO細胞和對照組Scramble細胞并感染1 000 TCID50的BVDV,分別于感染后0、12、24、36、48 h時,收集細胞和培養液并提取總RNA,反轉錄1 μg總RNA成cDNA,同上采用 qRT-PCR 檢測 BVDV 5′UTR RNA 水平[12]。
1.2.6 免疫熒光染色檢測BVDV雙鏈RNA含量 將SERPINF2 KO和Scramble細胞按照5×104個/孔的密度接種至鋪有爬片的24孔細胞培養板中,待細胞密度達到80%時,用1 000 TCID50BVDV分別感染12、24、36、48 h后棄掉培養液,加200 μL 4%多聚甲醛室溫下固定15 min,加入200 μL封閉液(1%山羊血清+3% BSA+1% Triton X-100,溶于PBS)室溫下孵育1 h,加入J2 anti-dsRNA IgG2a單克隆抗體(1∶1 200稀釋)4℃孵育過夜。加入Cy3標記山羊抗鼠IgG(H+L)二抗(1∶200稀釋)避光室溫孵育1 h,封片在激光共聚焦顯微鏡下觀察熒光情況。
1.2.7 BVDV CPE情況和病毒滴度檢測 將SERPINF2 KO細胞和對照Scramble細胞按照1×106個細胞/孔的密度接種至6孔細胞培養板中培養;待細胞貼壁后,加入1 000 TCID50BVDV感染細胞,分別于感染后12、24、36和48 h時,使用倒置顯微鏡觀察CPE情況;并將細胞和培養液反復凍融3次,收集病毒懸液至1.5 mL離心管,1 000 r/min離心10 min收集上清液,使用Reed-Muench方法測定各上清液病毒滴度[12]。
1.2.8 統計分析 使用SPSS 17.0 for Windows(SPSS Inc.Chicago,IL,USA)進行統計學分析。*表示通過t檢驗確定的統計學顯著性差異(*P <0.05;**P<0.01)。
2 結果
2.1 lentiCRISPR v2質粒酶切菌液PCR鑒定結果
使用限制性內切酶BsmB I酶切lentiCRISPR v2載體,用1%瓊脂糖凝膠電泳檢測到兩條清晰的條帶,其中小片段大小約2 000 bp,與預期結果一致(圖1)。
2.2 SERPINF2基因敲除效率檢測
應用CRISPR/Cas9技術敲除SERPINF2基因,收集部分細胞,通過PCR擴增目的片段,克隆至pMD18-simple T載體中,隨機送樣測序檢測SERPINF2基因敲除效率。結果顯示,測序成功的27株陽性克隆中有19株基因序列發生缺失(-)和插入(+)等移碼突變,共有70.37%(19/27)樣本的基因發生改變(圖2),表明MDBK細胞的SERPINF2基因敲除率為70.37%。
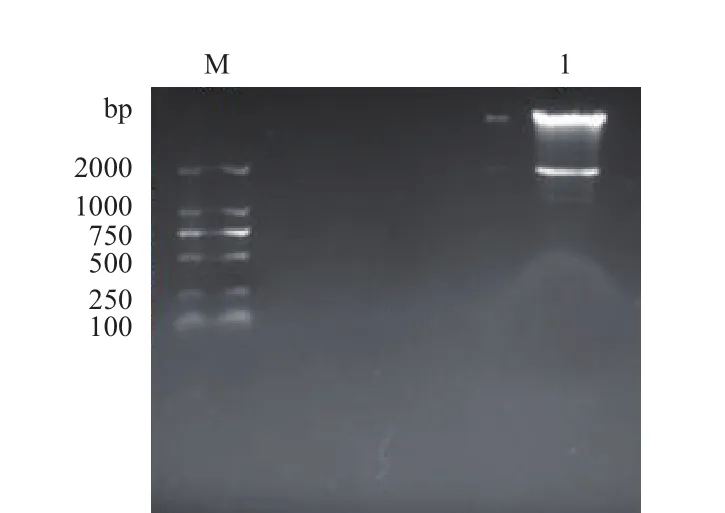
圖1 lentiCRISPR v2質粒酶切鑒定結果Fig.1 Identification of lentiCRISPR V2 plasmid by enzyme digestion

WT:野生型;-:堿基缺失;+:堿基插入;數字:堿基個數;(數字):缺失或插入等突變的克隆數WT:wild type, -:base deletion, +:base insertion, Number:base number, (Number):Clone number of mutation such as deletion or insertion
2.3 qRT-PCR檢測SERPINF2 mRNA轉錄水平
為檢測BVDV感染SERPINF2表達的影響,對BVDV感染MDBK細胞36和48 h后,使用qRTPCR檢測SERPINF2 mRNA轉錄水平。結果發現,與未感染BVDV相比,BVDV感染36 h和48 h時SERPINF2 mRNA轉錄水平分別提高約3.19和12.46倍(圖3),表明BVDV感染MDBK細胞顯著性提高SERPINF2 mRNA轉錄水平。
2.4 qRT-PCR檢測BVDV感染SERPINF2 KO細胞后BVDV RNA水平
BVDV感染SERPINF2 KO細胞和對照組Scramble細胞12、24、36、48 h后,提取總RNA,qRT-PCR檢測BVDV 5′UTR RNA水平。結果顯示與對照組Scramble細胞相比,BVDV感染SERPINF2 KO細胞12 h后BVDV RNA水平顯著降低(圖4)。
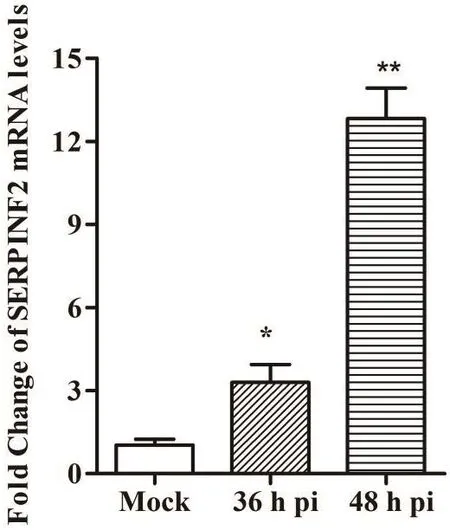
圖3 qRT-PCR檢測BVDV感染MDBK細胞后SERPINF2 mRNA轉錄水平Fig.3 Transcription levels of SERPINF2 mRNA in the MDBK cells infected by BVDV via qRT-PCR
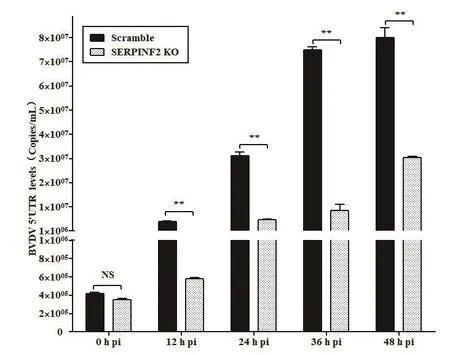
圖4 qRT-PCR檢測BVDV感染SERPINF2 KO細胞后BVDV RNA水平Fig.4 qRT-PCR detection of BVDV RNA level in the SERPINF2 KO cells infected with BVDV
2.5 免疫熒光染色檢測BVDV感染SERPINF2 KO細胞后BVDV dsRNA含量
BVDV感染SERPINF2 KO細胞和對照組Scramble細胞12、24、36、48 h,用免疫熒光染色后觀察細胞內BVDV sgRNA的分布情況,激光共聚焦顯微鏡下BVDV dsRNA呈紅色熒光,結果可見SERPINF2 KO細胞中紅色熒光顯著少于對照組Scramble細胞(圖5),表明BVDV dsRNA含量降低,BVDV的復制被阻止。
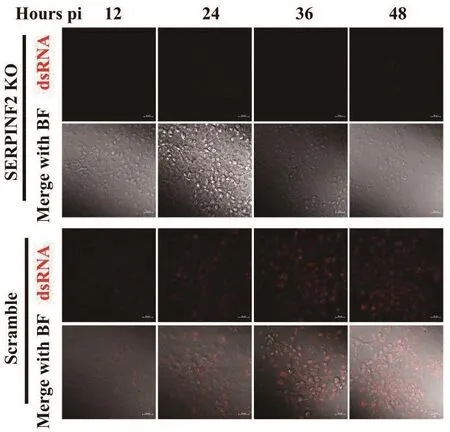
圖5 免疫熒光染色檢測BVDV感染SERPINF2 KO細胞后BVDV雙鏈RNA含量結果Fig.5 Detection of BVDV dsRNA accumulation in the SERPINF2 KO cells infected with BVDV by immunofluorescence staining
2.6 BVDV感染SERPINF2 KO細胞后病毒滴度檢測
BVDV感染SERPINF2 KO細胞和對照組Scramble細胞12、24、36、48 h,反復凍融后收集病毒懸液,使用Reed-Muench法測定病毒滴度變化。結果顯示BVDV感染SERPINF2 KO細胞12 h后的病毒滴度與對照組Scramble細胞相比顯著性降低(圖6)。結果表明敲除SERPINF2基因能夠顯著性阻止BVDV復制。
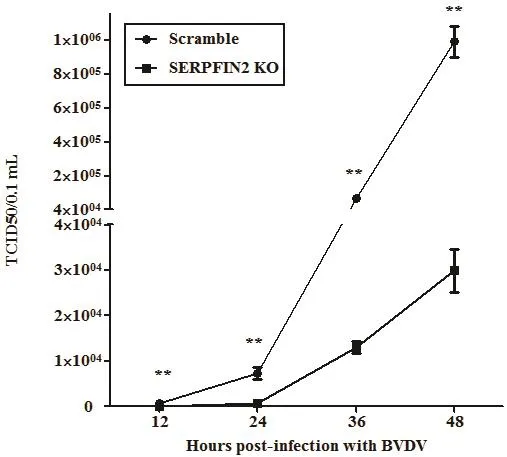
圖6 BVDV感染SERPINF2 KO細胞后病毒滴度檢測結果Fig.6 Detection results of virus titer in the SERPINF2 KO cells infected with BVDV
2.7 BVDV感染SERPINF2 KO細胞后CPE檢測結果
BVDV感染SERPINF2 KO細胞和對照Scramble細胞12、24、36、48 h后,在倒置顯微鏡下觀察細胞CPE情況。結果顯示BVDV感染SERPINF2 KO細胞24 h后CPE明顯少于對照組,BVDV感染36 h后對照組Scramble細胞大量病變脫落,SERPINF2 KO細胞雖出現較多病變,但細胞脫落情況較少(圖7)。表明敲除SERPINF2基因能夠抑制BVDV感染造成的細胞CPE。
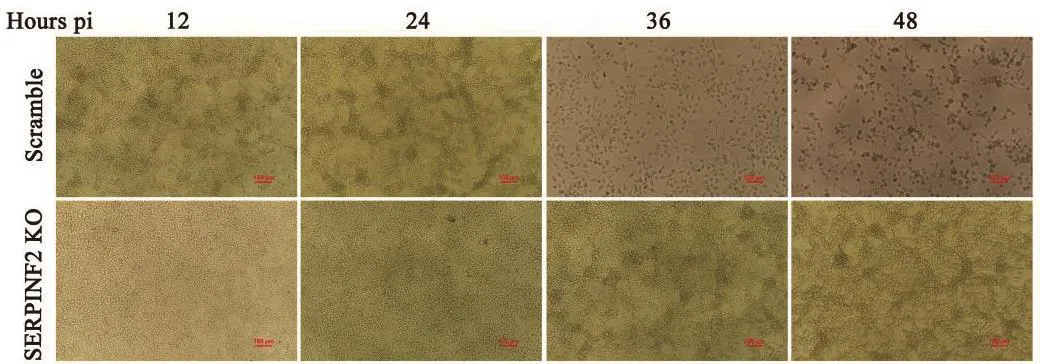
圖7 BVDV感染SERPINF2 KO細胞后致細胞病變效應檢測結果Fig.7 Detection results of cytopathic effect in the SERPINF2 KO cells infected with BVDV
3 討論
利用CRISPR/Cas9基因編輯技術敲除靶基因,選擇靶基因的識別序列(sgRNA識別序列)是關鍵。目標基因的識別序列一般是在前間區序列鄰近基序(protospacer adjacent motif,PAM)三聯核昔酸結構(NGG或者NAG,N代表任何堿基)前的20個左右的DNA堿基序列[13]。為了實現對SERPINF2基因的敲除,原則上可以將目標序列設計在SERPINF2基因啟動子或外顯子區域,進行敲除對SERPINF2基因目標序列進行切割并經HDR修復時引入突變。理論上可行的sgRNA識別片段不一定能最終實現基因的敲除,所以本實驗嘗試性設計了3個符合條件的SERPINF2基因的sgRNA識別序列,進而實現對SERPINF2基因的有效敲除。最終成功敲除MDBK細胞的SERPINF2基因,敲除效率為70.37%。為研究SERPINF2基因對BVDV的胞內復制的影響及作用機制奠定基礎。
SERPINF2是SERPIN超家族的重要成員,其主要作用是通過抑制plasmin活性參與抗溶血,阻礙細胞因子生成、血管發生等生物學過程[14]。有病歷研究發現,SERPINF2突變會造成胞內轉運異常和功能障礙[15]。BVDV TC株感染ICC細胞轉錄組差異性分析發現,SERPINF2基因表達量顯著性上調[10],感染MDBK細胞也得到同樣的結果,考慮SERPINF2敲除會引起胞內轉運異常和功能障礙,從而影響BVDV的胞內轉錄復制。
本研究發現BVDV感染MDBK細胞后SERPINF2基因表達量上調,與前期建立的BVDV感染宿主細胞建立的轉錄組差異表達譜相一致。利用CRISPR/Cas9基因編輯技術建立SERPINF2敲除的MDBK細胞SERPINF2 KO,并驗證敲除SERPINF2基因能夠顯著性降低BVDV RNA水平、dsRNA積累,降低CPE情況和病毒滴度,表明SERPINF2敲除影響BVDV在宿主細胞中復制,而該基因通過何種途徑影響BVDV的復制將在后續研究中深入探索。
4 結論
BVDV感染MDBK細胞SERPINF2基因表達量上調;利用CRISPR/Cas9基因編輯技術成功建立SERPINF2 KO細胞,敲除率為70.37%;SERPINF2基因敲除能夠抑制BVDV在宿主細胞中的復制。