柱狀田頭菇遺傳轉化體系啟動子的篩選
崔祥華 陶南 程波普 趙永昌 陳衛(wèi)民 李靖
(1.西南林業(yè)大學生命科學學院,昆明 650224;2.云南省農業(yè)科學院生物技術與種質資源研究所,昆明 650223)
隨著食用真菌遺傳體系的深入研究與建立,越來越多的啟動子被用于表達體系,尋找適合于不同菌類的啟動子,對于構建高效的表達體系十分必要。目前,研究者對食藥用菌中的多個啟動子進行了克隆和序列分析,如香菇Lentinula edodes和草菇Volvariella volvacea中ras(ras gene)啟動子、香菇和靈芝Ganoderma lucidum中gpd(glyceraldehydes-3-phosphate dehydrogenase)啟動子、雙孢菇Agaricusbisporus中spr1(serine proteinase gene)啟動子、cel1(tryptophan synthetase gene)啟動子和cel3啟動子、香菇 gal1(glu-coamylase gene)啟動子等[1-5]。目前,真菌著力于選擇使用強啟動子和同源啟動子,以增強靶標基因的表達量,而同源啟動子能識別調控因子,降低甲基化頻率,提高其轉化效率[6]。但也存在一些異源啟動子活性較強的現(xiàn)象,如研究者利用蟬棒束孢菌Isaria cicadae內源gpd、tef(translation elongation factor)和組蛋白(histone)H3啟動子分別與來自稻瘟病Magnaporthe grisea的H3和超氧化物歧化酶(Superoxide dismutase)sod基因啟動子進行比較,發(fā)現(xiàn)稻瘟病H3啟動子起始轉錄活性更強[7]。因此,選擇高效、適宜的啟動子對于研究其功能基因過量表達有著重要意義。目前為止,研究者對香菇[8]、雙孢菇[9]、金針菇 Flammulina velutipes[10]、平菇 Pleurotus ostreatus[11]、靈芝[12]等主要食藥用菌都使用gpd啟動子構建遺傳轉化體系,其它啟動子用于表達體系的研究較少。
柱狀田頭菇(Cyclocybe aegerita),又稱茶樹菇[13],是一種溫帶至亞熱帶地區(qū)春秋季生長的廣溫型木腐性食用菌,在國內外有著廣泛的種植。目前為我國的第九大類食用菌種植菌類,當前可開發(fā)的十大珍稀食用菌之一[14]。隨著柱狀田頭菇遺傳發(fā)育及育種研究的深入,需要建立高效穩(wěn)定的遺傳轉化體系,以滿足其遺傳及性狀等方面解析的需要。前期研究中利用PEG介導的原生質體轉化方法,結合熒光蛋白EGFP表達,建立了穩(wěn)定的遺傳轉化體系,為進一步開展柱狀田頭菇的基因功能研究提供了研究手段[15],但未對靶標基因的表達量做定量分析,缺乏對啟動子引導基因表達做綜合分析。
因而本研究利用基因組數(shù)據(jù),分析gpd和actin基因序列特征,分別用不同長度基因片段作為啟動子,與原始載體中的啟動子做比對分析,進而對靶標基因的表達量進行分析,期望篩選到穩(wěn)定高效的啟動子和區(qū)域,為后期柱狀田頭菇基因功能分析提供有力支撐。
1 材料與方法
1.1 材料
供試菌株:柱狀田頭菇菌株YSG,保存于云南省農業(yè)科學院菌種庫。菌絲置于YPD固體培養(yǎng)基(0.2%蛋白胨,0.2%酵母粉,2%葡萄糖,1.5%瓊脂粉,pH自然)中進行培養(yǎng)。質粒pAa含有潮霉素B磷酸轉移酶基因hph與綠色熒光蛋白編碼基因egfp。
高保真聚合酶Phanta Max Super-Fidelity DNA Polymerase、重組克隆試劑盒ClonExpress?Ultra One Step Cloning Kit(南京諾唯贊生物科技有限公司);RNA提取試劑盒Plant RNA Extraction Kit、限制性核酸內切酶(寶生物工程大連有限公司);膠回收試劑盒E.Z.N.A.?Gel Extraction Kit、質粒提取試劑盒Plasmid Mini KitⅠ、DNA提取試劑盒Fungal gDNA Isolation Kit(Omega公司);反轉錄試劑盒FastKing RT Kit(with gDNase)(北京天根生化科技有限公司);感受態(tài)細胞 TreliefTM5αChemically Competent Call(北京擎科生物科技有限公司);溶壁酶(lywallzyme)(廣東碧德生物科技公司);裂解酶(lysing enzyme)、纖維素酶R-10、潮霉素B(Sigma公司);Real-time PCR試劑盒iTaqTMUniversal SYBR Green supermix(美國Bio-Rad公司)。本研究所用引物合成及測序交由北京擎科生物科技有限公司昆明分公司完成。
1.2 方法
1.2.1 表達載體的構建及遺傳轉化 提取柱狀田頭菇菌株YSG的總DNA與RNA,通過反轉錄其RNA得到cDNA。根據(jù)CE Design V1.04設計引物,并在各連接片段的5′端與3′端加6-21 bp同源臂(表1),進行不同類型和長度啟動子的靶標基因擴增。PCR 采用 50 μL 反應體系,包括 1 μL Phanta?Max Super-Fidelity DNA Polymerase,25 μL 2×Phanta?Max Buffer,1 μL dNTP Mix(10 mmol/L each),正向和反向引物(10 μmol/L)各 2 μL,100 ng模板 DNA,用無菌去離子水補齊。PCR擴增體系采用95℃預變性3 min;9 5℃變性 15 s,60℃退火 20 s,72℃延伸 60 s,重復35個循環(huán);72℃終延伸10 min。PCR產物通過1%瓊脂糖凝膠電泳獲得的片段膠回收備用。
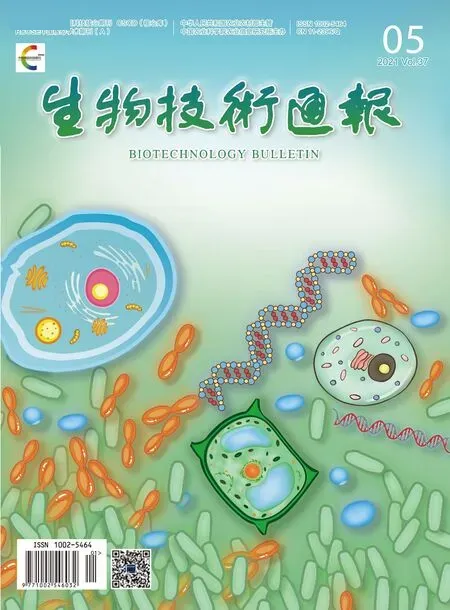
用限制性核酸內切酶Pst I與EcoR V雙酶切質粒pAa,酶切產物通過凝膠純化回收,將其原有的egfp基因及其啟動子替換成啟動子actin-1、gpd-1、actin-2、gpd-2、Pumgpd和靶標基因mek(圖1)。使用ClonExpress DNA多片段無縫克隆技術將啟動子、功能基因片段順序拼接克隆,分別得到重組載體pAa-actin-1、pAa-actin-2、pAa-gpd-1、pAa-gpd-2 和pAa-Pumgpd。
設計通用引物pAa-F/pAa-R擴增5個重組載體的轉化用DNA長片段,PCR產物切膠回收后送交北京擎科生物科技有限公司昆明分公司測序。測序正確的五個重組載體的DNA長片段通過PEG介導的原生質體轉化法轉進菌株YSG的原生質體,通過潮霉素抗性篩選得到轉化子。具體實驗方法同陶南等[15]的實驗方法。提取轉化子DNA,設計驗證引物PM-F/PM-R進行PCR擴增,切膠回收PCR產物送公司測序鑒定出陽性轉化子。
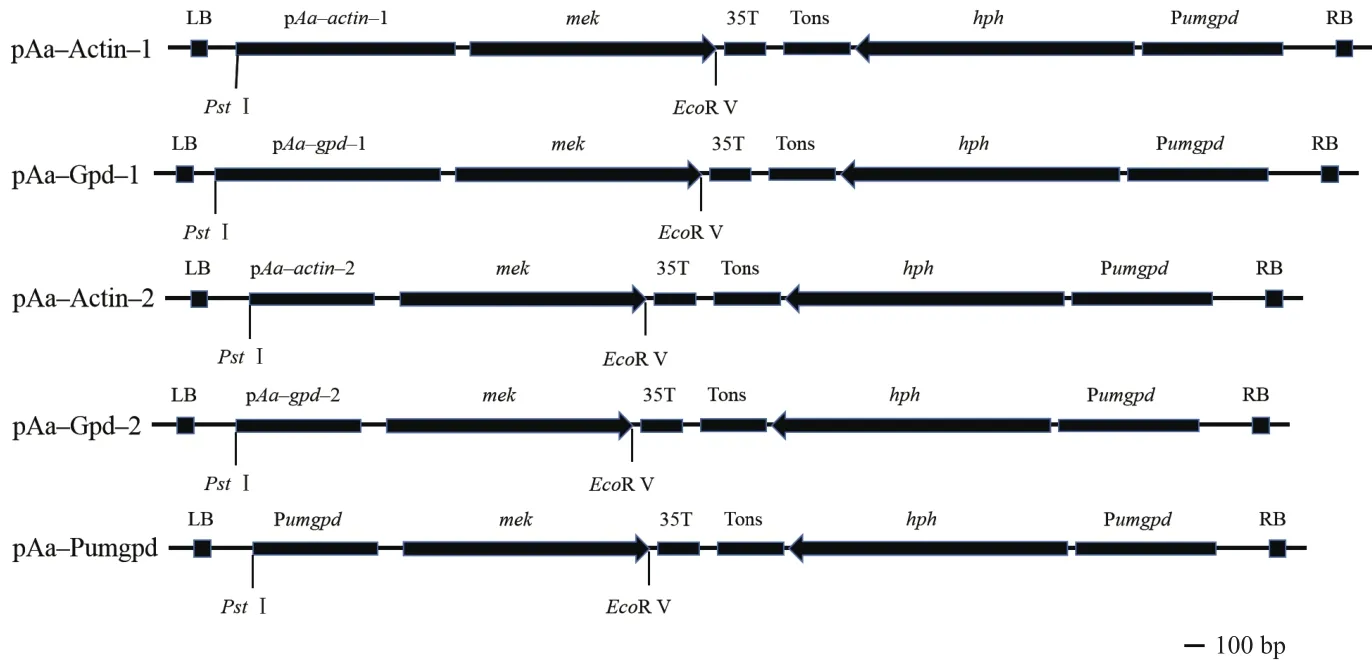
圖1 載體構建示意圖Fig.1 Schematic diagram of plasmid construction
1.2.2 qRT-PCR檢測 提取陽性轉化子的RNA,反轉錄得到其對應的cDNA。選取柱狀田頭菇菌株YSG中的gpd基因作為內參,應用DNAMAN設計熒 光 定 量 PCR引 物:qMek-F、qMek-R、qgpd-F、qgpd-R(表1)。采用 20 μL 反應體系 :10 μL iTaqTMUniversal SYBR?Green supermix(2×),1 μL正向引物,1 μL反向引物,8 μL ddH2O。反應條件為:95℃預變性30 s,95℃變性5 s,60℃退火30 s,72℃延伸30 s,40個循環(huán),每個樣品設置3個重復。
2 結果
2.1 啟動子與靶標基因mek片段的獲得
擴增出的5個啟動子片段長度分別為1 055 bp(actin-1)、600 bp(actin-2)、1 084 bp(gpd-1)、700 bp(gpd-2)、585 bp(Pumgpd);靶標基因 mek加上兩端同源臂序列后,片段長度約為1 180 bp(分別命名為Mek-A1、Mek-G1、Mek-A2、Mek-G2和Mek-PG)。通過凝膠電泳檢測,各啟動子與mek片段長度與預期相符(圖2),產物片段測序結果與原序列一致。
2.2 啟動子序列與元件分析
通過PlantCARE啟動子在線分析軟件,對基因actin、gpd、Pumgpd起始密碼子上游啟動子序列中作用元件進行分析。在啟動子中,根據(jù)TATA-box與CAAT-box的作用。其中TATA-box又稱核心啟動子,為RNA聚合酶的結合處之一,與轉錄起始有關;CAAT-box作為真核生物分布較廣的基因調節(jié)區(qū),控制著轉錄起始的頻率。在actin啟動子中(圖3-A),存在1個TATA-box元件,6個CAAT-box元件。在gpd啟動子中(圖3-B),存在3個TATA-box元件,6個CAAT-box元件。在Pumgpd啟動子中(圖3-C),存在2個CAAT-box元件。
2.3 轉化用DNA長片段獲取
通過多片段無縫克隆技術將啟動子actin-1、gpd-1、actin-2、gpd-2、Pumgpd分別與功能基因mek順序連接到載體pAa上得到5個重組載體pAaactin-1、pAa-actin-2、pAa-gpd-1、pAa-gpd-2和 pAa-Pungpd。用通用引物pAa-F/pAa-R分別擴增重組載體獲得對應的用于原生質體轉化的DNA長片段(圖4),片段長度7 200 bp左右,包含了重組載體LB和RB之間的DNA片段。
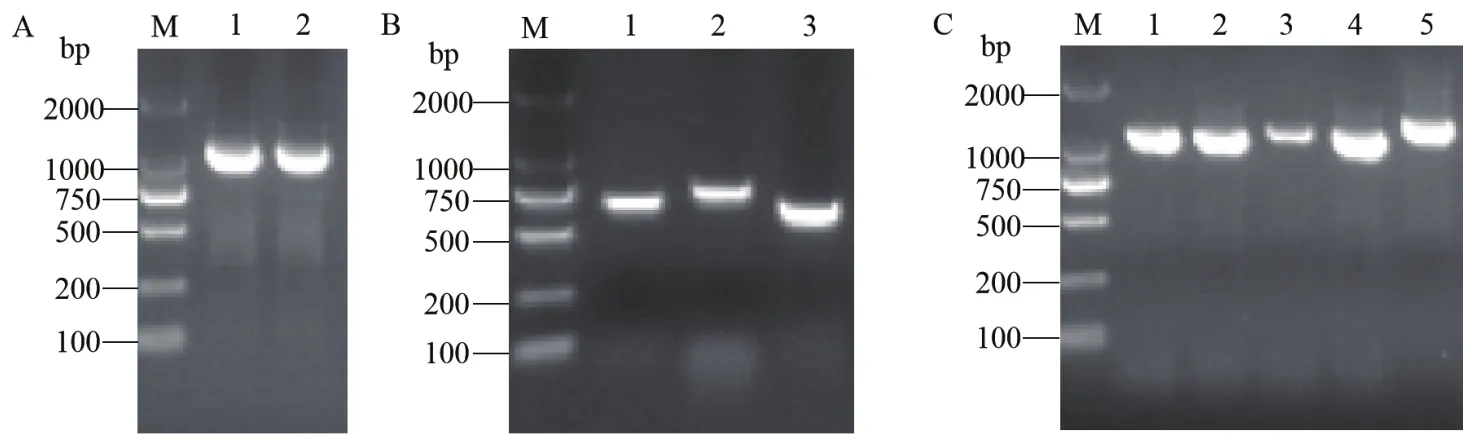
圖2 啟動子與mek片段擴增Fig.2 Amplification fragments of promoters and mek

圖3 啟動子序列元件特征Fig.3 Characterization of promoter sequences and elements
2.4 柱狀田頭菇遺傳轉化及轉化子篩選
通過PEG介導原生質體轉化,轉化子菌絲透過上層潮霉素篩選培養(yǎng)基形成白色菌落(圖5-A),挑取白色菌落重新置于YPD(含150 μg/mL HYG)培養(yǎng)基中進行復篩,轉化子在復篩時都能正常生長(圖5-B)。
將挑取的轉化子提取DNA,用引物PM-F/PM-R進行PCR擴增,結果(圖6)顯示轉化子中均含有重組后的啟動子和目的基因片段,說明挑取的轉化子均為陽性轉化子,可以用于后續(xù)的基因表達分析。
2.5 不同啟動子驅動靶標基因表達水平
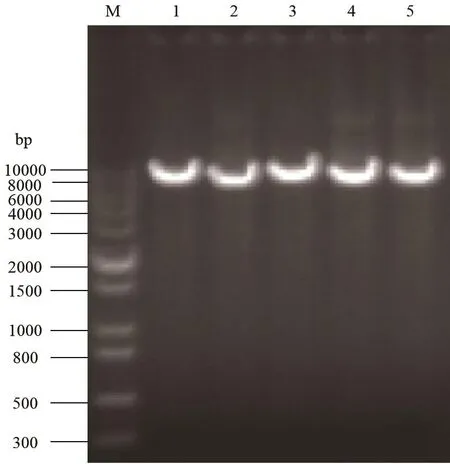
圖4 重組質粒中轉化片段擴增Fig.4 Amplification of transformation fragments in the recombinant plasmids
以YSG中gpd作為內參基因,通過qRT-PCR來檢測功能基因mek的表達量。結果顯示(圖7),挑選出攜帶actin-1啟動子的10個轉化子中,過量表達的轉化子有7個,過表達轉化子得率達70%,表達量為對照3倍以上轉化子有5個,最高表達量為對照的10.45倍;攜帶 actin-2啟動子的3個轉化子中,過量表達的轉化子有3個,過表達轉化子得率達100%,表達量為對照3倍以上轉化子有1個,最高表達量為對照的6.23倍;攜帶gpd-1啟動子的13個轉化子中,過量表達的轉化子有9個,過表達轉化子得率達69.24%,表達量均低于對照的3倍,最高表達量為對照的2.93倍;攜帶gpd-2啟動子的7個轉化子中,過量表達的轉化子有6個,過表達轉化子得率達85.71%,表達量為對照3倍以上轉化子有2個,最高表達量為原始啟動子的7.75倍;攜帶Pumgpd啟動子的4個轉化子中,過量表達的轉化子有3個,過表達轉化子得率達75%,表達量為對照3倍以上轉化子有1個,最高表達量為對照的4.31倍。綜合分析顯示,pAa-actin-1和pAa-actin-2兩個啟動子控制的過量表達及高表達轉化子得率較其它3個啟動子高,適用于構建柱狀田頭菇穩(wěn)定高效轉化體系。
圖5 潮霉素抗性平板上轉化子的篩選Fig.5 Screening of transformants on HYG plates
圖6 部分轉化子PCR驗證Fig.6 PCR verification of partial transformants
3 討論
隨著越來越多食用菌基因組測序工作的完成,對于食用菌遺傳轉化體系建立的研究也更深入,為后續(xù)基因功能分析奠定重要的基礎。啟動子作為控制基因轉錄的重要元件,與功能基因的表達及其表達程度密切相關,是建立穩(wěn)定高效遺傳轉化體系過程中關鍵組成部分。盡管研究者已從眾多物種中分離獲得了多種基因啟動子用于載體構建,然而適合于不同物種的啟動子不盡相同,需要進行全面篩選以找到合適的目標啟動子。
在前期研究中,利用actin作為啟動子,我們構建了柱狀田頭菇的遺傳轉化體系,菌絲中呈現(xiàn)明顯的熒光信號[15]。本研究中進一步構建了不同基因和不同長度actin、gpd和Pumgpd啟動子的表達載體,其中actin啟動子選取全長actin-1與部分序列actin-2,所獲得的過表達和高表達轉化子比率比其它啟動子更高,適合于后期的過表達載體構建。研究者多認為內源啟動子更適合菌株本身驅動靶標基因的表達[16],即與本研究中內源啟動子gpd和actin優(yōu)于外源Pumgpd結果相似,但也存在異源啟動子優(yōu)于本身內源啟動子的現(xiàn)象[17-19]。由此可見,研究者在構建過表達載體時,進行啟動子的對比篩選非常必要。
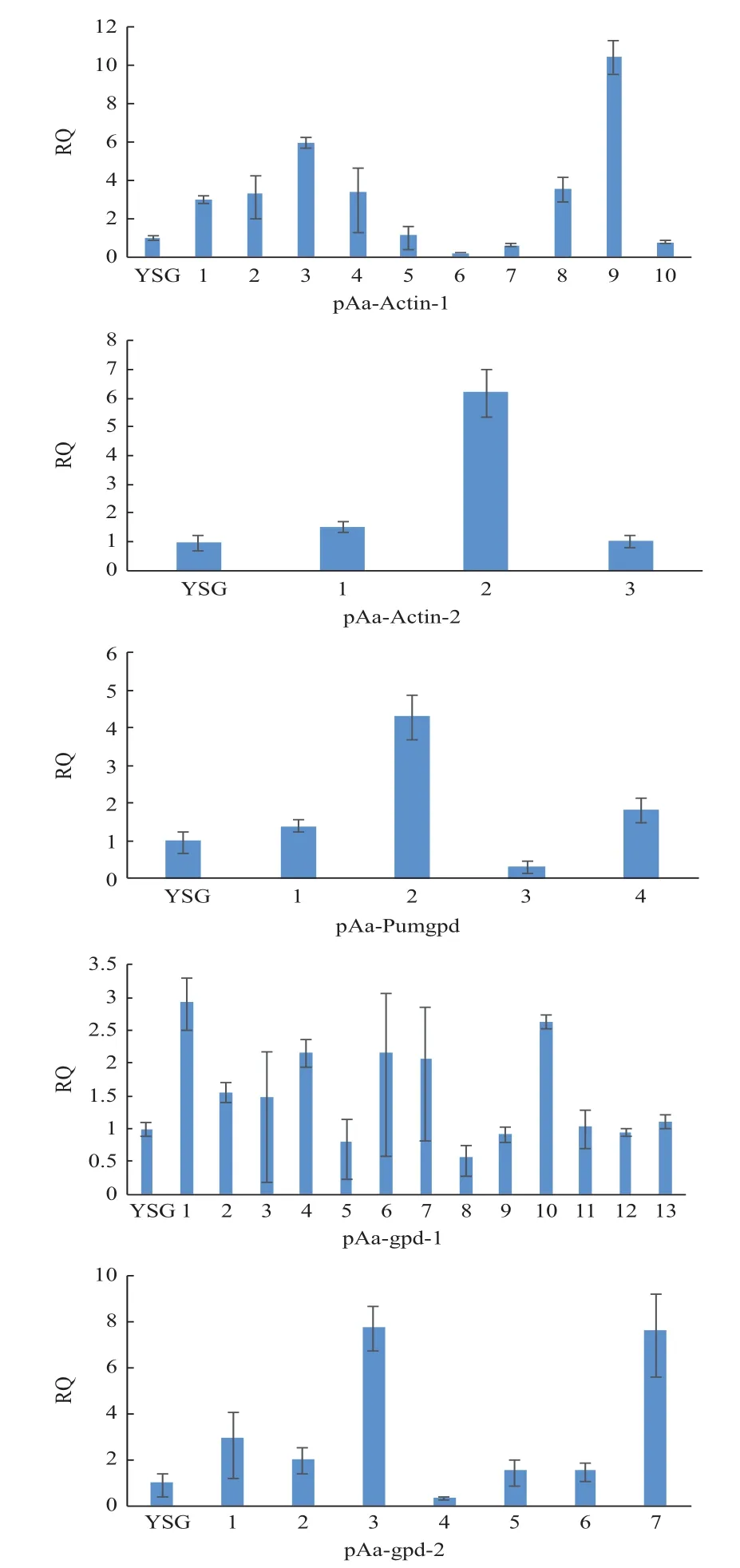
圖7 5個啟動子片段控制的mek基因表達水平Fig.7 Expression levels of mek gene controlled by five promoter fragments
此外,由于啟動子片段大小可能會影響靶標基因的轉錄活性,推測轉錄元件的數(shù)量與種類造成啟動子與轉錄復合體結合差異造成[20],而本研究中不同長度的actin和gpd作為啟動子,驅動的靶標基因表達量也有差異,其中攜帶長片段actin-1比段片段actin-2高表達(表達量為對照3倍以上)轉化子得率高,而攜帶短片片段gpd-2比gpd-1高表達轉化子得率高。因此選取的啟動子片段大小對靶標基因表達確實有影響,但是造成驅動子片段驅動基因表達差異的原因還需要進行深入探討。
4 結論
本研究通過對柱狀田頭菇內源gpd和actin基因啟動子不同長度片段及外源啟動子Pumgpd分別構建過表達載體,轉化原生質體后挑選陽性轉化子,對靶標基因的表達量進行分析,其中利用actin啟動子構建的載體比其它基因啟動子相對應載體所獲得高表達的轉化子得率更高,適用于后期的基因功能分析研究。