轉Cry1Ac-2A-gna基因甘蔗BCG-17轉化體特異性檢測方法的建立
馮翠蓮 萬玥 王俊剛 馮小艷 趙婷婷 王文治 沈林波 張樹珍,
(1.中國熱帶農業科學院熱帶生物技術研究所甘蔗研究中心,農業農村部熱帶作物生物技術重點開放實驗室,海口 571101;2.南京農業大學生命科學學院,南京 210095)
自1996年首例轉基因農作物產業化應用以來,全球轉基因技術研究與產業應用快速發展。2018年全球26個國家種植了1.917×108hm2轉基因作物,比2017年增長1%,2019年全球共有43項關于轉基因作物的批準,有9個新的轉基因作物品種獲得批準,包括油菜,棉花、豇豆、大豆和甘蔗。而我國農業農村部也公示了192個擬頒發“農業轉基因生物安全證書”的植物品種[1]。由此可見轉基因作物種植及應用在未來仍然持續保持穩定增長,轉基因作物的安全性問題早已成為國際社會關注的熱點,因此對轉基因作物進行有效的評估與后續的監管是當前亟需的問題。
每一個轉化事件中,攜帶外源基因的T-DNA在受體植物的插入都是隨機的,從而造成T-DNA左右兩側與受體植物基因組的連接區域的堿基序列的不同,因此T-DNA側翼序列的克隆以及定位是明確轉基因作物的分子特征的基礎,對于轉基因植株的身份識別具有重要意義[2];另一方面T-DNA在受體基因組中的插入位點對外源基因和受體內源基因的表達均有可能產生互相影響,因此分析T-DNA的插入位點對于研究轉基因植物的穩定遺傳有重要的意義[3]。所以T-DNA插入位點信息,側翼序列和拷貝數等轉基因作物的分子特征是轉基因生物安全評估和后續監測的基礎,有助于充分評估轉基因植物的安全性。
目前獲取T-DNA側翼序列最常用的技術之一是染色體步移法(genome walking),染色體步移法是以PCR技術為基礎發展而來,大體上分為依賴酶切連接與不依賴酶切連接的兩類。依賴酶切連接的染色體步移法由于酶切位點分布隨機造成連接效率偏低,從而引起PCR擴增效率下降,導致成功率降低。另一類不依賴酶切連接的染色體步移法操作簡便,不受酶切位點影響的優點,雖然非特異擴增較多,但經過3-4輪的巢式PCR擴增,仍然可以獲得滿意的實驗結果[4-5]。利用此類技術已經成功分離了轉基因水稻[6-8]、玉米[9]、棉花[10]、小麥[11-12]和馬鈴薯[13]等T-DNA側翼序列,并建立其相應的轉化轉化事件特異性檢測技術;轉基因作物轉化事件特異性檢測技術是以其轉基因T-DNA側翼序列的部分序列為靶標進行擴增,擴增產物是T-DNA 5′端或3′端序列與受體基因組的拼接序列,因此具有高度特異性,可準確識別不同的轉基因作物品系。
甘蔗(Saccharum officinarum L.)是世界上最重要的一類糖料作物,其產蔗糖產量占世界食糖量的65%[14]。我國甘蔗糖量占全國總糖量的90%。但在各個甘蔗生產區,甘蔗在整個生長發育期內均會受到120余種蟲害威脅[15-16]。抗蟲品種的培育一直都是甘蔗育種工作的一個重要目標,目前抗蟲轉基因育種是甘蔗抗蟲育種最有效的途徑之一。本文作者前期利用具有自我剪切功能的FMDV2A連接多肽連接人工改造后的 Cry1Ac和gna 基因,融合成Cry1Ac-2A-gna抗蟲基因,并由玉米Ubi強啟動子驅動,以pCAMBIA3300質粒為骨架,構成抗蟲植物表達載體,并通過農桿菌介導把Cry1Ac-2A-gna抗蟲融合基因轉入甘蔗新臺糖22號,經過2個無性繁殖世代的抗蟲性和遺傳穩定性的評價和深入農藝性狀鑒定,已獲得對甘蔗條螟等各類螟蟲具有良好的抗蟲性、外源基因穩定遺傳和農藝性狀優良的BCG-17株系,該株系正準備進行環境釋放。為了明確轉基因甘蔗BCG-17的分子特征及便于其檢測,推進其生物安全性評價工作,本實驗以其無性繁殖T2代為植物材料,首先利用Southern雜交檢測外源T-DNA在BCG-17中的插入拷貝數;然后利用染色體步移技術分離其T-DNA側翼序列,并根據T-DNA左右側翼序列設計檢測引物,建立轉基因甘蔗BCG-17的轉化事件特異性檢測方法,同時檢驗該方法的特異性與靈敏度,為該轉基因甘蔗及其衍生產品的檢測和身份識別提供技術依據。
1 材料與方法
1.1 材料
植物材料為轉cry1Ac-2A-gna 融合抗蟲基因和bar抗除草劑基因的甘蔗BCG-17株系,是通過農桿菌介導轉化甘蔗新臺糖22號(ROC22)胚性愈傷而獲得,由本實驗室保存,已申請在海南省的中間試驗。植物表達載體以 pCAMBIA3300為骨架,其T-DNA區從右到左依次包括Ubi啟動子、cry1Ac-2A-gna融合基因、NOS終止子、雙35S啟動子、bar基因和PolyA。cry1Ac-2A-gna融合基因全長為2 367 bp, 其 中 cry1Ac為 1845 bp、2A 為 51 bp、gna為471 bp。Dig nucleic acid detection kit、PCR DIG Probe Synthesis Kit購于德國羅氏公司;HyboodTM-N+尼龍膜購自美國GE Amersham;Genome Walking Kit、試劑 LA Taq酶、pMDTM18-T Vector Cloning Kit、T4 DNA Ligase等購于TaKaRa公司;質粒提取、膠回收試劑盒及純化試劑盒購于Axygen公司;2×Taq plus MasterMix、DNA Marker購于Biosharp公司;氨芐青霉素,瓊脂糖購于Sigma公司。PCR引物合成及基因測序由上海生工生物工程技術服務有限公司完成。其他試劑均為進口或國產分析純。
1.2 方法
1.2.1 甘蔗BCG-17基因組DNA的提取 選擇轉基因甘蔗BCG-17的無性繁殖T2代甘蔗的幼嫩葉片,采用改良CTAB法大量提取并純化基因組總DNA[17],同時提取非轉基因甘蔗ROC22基因組總DNA 作為對照。取 2 μL于 Thermo Scientific Nano Drop One 生物核酸定量檢測儀測定DNA的濃度和純度,另取2 μL于1.0%瓊脂糖凝膠電泳檢測DNA的完整性。
1.2.2 Southern雜交檢測 以轉化質粒pNUBG為模板,利用高效PCR地高辛標記法分別制備BG(包括Cry1Ac-2a-gna中Cry1Ac基因下游355 bp,2a和gna全長)、bar、sta、kan四種不同的探針,擴增引物、退火溫度、產物長度等詳見表1。通過分析T-DNA區的酶切位點,結合各探針在T-DNA上的位置(圖1),分別選擇3種限制性內切酶對30 μg基因組DNA進行酶切(不同探針使用的內切酶詳見表4),低電壓電泳后,轉膜至 HyboodTM-N+尼龍膜,再利用相應的探針,進行Southern 雜交檢測,雜交溫度40℃,預雜交時間2 h,雜交時間16 h,室溫黑暗條件下用BCIP / NBT進行化學顯色,待雜交信號帶清晰后終止顯色,拍照并分析。具體操作參考試劑盒說明書和本研究團隊成員崔學強發表的文章[18]。
1.2.3 轉基因甘蔗BCG-17的T-DNA左右側翼序列的獲取 按照染色體步移試劑盒中的要求,在植物表達載體pNUBG的T-DNA左右端序列分別設計4條退火溫度約為65℃的嵌套特異性引物(Lsp1-Lsp4和Rsp1-Rsp4),位置見圖2,序列見表2。由于不同植物物種基因組的差異,為了增加試劑盒使用的廣譜性,試劑盒提供了4種隨機簡并引物,按照操作說明,每種隨機簡并引物AP1-AP4分別與嵌套特異性引物組合配對,進行三-四輪巢式PCR擴增分離該株系的T-DNA左右側翼序列。第一輪反應體系中,BCG-17基因組DNA模板為200 ng,特異性引物為Lsp1或Rsp1,簡并引物為AP1-AP4其中之一。第二輪PCR反應的擴增模板為稀釋50倍的第一輪PCR產物,特異性引物為Lsp2或Rsp2,簡并引物為第一輪所用的AP引物,第三、四輪操作同第二輪,特異引物換成Lsp3/Rsp3或Lsp4/Rsp4,每一輪反應的退火溫度詳見表2,擴增程序參照試劑盒說明書。最后擴增產物于用1.0%瓊脂糖凝膠電泳分離,特異擴增片段利用DNA膠回收試劑盒回收。連接T載體,轉化大腸桿菌DH5α,送陽性菌株至上海生工測序。
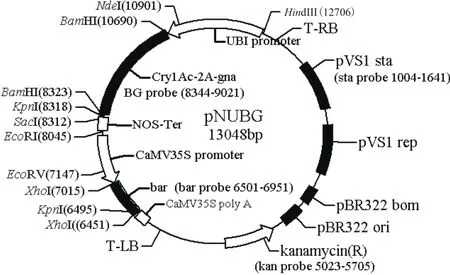
圖1 pNUBG植物表達載體酶切位點及探針位置Fig.1 Enzyme digestion sites and probe positions of pNUBG plant expression vector

表1 PCR DIG探針制備所用引物Table 1 Primers used for PCR DIG probe preparation
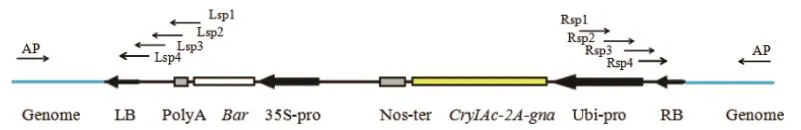
圖2 pNUBG表達載體的T-DNA結構和特異性引物的位置Fig.2 T-DNA structure of pNUBG expression vector and the location of specific primers

表2 巢式PCR反應所需要的特異性引物Table 2 Specific primers required for nested PCR reactions
1.2.4 轉基因甘蔗BCG-17事件特異性PCR檢測及其靈敏度 BCG-17事件特異性PCR檢測的建立:根據T-DNA左、右側翼序列的測序結果以及T-DNA左右端載體序列分別設計3對特異性檢測引物:LS132/LA797、LS132/LA791、LS040/LA791和 RS139/RA467、RS139/RA526、RS006/RA467,對轉基因甘蔗BCG-17進行擴增,分別篩選一組左、右特異性檢測擴增效率最好的,并回收純化特異性片段及測序,比對是否與預期序列完全一致,最終建立事件特異性檢測方法。特異性檢測引物的一條引物位于甘蔗基因組序列,另一條引物則位于T-DNA左、右端載體序列,引物序列詳見表3。分別利用上述篩選的兩對引物和bar基因引物,以包括BCG-17在內的轉Cry1Ac-2a-gna基因的不同甘蔗株系和非轉基因甘蔗DNA為模板,表達載體pUNBG質粒為對照,進行轉化事件特異性PCR檢測。DNA模板量為200 ng,反應循環數35,退火溫度見表3。PCR產物取5 μL于1.0%瓊脂糖凝膠電泳檢測擴增效率和擴增特異性。

表3 BCG-17事件特異性PCR檢測引物Table 3 Primers for BCG-17 event-Specific PCR detection
檢測轉化事件特異性PCR的靈敏度:轉基因甘蔗BCG-17與受體甘蔗ROC22#的基因組DNA分別稀釋至100 ng/μL,根據不同的比例配制BCG-17的DNA相對含量為100%、50%、10%、1%、0.5%、0.1%、0.05%和0%(V/V)的總DNA為100 ng/μL的模板樣品。混合樣品取各1 μL作為PCR模板,分別利用上述已篩選出來的擴增效率最高的左、右特異性引物對,進行PCR擴增。取5 μL PCR產物,用1.0%瓊脂糖凝膠電泳,檢查各濃度BCG-17 DNA模板下的擴增效果,測試各對引物的轉化事件特異性PCR的特異性和靈敏度。
2 結果
2.1 抗蟲轉基因甘蔗BCG-17外源T-DNA插入拷貝數檢測
轉基因甘蔗BCG-17基因組DNA分別用BamHI、Nde I、EcoRV限制性內切酶進行酶切、電泳和轉膜后,利用地高辛標記的外源基因BG和bar片段的探針分別進行Southern雜交檢測,結果表明,不同的限制性內切酶后的甘蔗基因組DNA經BG和bar探針雜交后,均只顯示一條雜交帶,并且雜交帶的大小與預測理論大小一致(表4),而對照非轉基因植株中無雜交信號,說明外源基因已整合到甘蔗BCG-17基因組中并以單拷貝的方式整合(圖3);用載體骨架序列制備的sta和kan探針進行Southern雜交,結果表明轉基因甘蔗基因組中沒有來源于轉化載體的其他元件的骨架序列。Kpn I酶切后的pNUBG質粒經BG、sta和kan探針雜交后均顯示一條約11000 bp的雜交帶,而與bar探針雜交則顯示約1800 bp的雜交帶,與預測理論大小一致(表4)。

表4 BCG-17和pNUBG質粒Southern Blot雜交帶大小的理論值Table 4 Theoretical values of Southern Blot hybridization zone size in BCG-17 and pNUBG
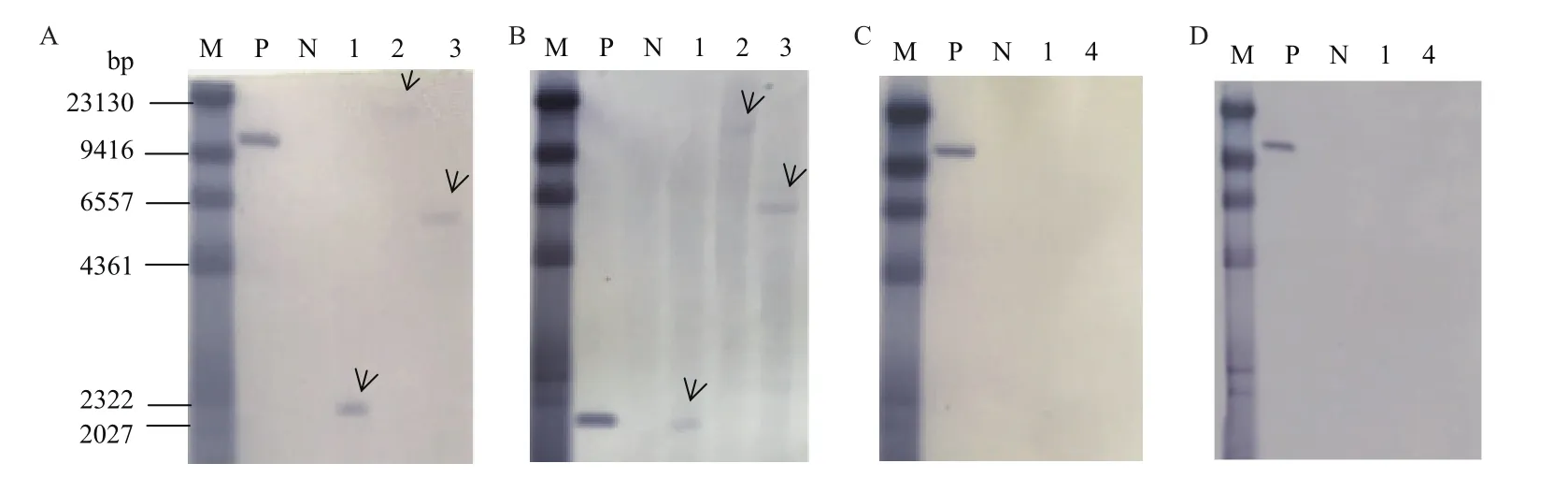
圖3 轉基因甘蔗BCG-17 Southern Blot分析Fig.3 Southern Blot analysis of transgenic sugarcane BCG-17
2.2 外源基因T-DNA左右側翼序列的獲得及分析
為了獲得BCG-17株系T-DNA的左、右側翼序列,在T-DNA左右邊界分別設計四條巢式特異性引物。左側四條巢式特異性引物分別與試劑盒中AP1-AP4四條簡并引物組合,經過三-四輪熱不對稱巢式PCR反應后,電泳結果顯示,任何引物組合經3輪巢式PCR的擴增均未獲得特異性片段,只有AP4簡并引物和4條巢式引物組合,經過4輪巢式PCR的擴增,獲得特異性的片段如圖4-A。回收產物送上海生工測序,獲得840 bp的序列,如圖5-A,其中510 bp屬于甘蔗基因組序列,此部分GC百分含量為25.49%;剩余330 bp與T-DNA左邊載體序列重合,并發現缺失了LB border 最左邊的17 bp序列,見圖5-B。
分離右側翼序列同操作上,簡并引物AP1與特異性引物Rsp1/Rsp2/Rsp4組合,經三輪巢式PCR擴增得到特異性片段,如圖4-B。測序獲得1233 bp的序列,如圖6-A。其中915 bp為甘蔗基因組序列,GC百分含量為39.89%,其它318 bp與T-DNA右邊界載體序列重合,并發現缺失了RB border 最右側的20 bp,見圖6-B。由此可見,T-DNA序列插入BCG-17基因組時,左右兩側的都有不同程度的缺失。
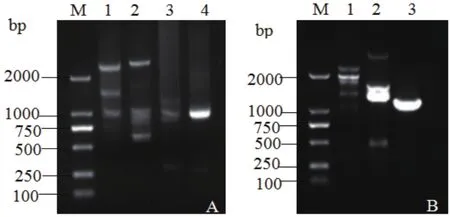
A:左側翼序列擴增;B:右側翼序列擴增。M:DNA Marker;1:1st產物;2:2nd產物3:3rd產物;4:4th產物A: Left flanking sequence.B: Right flanking sequence.M:DNA marker,1: Amplification for 1st, 2: Amplification for 2nd, 3: Amplification for 3rd,4: Amplification for 4th
2.3 建立轉基因甘蔗BCG-17事件特異性檢測方法
利用左、右側3對特異性檢測引物LS132/LA797、LS132/LA791、LS040/LA791和 RS139/RA467、RS139/RA526、RS006/RA467,對轉基因甘蔗BCG-17進行擴增,擴增效率最好的引物對分別是LS040/LA791和RS139/RA526,見圖7-A。以轉相同基因的轉基因甘蔗株系和非轉基因甘蔗為模板,分別利用LS040/LA791和RS139/RA526特異引物和bar基因引物進行事件特異性檢測。結果顯示,使用特異性檢測引物的擴增產物中,只在轉基因甘蔗BCG-17可以擴增到大小約為750 bp(左側翼)和約380 bp(右側翼)的特異性條帶,其他轉基因株系和非轉基因材料擴增均為陰性(圖7-C、7-D);而使用bar基因引物的擴增產物中,表達載體質粒和轉基因各株系都能擴增到約423 bp的特異性片段,只有非轉基因甘蔗擴增結果為陰性(圖7-B)。BCG-17擴增到的約750 bp和380 bp的特異性片段回收后,測序,經比對證實與預期序列完全一致。證明LS040/LA791和RS139/RA526這兩對引物可以特異的識別轉基因甘蔗事件BCG-17。
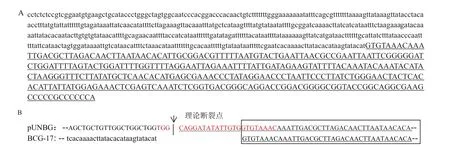
圖5 BCG-17左側翼序列及拼接位置特征Fig.5 Left flanking sequence of BCG-17 and the character of junction region

圖6 BCG-17右側翼序列及拼接位置特征Fig.6 Right flanking sequence of BCG-17 and the character of junction region
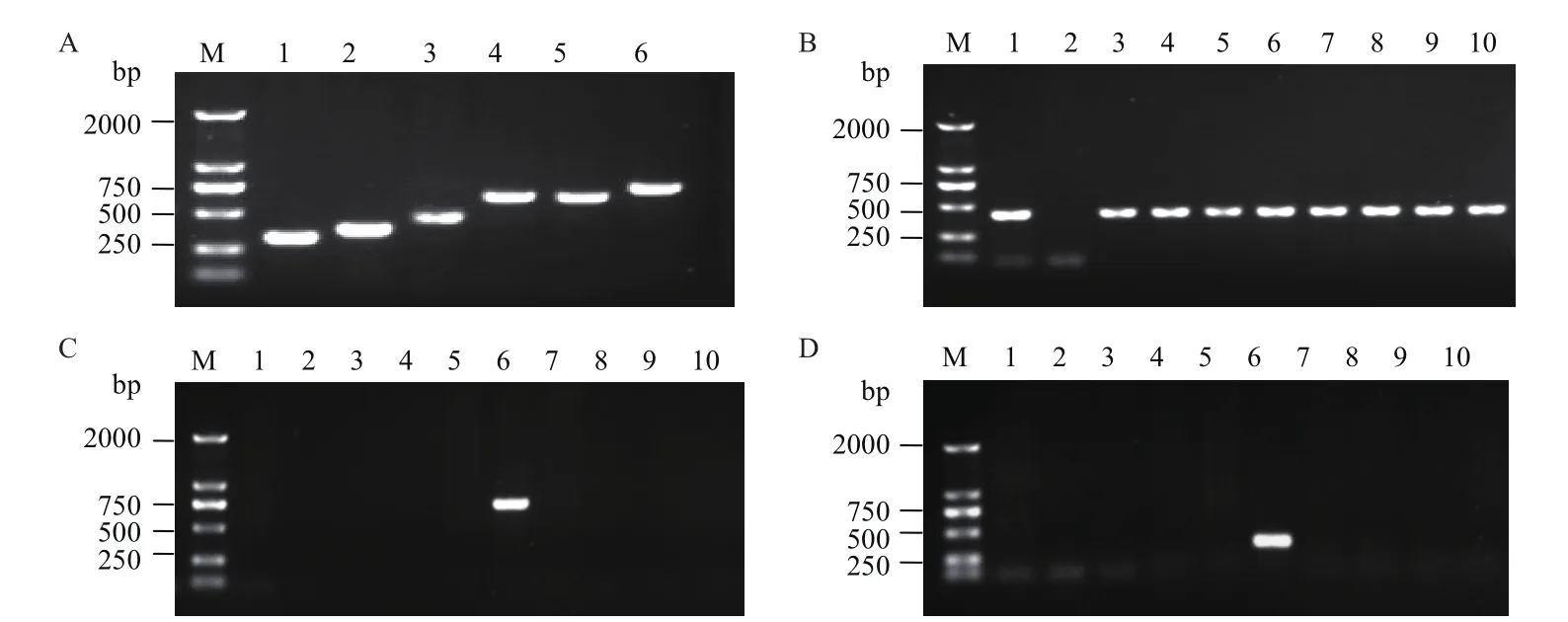
圖7 甘蔗BCG-17轉化事件特異性PCR檢測Fig.7 Transformation event-specific PCR detection of the BCG-17 sugarcane
2.4 事件特異性PCR檢測的靈敏度
利用LS040/LA791和RS139/RA526兩對引物檢測在不同BCG-17 DNA含量混合樣品中的轉化事件特異性PCR擴增效率,測試此兩對引物的最低擴增限度。結果發現,以左側引物LS040/LA791擴增時,當BCG-17的DNA相對含量降低至0.1%時,仍然可以特異地擴增到目的片段(圖8-A);以右側引物RS139/RA526擴增時,當BCG-17的DNA相對含量降低至1%、0.5%、0.1%時,除了目的片段,還出現了非特異片段的擴增,當降低至0.05%和0%時,只有非特異片段的擴增(圖8-B)。以上結果表明以右側RS139/RA526為引物的事件特異性PCR的特異性和靈敏度較差,而以左側LS040/LA791為引物的事件特異性PCR檢測的特異性好和靈敏度高,最低檢出值達 0.1%,按甘蔗基因組為10Gb計算,相當于9個單倍體基因組拷貝數,也就是說該轉化事件特異性PCR最低檢測限約為 9個單倍體甘蔗基因組拷貝數。
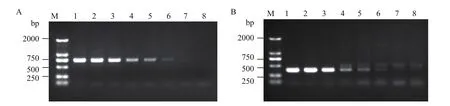
圖8 左右側翼特異性引物對PCR檢測限度的測定Fig.8 Limitation of event-specific detection by use of specific primer pairs of left and right flanking sequences
3 討論
目前分離外源T-DNA側翼序列使用最廣泛的技術有染色體步移法、高效熱不對稱PCR(hiTAILPCR)和近幾年熱門的全基因組重測序技術。后者是對已知基因組序列的物種進行不同個體的基因組測序,并在此基礎上對個體或群體進行差異性分析[19]。由此可見,應用該技術的前提條件是已知受體植物的基因組序列信息。到目前為止,國內外并未對甘蔗ROC22開展基因組測序工作,因此本實驗仍然選擇操作較為繁瑣的染色體步移法。本實驗中,根據已知T-DNA左右序列首先設計了3條同向Tm值約為65℃的特異性引物,與染色體步移試劑盒中的四條簡并引物分別進行熱不對稱 PCR反應,經過多次三輪巢式PCR反應后,電泳檢測仍得不到滿意的實驗效果,故設計第四條特異引物。通過簡并引物AP4和T-DNA左側四條巢式引物組合,經過四輪巢式PCR的擴增,最終獲得510 bp的T-DNA左側左側翼序列。分析此獲得序列的GC百分含量發現,此部分序列富含A、T堿基,GC含量僅為25.49%。因此推測可能是富含A、T堿基的原因造成大量非特異性片段的擴增,三輪巢式PCR得不到特異片段,經四輪巢式PCR擴增才得到目的片段。而T-DNA右側翼則在簡并引物AP1與特異性引物Rsp1/Rsp2/Rsp4組合經過三輪巢式PCR獲得,由此可見利用染色體步移技術分離轉基因甘蔗T-DNA側翼序列仍然有一定的難度,推測跟甘蔗是異源多倍體植物并具有龐大復雜的基因組有關,所以設計嵌套特異性引物時可以多設計幾條備選或進行第四輪、五輪巢式PCR。另一方面,在染色體步移試劑盒提供的4種簡并引物里,本次獲得目標序列的是AP1與AP4,而在另一個株系BCG-2則是AP1和AP3,剩下的AP2也曾經獲得目標片段,只是長度偏短。由此可見,4種簡并引物都是可以用于分離甘蔗已知序列的側翼序列的。
由于利用TaKaRa公司的 Genome Walking Kit分離轉基因甘蔗T-DNA側翼序列存在較大的難度和工作量,在實驗中,曾嘗試使用了另一種LA PCRTM in vitro Cloning Kit對側翼序列進行擴增,該方法是依賴酶切連接接頭的染色體步移技術,理論上該方法的擴增目標更直接,故特異性會更高,然而在實驗過程中,利用該方法經多次嘗試未獲得理想結果,推測由于甘蔗基因組龐大造成酶切位點分布隨機造成連接效率偏低,從而引起PCR擴增成功率降低。因此不依賴酶切連接的染色體步移是目前較為適合于擴增轉基因甘蔗T-DNA側翼序列的方法。
上述獲得的的T-DNA側翼序列在NCBI的核酸數據庫中進行比對,發現右側翼序列與高粱BRCA1相關的結構域蛋白mRNA有39%同源外,而左側翼序列在數據庫中沒有發現任何的同源序列。這個比對結果是因為甘蔗基因組測序未完成,NCBI的核酸數據庫只有少量的甘蔗轉錄組測序和EST序列而造成,因此就目前研究水平,盡管得到了T-DNA的側翼序列,仍無法對甘蔗BCG-17的T-DNA插入位點進行精準的定位。但是甘蔗割手密種AP85-441基因組測序于2018年完成并發表在Nature Genetics上[20],本研究團隊曾把序列下載,進行本地化建庫獲得庫文件,已獲得的T-DNA側翼序列經Blastn比對發現, T-DNA插入可能在該基因組的Chr7A非編碼區19011049、Chr7B非編碼區20602346、Chr7C非編碼區9126238和Chr7D非編碼區12281767位點上。從此結果看,插入位點可能是在Chr7染色體上,但甘蔗割手密和甘蔗ROC22都是多倍體植物,所以無法判斷T-DNA是插入在A-D中哪一組。而從Southern雜交的結果看,外源基因是以單拷貝方式插入,所以只能是插入在A-D中其中一組。就目前缺少甘蔗基因組序列數據庫的情況下,根據甘蔗某段核酸序列而進行準確的染色體定位是極其困難的,最好的解決方法是加快甘蔗基因組的測序工作。據了解,國內已經有甘蔗研究團隊準備甘蔗ROC22的基因組測序工作,該項工作的完成,勢必將甘蔗基因組功能研究等基礎研究推上一個新的臺階。
通過擴增T-DNA側翼序列而建立起來的事件特異性檢測法,是鑒定含有相同T-DNA插入片段的不同轉化事件的最有效方法。本研究建立的轉基因甘蔗BCG-17的事件特異性PCR檢測方法特異性好,靈敏度高,轉基因成分含量0.1%及以上時利用常規定性PCR方法即可檢測,該靈敏度在其他轉基因作物事件特異性檢測中普遍存在,如轉基因水稻[8,21]、大豆[22]、油菜[23]和玉米[24]等,并且遠高于歐盟對轉基因植物衍生的食品及飼料標識的0.9% 的最低限量[25]。
4 結論
本研究利用southern雜交確定了轉基因甘蔗BCG-17的外源基因的插入拷貝為單拷貝;利用染色體步移方法,擴增得到轉基因甘蔗BCG-17外源基因插入位點的左右側翼序列;以此序列為基礎,建立了轉基因甘蔗BCG-17的事件特異性PCR檢測方法,該方法特異性好,靈敏度高,為轉基因甘蔗BCG-17的利用及產品檢測奠定關鍵技術基礎。