水凝膠應用在關節損傷中的意義和進展
郭明宇,徐林
水凝膠是具有網狀交聯結構的高分子親水性材料,吸水后體積會顯著膨脹。水凝膠具有較好的生物力學作用,通過改性[1]可以制備更多具有優良特性的生物材料,例如合成具有“8”字形結構[2]的滑動輪水凝膠,這類水凝膠的抗應力的特性適合用作關節隔離支撐材料。水凝膠的多孔結構可以貯存藥物并緩慢釋放,例如在關節腔內給藥治療關節軟骨的局部病變。本文主要介紹水凝膠的發展、性能、應用以及在關節慢性運動損傷中的研究現狀和應用前景。
1 水凝膠的研究進展
1.1 發展演變
從Wichterle和Lim首次研究甲基丙烯酸β-羥乙酯(2-Hydroxyethyl methacrylate,HEMA)優良的性能開始,到Nagarsekar等[3]通過生物合成法合成出類彈性蛋白聚合物(elastin-like polypeptides,ELPS)水凝膠時期,再到Cappello等[4]研究了類絲蛋白聚合(silk-elastin-like-protein,SELP)與組織的生物相容性。這些研究都發現了水凝膠具備優良的特性,近年來,有關水凝膠的制備工藝和理化性質的研究十分活躍,Bahcecioglu等[5]人發現使用含有聚乙酸丙酯水凝膠的細胞支架有利于促進體外半月板再生。
1.2 水凝膠分類
水凝膠按照材料來源[6]、交聯方式[7]、對外界刺激的響應情況[8]等可以進行不同的分類(見表1)。
根據材料來源的不同可以分為天然水凝膠及合成水凝膠;根據水凝膠交聯網絡鍵合機理不同可分為物理水凝膠和化學水凝膠;根據對外界環境刺激的響應程度,可分為傳統水凝膠和智能水凝膠,如偶氮苯分子[9]可以在光刺激下結構發生變化,丙烯酰胺基偶氮苯單體與丙烯酸共聚形成的水凝膠可以同時對環境中的pH值與光刺激產生響應,發生體積的變化。
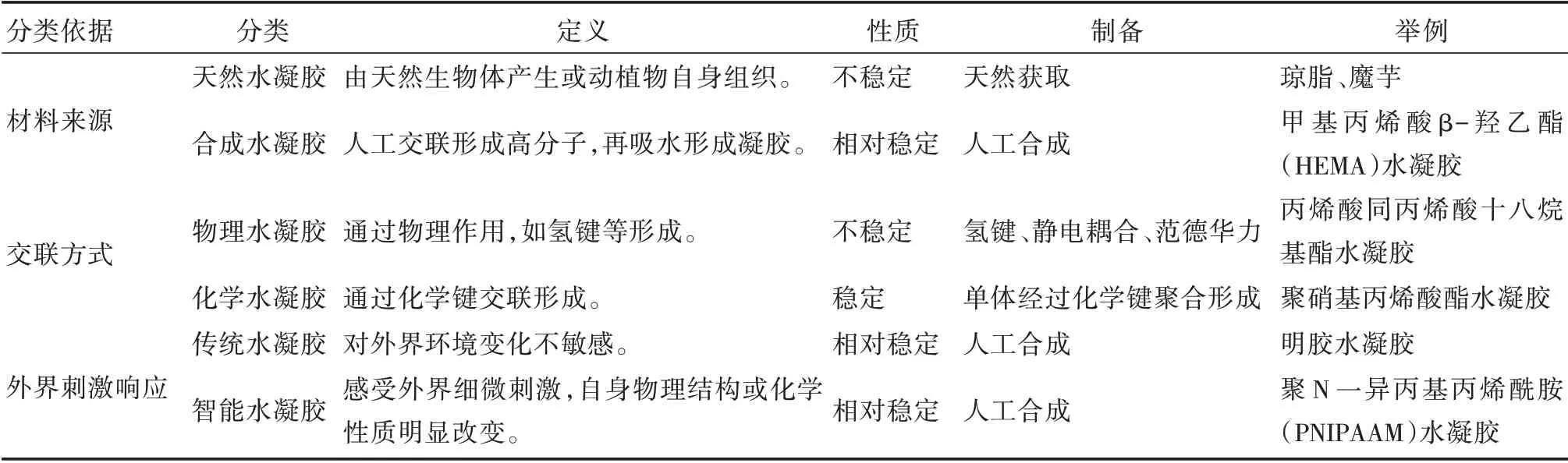
表1 水凝膠的分類
1.3 水凝膠的制備
水凝膠的制備關鍵在于交聯高分子的形成。物理制備方法是通過外力或環境條件改變,如氫鍵配位鍵、靜電耦合等方式形成的交聯結構,物理水凝膠具有獨特的性質,但自身穩定性較差,例如江明等[10]人發現通過控制溫度可以合成分聚乙二醇-聚酯嵌段共聚物水凝膠;化學水凝膠的制備是通過產生化學鍵的方式形成三維網絡聚合物,制備過程決定了其穩定性比物理水凝膠高,因此也被稱為永久性水凝膠。例如Kou等[11]使用具有較好電化學穩定性和離子傳導性的材料單體合成聚硝基丙基酸酯水凝膠。隨著材料學的快速發展,新型水凝膠的制備不再是單純的物理、化學制備,而是在微觀層面上對材料分子進行交聯、修飾,制備過程包括物理、化學甚至生物酶聯等方法,制備出的水凝膠不僅結構穩定、生物相容性好,還能夠與外界刺激產生響應。Ossipova等[12]以透明質酸為原料,通過巰基修飾與多種耦聯方式合成的鄰硝基芐基的連接體水凝膠可用作多種藥物的前體,控制光照條件可以改變其藥物釋放效率。
2 水凝膠的性能
2.1 生物相容性
生物相容性通常指生物材料與植入環境之間的相互作用,分為生物安全性與生物功能性。要求植入類材料不能對機體產生嚴重的排斥反應,對機體自身功能有幫助。細胞間粘附分子(cell adhesion molecules,CAM)[13]是細胞表面控制和促進與其他細胞相互作用的分子,天然水凝膠對CAM影響較小,合成水凝膠生物相容性相對較差,但通過改變本身材料種類及交聯方式可提高生物相容性。例如,利用靜電紡絲技術制備殼聚糖-明膠仿生支架[14]可以顯著提高生物相容性。
2.2 物理特性
2.2.1 結構強度 天然水凝膠交聯鏈段分布不均,網絡結構力學性能較差,一般水凝膠的斷裂能在10-1-100 J/m2左右[15]。通過人工合成制造高強度水凝膠,如使用納米蒙脫土等材料制造納米水凝膠,Okumura等[16]將利用α-環糊精(CD)制造滑動輪水凝膠等。滑動輪水凝膠由數個環糊精分子[17]構成的可滑動“8”字形交聯結構,受力時各鏈段相互滑動維持平衡起到滑輪效應[18]具有強大的抗應力效果,將其浸泡水中10 h以上形狀不變而質量可溶脹45倍以上,最大可拉伸為原長度的24倍,因此適合用作關節隔離支撐材料。
2.2.2 溫敏性 溫敏性材料能夠感知環境溫度變化而改變自身性質。溫度變化時,水凝膠鏈段上的親水、疏水集團與水分子之間氫鍵作用會發生變化,兩者相互競爭導致分子鏈在無規線團與卷球狀之間轉變,例如線性聚(N-異丙基丙烯酰胺)(PNIPAm)[19],在溫度較低時,聚合物的親水作用使溶質在水中均勻分布形成溶液,當溫度升高至32℃時,疏水作用大于親水作用,形成凝膠狀。
3 水凝膠在關節軟骨損傷中的應用
關節軟骨指覆蓋于關節連接處表面,由軟骨細胞、膠原、基質等物質組成,起到緩沖及潤滑作用的透明軟骨[20]。關節軟骨在關節運動中主要起到緩沖及分散壓力的作用[21],與關節囊分泌的滑液對潤滑關節,減輕磨損起到重要的作用。
3.1 水凝膠細胞支架在組織工程中的應用
關節軟骨相對孤立,缺乏血運,受損后難以自愈,組織工程的發展為關節軟骨修復提供了較好的契機。通過組織工程修復關節軟骨的關鍵在于選取合適的種子細胞、細胞因子及細胞支架,細胞支架材料需要為種子細胞提供接近關節軟骨細胞外基質(extracellular matrix,ECM)[22]的生長環境,這類材料要有較高孔隙率的物理形態[23]能夠為種子細胞提供分化增殖微環境。水凝膠類材料不僅具備上述條件,而且整合能力[24]良好。水凝膠植入物的生物相容性越好,與宿主組織結合完整性就越好,新生軟骨與宿主軟骨相似程度就越高。水凝膠高分子生物支架除了具備營養,便于細胞-支架黏附[25],生物相容性等基本屬性外,特殊的加工方式能使水凝膠具備足夠的強度,在一定應力下依然能維持自身結構的完整性,在關節這類受力較大的部位應用前景較好。
組織工程支架通常分為預塑形多孔支架材料與可注射性材料。前者強度較大,但設計與手術相對困難;后者易于操作,手術損傷小但本身強度較低,無法用作受力較大部位的修復。水凝膠的生物降解是指水凝膠在生物體內伴隨組織細胞的生長通過水解,酶解等途徑不斷排出,直到自身組織修復完成的過程。水凝膠降解受到交聯程度,交聯方式及包埋細胞的種類等因素的影響,降解速度需要與細胞合成分泌細胞外基質的速度相適應。
水凝膠細胞支架修復關節軟骨損傷的思路是針對軟骨缺損的面積大小,選取合適的種子細胞,在體外擴增后與支架結合,移植到軟骨缺損的部位。解光越等[26]選擇人臍帶Wharton膠來源間充質干細胞(MSCs)作為種子細胞,復合藻酸鈉水凝膠(Alg)作為細胞支架嘗試修復兔關節軟骨,實驗證明Alg+MSCs組明顯優于其他對照組。Stark等[27]嘗試將軟骨細胞種植在膠原基水凝膠上面,發現能夠提高軟骨細胞的活性。Silverman等[28]通過實驗還發現纖維蛋白凝膠可以促進軟骨生長。
3.2 水凝膠藥物載體在關節軟骨病變中的應用
傳統的給藥途徑受藥物半衰期的影響波動性較大。一般的藥物的釋放體系是載體與藥物制成一定劑型,在藥物起效的濃度下緩慢地釋放,從而維持有效的藥物濃度。目前在藥物緩釋方面研究較多的是DDS系統(經植入性藥物傳送系統)[29],該系統是由儲存藥物、控制釋放速度、驅動釋放3部分組成,適用于需要維持一定的藥物濃度的給藥系統,如肝癌患者的化療藥物治療等。
水凝膠具備多層次、多尺度的微細結構以及良好的親水性,吸收大量水分子后體積膨脹數倍,水分子包裹在網絡結構中使得水凝膠具有了一種流體的性質,適合于作為大分子藥物的控釋材料[3]。水凝膠藥物載體在緩釋的同時還可以保護蛋白分子不受外界有害因素的干擾,應用于上述DDS系統對藥物緩釋有較大意義。
類風濕性關節炎(RA)[30]是一種好發于手足小關節滑膜的自身免疫疾病,以軟骨與骨破壞為主。以兩親性聚合物溫敏性水凝膠結合甲氨蝶呤[31],在關節腔內注射可以起到短期內庫存藥物并緩釋,有助于減少頻繁給藥帶給患者的痛苦并降低感染風險。
骨關節炎(osteoarthritis,OA)是一種好發于全身承重關節的退行性病變[32],以關節軟骨破壞為主要表現。骨關節內(intra-articular,IA)給藥[33]通過選取具有良好安全性、生物相容性、可控釋放性等優良特性的水凝膠載體[34],將含有藥物的載體通過關節內注射的方式注入靶關節,達到高效的局部給藥[35]的效果。醫師還可以改變關節局部溫度或磁場等外界因素來調整水凝膠載體與藥物分子間的親和程度,從而控制藥物的釋放速度的作用來減輕藥物反應。
Matsuzaki等[36]研究發現,雷帕霉素-膠束(rapamycin-micelles-hydrogels)單位時間內藥物釋放率要低于對照組,說明這類水凝膠藥物載體具有緩釋性;KANG等[37]通過形成共價鍵的方式合成HA/PEG/KGN水凝膠,實驗證明這類水凝膠藥物載體具有保護關節軟骨延緩病情進展的作用。
4 水凝膠在關節置換手術中的應用
關節置換可以提高術后生活質量,但手術不可避免會對關節產生損傷,引起術后出血、疼痛,假體無菌性松動、負重界面磨損嚴重等一系列問題,為解決上述問題需要在術后應用鎮痛、止血藥物以及關節隔離支撐類材料來延長人工假體的使用時間。
4.1 關節置換術后止血
關節手術損傷較大,術中、術后容易出現失血較多的問題,時利軍等[38]發現在局部關節腔內注射氨甲環酸[39]、腎上腺素、止血凝膠等藥物混合制成的“雞尾酒”制劑可以有效降低出血。Aggarwal等[40]發現富含血小板血漿(platelet-rich plasm)與凝血酶及鈣離子結合形成的PRP凝膠能夠在減少術后出血的同時加快損傷組織的恢復。
4.2 關節置換術后鎮痛
選擇性COX-2抑制劑類藥物通過阻止致炎前列腺素的生成達到術后鎮痛的作用,在低疼痛刺激下,患者能夠積極地完成關節功能鍛煉促進膝關節功能恢復。通過將選擇性COX-2抑制劑類藥物分子與水凝膠藥物載體相結合,再將其注入關節腔中去起到長效抑制疼痛的效果,因為水凝膠載體可以緩慢地釋放藥物,可以起到長時間術后鎮痛的效果。
4.3 降低關節置換假體摩擦
關節置換后的人工關節假體缺乏關節軟骨,缺乏正常膝關節結構具有的緩沖和潤滑能力。Kamata等[41]科學家報道了使用聚乙二醇(PEG)改性制成水凝膠,其多孔、穩定的三維網狀結構特性適合儲存并緩慢地釋放關節液,使關節假體具有低摩擦,磨損低的良好性能。Gong等[42]研究發現,在負載存在的情況下,水凝膠網格體系中的水會分散到表面,增加潤滑層的厚度減少摩擦,因此水凝膠用作填充劑可以有效減少摩擦,降低損耗。
5 問題及不足
目前大多數水凝膠材料仍處于研究階段,大多技術不成熟。我國對水凝膠在關節慢性運動損傷與生物工程方面的研究較少。水凝膠在生物工程領域研究涉及生物工程、分子化學、材料學等多個學科,研究層面需要深入到組織細胞、分子層面,為實現水凝膠的臨床應用需要多學科的理論支持,如何將多學科的理論方法應用于特定的水凝膠材料并解決相關問題是目前亟需解決的問題。
天然水凝膠與合成水凝膠在生物相容性與機械強度方面各具優劣,應用于關節軟骨損傷修復的水凝膠應當同時具備較高的機械強度與良好的生物相容性,如何制備兼具上述優點并且性質穩定的水凝膠是目前亟需解決的問題。
6 總結與展望
本文回顧研究了各種水凝膠的發展、分類及自身特性,詳細闡述了不同關節慢性運動損傷情況下水凝膠的應用情況。未來的工作重心在于,進一步提高應用于關節損傷修復水凝膠系統的穩定性,水凝膠材料需要具備一定的機械強度,才能夠抵抗關節運動帶來的剪切力作用。應用于支架材料的水凝膠除了具有營養,生物相容性,利于細胞黏附等特性外,還要具備一定的智能性,便于注射及微創操作。現有的水凝膠材料無法具備上述的全部優勢,隨著各種新材料的不斷研發,會有更多優良性質的水凝膠材料應用在關節慢性運動損傷的治療中。

