人脂肪源性血管外膜細胞對CD34+造血干/祖細胞體外支持的實驗研究
周 芮,楊婷婷,張 磊,許 飛,鄭 波
(1.寧夏醫科大學,銀川 750004;2.寧夏人類干細胞研究所,銀川 750004;3.寧夏醫科大學總醫院血液內科,銀川 750004)
造血干細胞移植是治療多種難治性血液系統疾病的有效手段,造血干細胞與骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)共輸注成功促進體內造血重建已有報道[1]。大量研究[2-3]表明,BMSCs不但參與骨髓造血微環境構成,并能在特定條件下分化為造血基質細胞,產生具有多種調節造血作用的細胞因子從而改善造血微環境,促進造血干細胞/祖細胞(hematopoietic stem/progenitor cells,HSPCs)增殖分化。然而,BMSCs不易獲取,難以進行有效分離純化等問題影響了移植的療效。因此,尋找替代細胞將是再生醫學急需解決的問題。
血管外膜細胞(pericyte/perivascular cells,PCs)被認為是間充質干細胞的前體細胞,是一種沿著人體組織器官的小血管廣泛分布,且高表達CD146標記的細胞群[4-5]。研究發現,PCs與BMSCs不僅在組織再生和分化潛能等方面存在相似性[6],還能夠在血管發育和調節微循環穩態方面發揮重要作用[7-8],Corselli等[9]進一步發現,髓外脂肪組織來源的PCs能夠通過細胞間接觸激活Notch通路來重構異位造血微環境,從而支持免疫缺陷小鼠HSPCs移植后長期存活。脂肪組織是人體分布最為廣泛的組織器官之一,脂肪來源的細胞具有自我更新能力強和高增殖率的特點[10],并且能夠分泌多種支持HSPCs增殖和分化的正性因子[11-12],如胰島素樣生長因子-1和轉化生長因子-β1等,是相關造血細胞的理想來源。但人脂肪源性血管外膜細胞(human adipose-derived pericyte/perivascular cells,hAD-PCs)是否能夠體外支持UCB CD34+HSPCs生長國內尚未見報道,本文通過直接接觸共培養,探究hAD-PCs對UCB CD34+HSPCs在維持體外生長、造血細胞表面抗原表達及集落形成等方面的潛能,評估hADPCs對UCB CD34+HSPCs的體外支持效力。
1 材料與方法
1.1 細胞與試劑
大網膜脂肪標本來源于減重患者胃切除手術術中切除大網膜脂肪組織(n=5),臍血標本來源于寧夏醫科大學總醫院產科剖宮產手術足月新生兒(n=10),患者及家屬簽署知情同意書并獲得寧夏醫科大學總醫院倫理學委員會批準。成人骨髓間充質干細胞購自中國賽業生物。
淋巴細胞分離液購自美國GE公司;胎牛血清購自Biological Industries公司;高糖型DMEM培養基購自Gibco公司;紅細胞裂解液購自eBioscience公司;絲裂霉素購自Sigma公司;小鼠抗人CD45-APC-H7抗體、小鼠抗人CD34-APC抗體、小鼠抗人CD33-FITC抗體、小鼠抗人CD19-BV 621抗體、小鼠抗人CD10-PE抗體、小鼠抗人CD14-Alexa 700抗體均購自美國BD公司;MACS分選柱購自德國Miltenyi Biotec公司;各規格培養皿和培養板購自Corning美國公司;各規格離心管購自Thermo公司。
1.2 實驗方法
1.2.1 不同體系基質細胞與UCB CD34+HSPCs直接接觸共培養 通過酶解和多參數流式細胞術分選獲得hAD-PCs,詳見課題組前期建立的分離方法[13]。臍血通過密度梯度離心獲取單個核細胞,利用免疫磁珠分選得到UCB CD34+HSPCs。實驗組(hAD-PCs組)以hAD-PCs為基質細胞與UCB CD34+HSPCs共培養,陽性對照組(BMSCs組)以BMSCs為基質細胞與UCB CD34+HSPCs共培養,空白組(無基質細胞組)以UCB CD34+HSPCs單獨培養。基質細胞以1.5×104/孔細胞密度種植于96孔板,每組設5個復孔,待24 h基質細胞貼壁達80%用4μg·mL-1濃度的絲裂霉素處理2 h。絲裂霉素處理后24 h將UCB CD34+HSPCs以4×104/孔的密度分別加至預先處理hAD-PCs、BMSCs基質層上。
1.2.2 共培養后UCB CD34+HSPCs增殖情況 在共培養的1、2、4周時,倒置顯微鏡下觀察hADPCs組、BMSCs組及無基質細胞組細胞形態和細胞密度的改變。在各時間點收集懸浮的UCB CD34+HSPCs,清洗后細胞加入Tryple消化收集剩余UCB CD34+HSPCs,用臺盼藍拒染法進行細胞計數。
1.2.3 共培養后流式分析UCB CD34+HSPCs造血標記表達情況 在共培養的1、2、4周時,收集懸浮的UCB CD34+HSPCs,離心重懸后以每毫升體積細胞懸液與鼠血清體積比為20∶1進行30 min低溫封閉。封閉后將細胞分為樣本管、同型管及空白管加入相應的抗體:將總體積60%的細胞設為樣本管,加入各抗體(小鼠抗人CD45-APCH7抗體、小鼠抗人CD33-FITC抗體、小鼠抗人CD34-APC抗體、小鼠抗人CD10-PE抗體、小鼠抗人CD19-BV 621抗體及小鼠抗人CD14-Alexa 700抗體)1μL;總體積20%的細胞設為同型管,分別加入1μL小鼠抗人CD45-APC-H7、小鼠抗人CD33-FITC、小鼠抗人CD34-APC、小鼠抗人CD10-PE、小鼠抗人CD19-BV 621及小鼠抗人CD14-Alexa 700的相應抗體;空白管封閉后不加入任何抗體。樣本管及同型管加入抗體冰上孵育30 min,重懸后離心清洗殘余抗體后重懸至300μL上機檢測。因無基質細胞組細胞數持續減少,故不納入流式檢測。
1.2.4 共培養后UCB CD34+HSPCs集落形成情況分析 在共培養的1、2、4周時,收集懸浮的UCB CD34+HSPCs,用臺盼藍拒染法進行細胞計數。以1×103個/mL的細胞數將細胞吹打混勻于甲基纖維素半固體培養基中,將1 mL培養基接種于35 mm×10 mm的培養皿放置于37℃、5% CO2的培養箱內進行培養,各培養體系設置3皿。培養2周后倒置顯微鏡下觀察集落形態,大于200個細胞的細胞簇視為一個集落進行計數。因無基質細胞組細胞數持續減少,故不納入集落統計。
1.2.5 共培養后上清液細胞因子表達水平變化 在共培養體系建立的1、2、4周,將UCB CD34+HSPCs自96孔板中吸出,離心后將細胞上清液留置于1.5 mL無菌EP管中。標注培養體系、培養時間等信息保存至-80℃冰箱,ELISA法檢測IL-3、IL-6、TPO、SCF等細胞因子表達水平,因1例數據缺失故取4例共培養的上清液進行細胞因子表達水平統計。因無基質細胞組細胞數持續減少,故不納入因子分泌檢測。
1.3 統計學方法
數據采用SPSS 26.0軟件進行統計學分析。計量資料以均數±標準誤(x±Sx)表示。造血標記表達指標、集落單位形成數量和細胞因子表達水平的組間比較采用獨立樣本t檢驗,細胞數量三組比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。P≤0.05為差異有統計學意義。
2 結果
2.1 不同培養體系共培養后UCB CD34+HSPCs形態變化
倒置顯微鏡下觀察結果顯示:接種時(0周),hAD-PCs組、BMSCs組及無基質細胞組鏡下觀察上層細胞UCB CD34+HSPCs折光性良好,分界清晰(圖1A~C),hAD-PCs組及BMSCs組鏡下可見梭形生長的基質細胞存在(圖1A、B)。培養至1周鏡下可見hAD-PCs組及BMSCs組細胞密度增長,細胞仍透亮橢圓(圖1D、E),而無基質細胞組細胞密度明顯降低,形態改變折光性差(圖1F)。共培養至2周時,hAD-PCs組及BMSCs組UCB CD34+HSPCs細胞數量明顯增長,聚集生長,鏡下可見細胞透亮(圖1G、H),無基質細胞組細胞形態改變,胞質渾濁,鏡下可見密度降低(圖1I)。hAD-PCs組及BMSCs組細胞培養至4周時UCB CD34+HSPCs數量降低,細胞仍維持較好的形態(圖1J、K),無基質細胞組細胞全部死亡皺縮,喪失細胞正常形態(圖1L),與hADPCs組及BMSCs組細胞相比差異明顯。
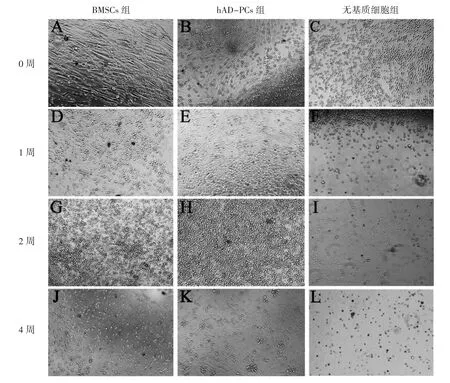
圖1 UCB CD34+HSPCs不同培養體系細胞及不同培養時間的鏡下表現(×100)
2.2 不同培養體系共培養后UCB CD34+HSPCs細胞數量分析
共培養接種當天(0周)各培養體系UCB CD34+HSPCs初始數量均為4×104個細胞。培養至1周時,hAD-PCs組及BMSCs組的UCB CD34+HSPCs細胞數少量增長,分別增長至(4.83±1.64)×104個細胞和(4.49±1.60)×104個細胞,無基質細胞組細胞大量死亡,細胞數為(1.47±0.27)×104個細胞,各組UCB CD34+HSPCs數量差異均無統計學意義(P>0.05)。共培養至第2周,hAD-PCs組及BMSCs組UCB CD34+HSPCs細胞數量達到高峰,分別為(5.93±1.45)×104和(5.91±0.79)×104個細胞,無基質細胞組細胞數減少至(0.35±0.10)×104個細胞,hAD-PCs組、BMSCs組共培養后的UCB CD34+HSPCs細胞數量均高于無基質細胞組(P均<0.05,n=5)。UCB CD34+HSPCs培養4周時,hAD-PCs組及BMSCs組UCB CD34+HSPCs數下降至(4.88±0.97)×104和(3.35±0.63)×104,無基質細胞組無細胞存活。hAD-PCs組及BMSCs組各時間點差異均無統計學意義(P均>0.05,n=5)。因第5周細胞全部死亡,故未行統計學分析(圖2)。

圖2 UCB CD34+HSPCs不同培養體系細胞數變化(n=5)
2.3 不同培養體系共培養后UCB CD34+HSPCs造血標記表達情況
經多參數流式細胞術檢測BMSCs組和hADPCs組的UCB CD34+HSPCs在1周、2周及4周的全血細胞表達CD45+標記、造血祖細胞表達CD34+CD33-標記、淋巴細胞表達CD10+/CD19+標記和髓系細胞表達CD14+標記(圖3A),經統計兩組細胞以上表面標記表達在各時間點差異均無統計學意義(P均>0.05,n=5)(圖3B)。

圖3 UCB CD34+HSPCs造血標記表達情況分析圖
2.4 共培養后UCB CD34+HSPCs集落形成情況分析
共培養1周、2周、4周的UCB CD34+HSPCs細胞種植于甲基纖維素半固體培養基培養14 d均有集落單位形成(圖4A),結果顯示,在1周、2周和4周UCB CD34+HSPCs形成的集落單位數量兩組比較差異均無統計學意義(P均>0.05,n=5)(圖4B)。
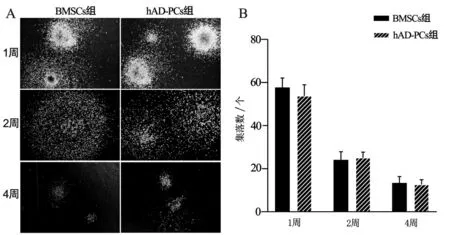
圖4 UCB CD34+HSPCs集落形成情況分析圖(n=5)
2.5 共培養后上清液細胞因子表達水平分析
采用ELISA法檢測BMSCs組和hAD-PCs組共培養上清液中細胞因子分泌水平結果顯示,hAD-PCs組的SCF在1周時和G-CSF在2周時表達量高于BMSCs組(P=0.008;P=0.002,n=4);hAD-PCs組的IL-2在2周時,VEGF、G-CSF和SCF在4周時表達量低于BMSCs組(P=0.01;P=0.04;P=0.02;P=0.004,n=4);IL-3、IL-6、TPO、IFN-γ及TNF-α表達水平兩組各時間點比較差異均無統計學意義(P均>0.05,n=4)(圖5)。

圖5 不同培養體系培養上清液中細胞因子表達水平統計圖(n=4)
3 討論
細胞治療在血液惡性疾病治療方面已取得了很好的療效,其中HSPCs移植已成為治療多種血液系統惡性腫瘤的理想方式[14-16]。BMSCs所組成的骨髓造血微環境是HSPCs賴以生存的基本功能單位,BMSCs分泌的細胞因子及造血細胞本身均參與造血穩態的調控[2]。研究顯示,BMSCs在良好培養條件下可通過細胞接觸和分泌可溶性因子模擬造血微環境,從而對HSPCs起到體外支持的作用[17-18]。因此,BMSCs被認為是目前促進造血基質細胞理想來源。但是在人體骨髓中105~106個單個核細胞中才能獲得1個BMSCs[19],并且因其缺乏特殊的表面標記難以有效分離純化,且經過體外培養得到的BMSCs常為混合細胞群,種種問題限制了其應用。為滿足臨床治療疾病的需要,分離純化和擴增出大量的造血基質細胞變得尤為重要。
PCs作為間充質干細胞的前體細胞,可在人體多種組織器官的周圍微血管和毛細血管被發現[5,9]。研究發現,髓外脂肪來源的PCs表達趨化因子-12和Notch通路關鍵配體Jagged-1,移植后可通過細胞間接觸和活化Notch信號來維持免疫缺陷小鼠的長期存活[9,20]。Pierantozzi等[21]已證明hAD-PCs與同來源間充質干細胞相比具有更好的分化能力。以上研究結果提示了hAD-PCs在造血方面應用具有廣闊的前景,hAD-PCs對于HSPCs是否具有與BMSCs相似的支持作用值得探討。大量研究表明BMSCs通過細胞接觸和分泌細胞因子在造血過程中起著關鍵作用[22-24],本研究在未額外添加TPO、SCF等造血促進因子的情況下,將hAD-PCs與UCB CD34+HSPCs直接接觸共培養,根據培養后UCB CD34+HSPCs細胞數量、造血細胞標記表達和集落形成能力等指標評估hAD-PCs作為基質細胞對UCB CD34+HSPCs的體外支持效能。
本研究通過檢測hAD-PCs和BMSCs作為基質細胞分泌的造血相關細胞因子來比較它們的分泌功能,結果表明hAD-PCs所分泌的部分細胞因子與BMSCs分泌水平存在異同。hAD-PCs組與BMSCs組IL-3、IL-6、TPO、IFN-γ及TNFα表達水平在培養的各時間點差異均無統計學意義。IL-3又被稱為多能集落刺激因子,在造血中期促進多能祖細胞向定向祖細胞分化;IL-6則通過抑制樹突狀細胞的分化參與MSCs的免疫調節[25],TPO在晚期造血中誘導巨核細胞形成成熟血小板的因子,另外,IFN-γ和TNF-α作為負性造血因子能夠與其他因子協同使其停留在細胞周期的靜止期,阻斷原始細胞進入細胞周期從而抑制造血[26]。hAD-PCs在促進HSPCs增殖分化及動員的細胞因子SCF(1周)和G-CSF(2周)在培養早期分泌量高于BMSCs,IL-2在培養第2周,VEGF、G-CSF和SCF在培養第4周的分泌水平低于BMSCs。研究顯示,GM-CSF、SCF、TPO和IL-3等細胞因子可通過快速增加靜止期細胞中的活性氧水平從而促進小鼠和人HSPCs的增殖[27];G-CSF還可刺激體外培養的造血前體細胞形成定向分化的細胞群[28],白細胞介素家族因子可直接作用于淋巴細胞和促進造血前體細胞分化成熟[25]。但以上細胞因子表達水平的差異宏觀表現在促進UCB CD34+HSPCs體外生長、形成集落單位能力和血細胞標記表達方面無統計學意義,表明多數細胞因子需要與其他細胞因子協同共同調節造血功能。其中,UCB CD34+HSPCs增殖結果顯示,隨著培養時間的延長,hAD-PCs作為基質層培養的UCB CD34+HSPCs細胞數量逐漸增高,在第2周達到高峰后開始下降,細胞增殖趨勢與BMSCs組細胞相同;無基質層滋養UCB CD34+HSPCs在培養全程細胞數持續下降,第4周全部死亡。結果表明hAD-PCs作為基質層在培養過程中能夠對UCB CD34+HSPCs具有體外支持的能力,進一步證實了Corselli等[9]提出的PCs具有體外維持HSPCs再生能力和自我更新潛能的結論。半固體細胞培養基培養集落形成單位的數量作為評價造血細胞增殖分化能力的重要指標,hAD-PCs滋養的UCB CD34+HSPCs在各時間點表達的全血細胞標記CD45+、造血祖細胞標記CD34+CD33-、淋巴細胞標記CD10+/CD19+和髓系細胞標記CD14+表達與BMSCs組相比差異均無統計學意義,并且以hAD-PCs為基質層和以BMSCs為基質層所培養的UCB CD34+HSPCs經體外培養均能形成集落形成單位,經統計分析集落數量各時間點差異無統計學意義。
綜上所述,hAD-PCs作為基質細胞與經典BMSCs相似,具有體外支持UCB CD34+HSPCs的潛能。本課題組后續將進一步探究hAD-PCs與BMSCs調控機制的異同,對于其臨床轉化作為BMSCs再生醫學治療的替代細胞提供理論依據。

