Nrf2基因敲除加劇單側輸尿管梗阻腎纖維化模型中巨噬細胞介導的炎癥損傷作用
吳存造,陸紅,朱恒悅,翁敏,施程浩,林周豪,白永恒
溫州醫科大學附屬第一醫院,浙江 溫州 325015,1.泌尿外科;2.檢驗科;3.浙江省胰腺肝臟危重性疾病診治新技術研究重點實驗室
氧化應激損傷是各種類型腎損傷的重要病理因素,可直接或間接地引起腎皮質固有免疫細胞活化及周圍組織、血管中大量炎癥細胞的浸潤。浸潤的炎癥細胞又可釋放炎癥介質,使腎皮質缺氧程度進一步加重,進而引起腎小管損傷、腎缺血和纖維化,形成惡性循環[1]。巨噬細胞是腎氧化應激損傷過程中重要的免疫細胞和炎癥細胞,其活化通過釋放誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等物質,誘導局部炎癥損傷,參與間質纖維化進程[2]。核轉錄因子Nrf2(nuclear factor erythroid 2-related factor 2)是機體重要的抗氧化應激損傷分子[3]。氧化應激損傷時,反應性氧代謝產物(reactive oxygen species,ROS)等可誘導Nrf2解耦聯,使之進入細胞核并與抗氧化反應元件(antioxidative response element,ARE)結合,激活下游多種基因的轉錄,從而發揮其抗氧化活性[4]。然而,Nrf2是否參與腎纖維化過程中的炎癥反應及影響巨噬細胞活化尚不十分清楚。本研究以臨床上常見的單側輸尿管梗阻(unilateral ureteral obstruction,UUO)誘導腎纖維化模型作為研究對象,通過分析Nrf2基因敲除后,巨噬細胞的活化及其調控機制,以明確抗氧化應激分子Nrf2在腎炎癥損傷和纖維化中的作用。
1 材料和方法
1.1 材料
1.1.1 動物:Nrf2(Nfe212)基因敲除小鼠(B6.129X1-Nfe212tm1ywk/J)購于南京大學南京生物醫藥研究院,動物許可證號為SCXK(蘇)2015-0001。野生型B6小鼠(C57BL/6)購于溫州醫科大學實驗動物中心,動物許可證號:SYXK(浙)2019-0009。所有實驗動物喂養程序嚴格按照溫州醫科大學制定的實驗動物保護條例執行。
1.1.2 試劑:PAS染色試劑購于上海碧云天生物公司;Masson試劑盒購于北京Solarbio公司;免疫組織化學試劑盒購于北京中杉金橋公司;抗CD68單克隆抗體購于美國Santa Cruz公司;iNOS試劑盒購于武漢Proteintech公司;干擾素調節因子5(interferon regulatory factor,IRF5)抗體購于美國Proteintech公司;TRIzol試劑購于美國Invitrogen公司;RNA反轉錄試劑盒購于日本Toyobo公司。
1.1.3 儀器:MyCycler梯度PCR儀購于美國Bio-Rod公司;7500 Fast定量PCR儀購于美國Applied Biosystens公司;Varioskan Flash全波長多功能掃描儀購于美國Thermo Scientific公司;DM4000B LED熒光正置顯微鏡購于德國Leica公司。
1.2 方法
1.2.1 實驗動物的分組和UUO模型的制備:將實驗小鼠分為:Nrf2野生型UUO組(Nrf2Wild-typeUUO)、Nrf2野生型假手術組(Nrf2Wild-typeSham)、Nrf2敲除型UUO組(Nrf2KOUUO)和Nrf2敲除型假手術組(Nrf2KOSham),每組6只。用10%水合氯醛成功麻醉小鼠,對腹部進行常規消毒后,取左側腹部切口,找到左腎下極并游離左側輸尿管,并于靠近腎盂處結扎左側輸尿管,隨后將腹內臟器復位后腹壁縫合。假手術組僅分離腎臟及游離輸尿管,隨即縫合腹壁。各組小鼠于術后7 d,取左腎組織用于后續實驗。
1.2.2 PAS染色檢測腎組織病理學改變:腎組織樣本取出后,使用4%多聚甲醛對其進行固定。腎組織經過脫水、透明、浸蠟、包埋等步驟后,切成4 μm厚組織切片,制備成石蠟切片。切片經過脫蠟、梯度乙醇后,通過PAS染色,最后使用中性樹膠封片。通過顯微鏡觀察腎組織皮質和髓質的病理學改變。
1.2.3 Masson染色檢測腎組織纖維化:脫蠟后4 μm的石蠟切片根據Masson試劑盒說明書進行實驗操作。使用蘇木素-三氯化鐵染核10 min,流水稍洗;鹽酸乙醇分化后,流水沖洗;氨水返藍,水洗;麗春紅酸性染液進行染色10 min,醋酸清洗1 min;1%磷鉬酸作用2 min,苯胺藍染色2 min;然后用95%乙醇分化30 s;脫水、透明、封片、鏡檢。在Masson染色之后,肌纖維為紅色,膠原纖維為藍色。Masson染色組織評分標準參照文獻[5]。
1.2.4 免疫組織化學染色檢測CD68和IRF5的表達:已制作的石蠟切片采用免疫組織化學鏈霉菌抗生物素蛋白連接的過氧化酶法進行染色。對CD68、iNOS和IRF5等一抗按1:200進行稀釋。常規脫蠟水化后,枸櫞酸鹽高溫進行修復抗原,以二抗相同來源的血清封閉。使用一抗稀釋液作為陰性對照,細胞核、細胞漿或胞膜出現黃褐色顆粒即為陽性表達。最后用Image-Pro Plus 6.0軟件分析每個視野下陽性表達區域的平均光密度值(累積光密度/分析面積)。
1.2.5 ELISA檢測iNOS的水平:取100 mg腎組織,充分勻漿溶解于1 mL的PBS液內,離心分離出上清液,制成100 g/L蛋白原液,根據試劑盒說明書,采用雙抗體夾心ELISA法,檢測樣品吸光度值,然后根據標準曲線計算樣本濃度。
1.2.6 Western blot檢測IRF5蛋白的表達:使用RIPA裂解腎組織,收集離心后的上清液,檢測蛋白濃度;制備12%聚丙烯酰胺分離膠和4%積層膠,樣品5×SDS上樣緩沖液,設置恒壓200 V,電泳60 min;設置恒壓100 V,濕法電轉移60 min;轉膜后的PVDF膜經5% TBST脫脂奶粉室溫封閉1 h;然后加IRF5一抗(1:1 000),于4 ℃搖床孵育過夜。隨后TBST清洗3次,加入二抗(1:5 000),室溫搖床孵育1 h,TBST清洗3次,加入ECL發光液孵育膜5 min,暗室壓片曝光,顯影定影后膠片保存。蛋白表達量以目標蛋白與內參蛋白條帶灰度值的比值表示。
1.2.7 qRT-PCR檢測炎癥基因mRNA表達:采用TRIzol法提取腎組織中的RNA,根據RNA反轉錄試劑說明書將其反轉錄為cDNA。設計小鼠IL-1β、IL-6、TNF-α mRNA特異性引物,以β-actin作為內參(由上海生工公司合成,見表1),進行PCR擴增,擴增體系為:5 μL 2×SYBR Green熒光定量試劑、2 μL引物(上、下游各1 μL,終濃度為200 nmol/L)、2 μL反應緩沖液,以及1 μL待測樣品cDNA。PCR反應體系為:95 ℃ 3 min預變性;95 ℃ 5 s,60 ℃ 35 s,反復40個循環。采用相對定量法計算得到數據,通過溶解曲線分析數據結果的可靠性。相對表達量=2-ΔΔCt,ΔΔCt=[Ct目的基因(待測樣品)-Ct內參照(待測樣品)]-[Ct目的基因(校正樣品)-Ct內參照(校正樣品)]。

表1 引物序列
1.3 統計學處理方法 采用GraphPad Prism 8.0軟件包對實驗數據進行統計學分析。計量資料以±s表示,多組比較采用單因素方差分析,兩兩比較應用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 敲除Nrf2加重UUO模型腎組織損傷和纖維化程度 PAS染色結果顯示,UUO組與假手術組相比,其腎小管明顯擴張,間質面積顯著增加,同時伴有炎癥性充血和水腫。Nrf2KOUUO組與Nrf2Wild-typeUUO組相比,其腎皮質區域小管擴增與間質炎癥水腫更為明顯(P<0.01),見圖1。Masson染色結果顯示,與Nrf2Wild-typeUUO組相比,Nrf2KOUUO組的腎組織膠原累積程度更為明顯(P<0.05),見圖2。
2.2 敲除Nrf2加劇UUO模型腎組織CD68陽性的巨噬細胞浸潤 免疫組織化學染色結果顯示,與Sham組比,UUO組的CD68的表達明顯增強(P<0.01);與Nrf2Wild-typeUUO組相比,Nrf2KOUUO組CD68的表達更為明顯(P<0.05),見圖3。深入分析顯示,炎癥型巨噬細胞標志物iNOS的表達在UUO中較Sham組高(P<0.01);與Nrf2Wild-typeUUO組比,Nrf2KOUUO組iNOS的表達水平更高(P<0.05),見圖4。
2.3 敲除Nrf2提高UUO模型腎組織炎癥因子的釋放 qRT-PCR結果顯示,與Sham組相比,UUO組術后炎癥因子IL-1β、IL-6、TNF-α mRNA的表達水平明顯升高(P<0.05)。深入分析顯示,Nrf2KOUUO組與Nrf2Wild-typeUUO組相比,腎組織中IL-1β、IL-6、TNF-α mRNA的表達水平更高(P<0.05)。見圖5。
2.4 敲除Nrf2促進UUO模型腎組織IRF5的表達Western blot結果顯示,與Sham組比,UUO組腎組織中IRF5的表達水平明顯升高(P<0.001),與Nrf2Wild-typeUUO組比,Nrf2KOUUO組腎組織中IRF5的表達更為明顯(P<0.01),見圖6。此外,免疫組織化學染色結果同樣證實,敲除Nrf2提高了UUO模型腎組織IRF5的表達水平(P<0.01),見圖7。
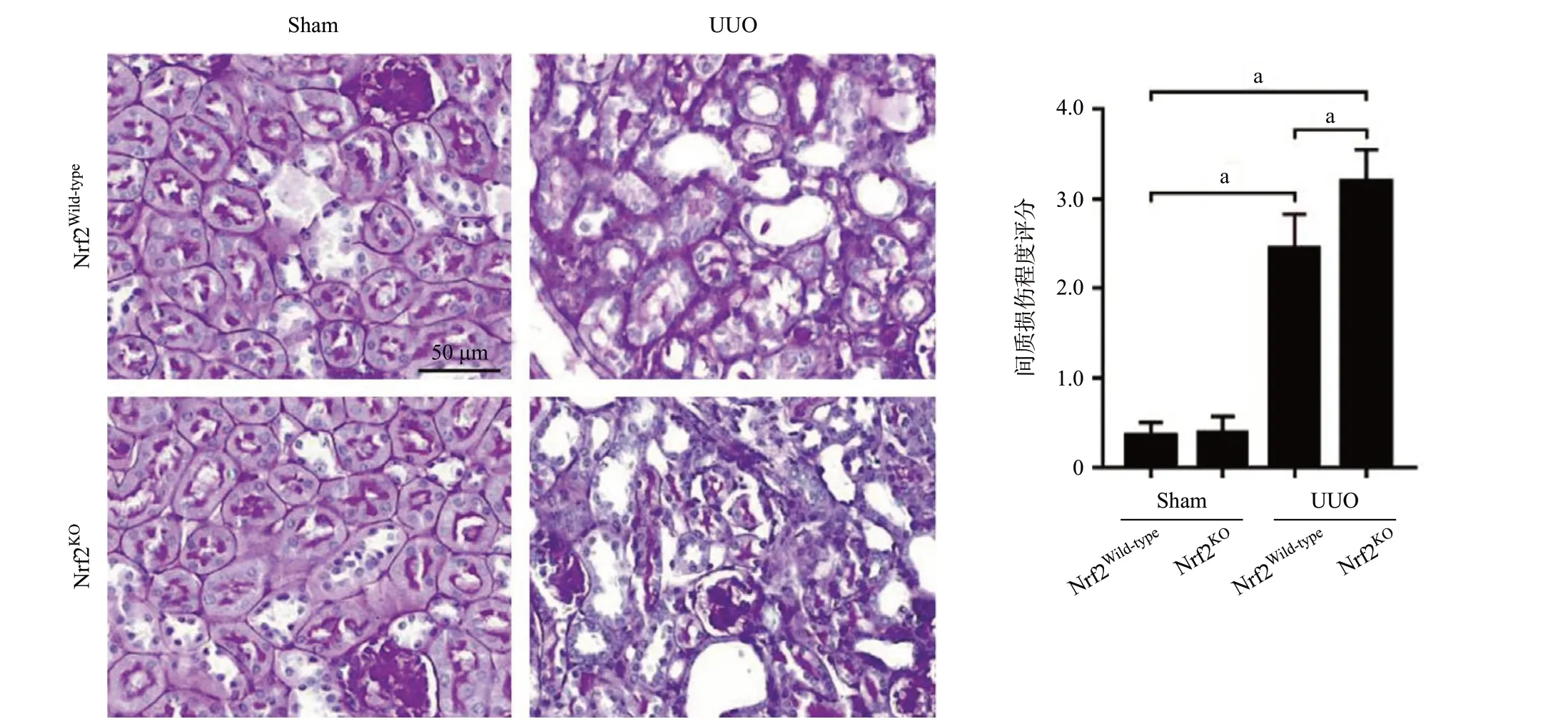
圖1 UUO模型中PAS染色顯示腎組織病理學改變(aP<0.01)
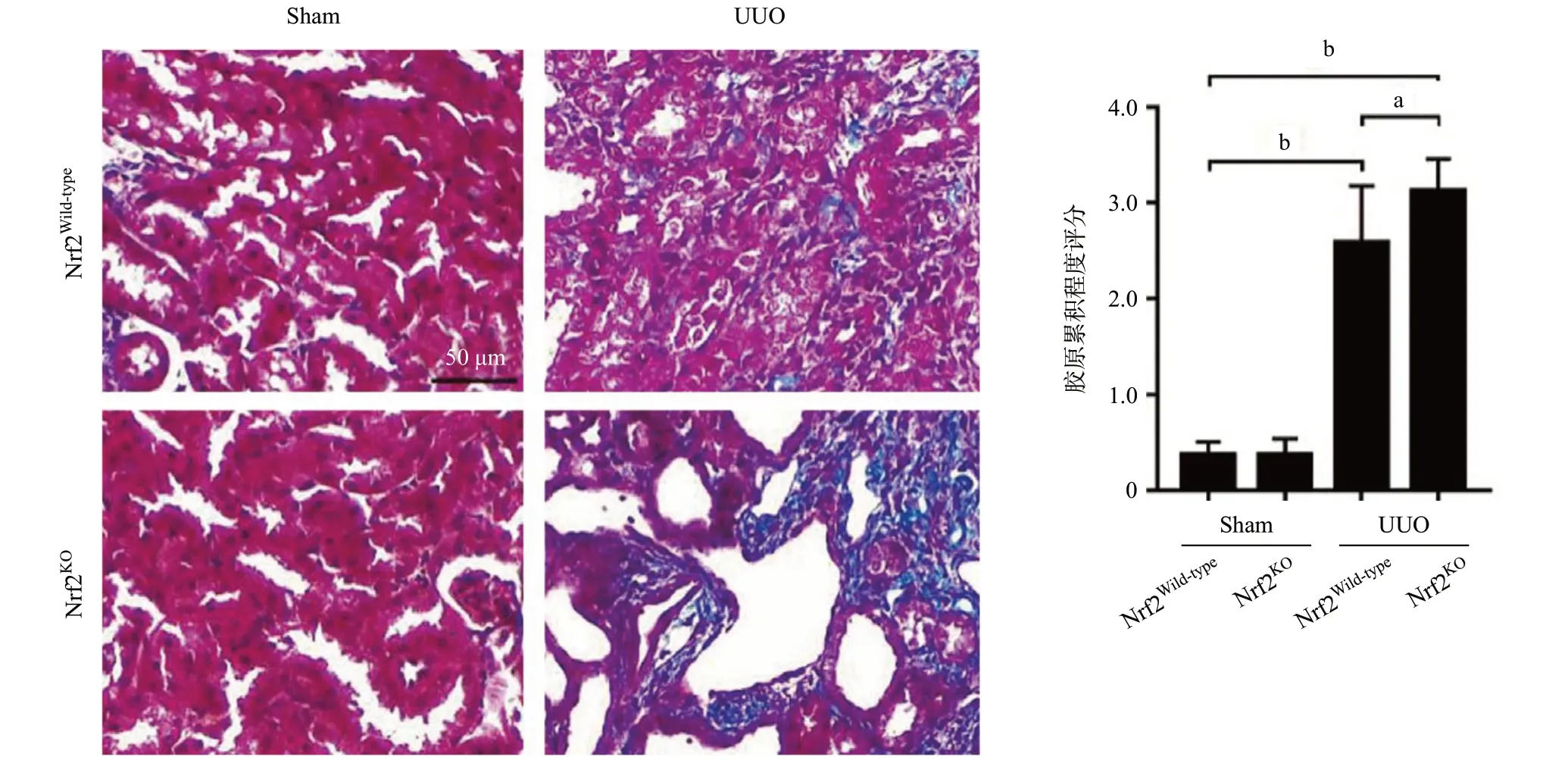
圖2 UUO模型中Masson染色顯示腎組織膠原累積程度(aP<0.05,bP<0.01)
3 討論
氧化應激是指體內氧化作用與抗氧化作用失衡的一種狀態。氧化應激損傷常常直接或間接地引起腎內不同類型細胞的損傷,從而導致了包括巨噬細胞在內多種炎癥細胞的浸潤和活化,從而加劇局部損傷程度。在此過程中,抗氧化應激信號可被激活,發揮拮抗氧化應激損傷的作用。Nrf2/ARE通路是機體十分重要的抗氧化信號。本研究發現在UUO模型中,腎組織局部炎癥損傷和纖維化病變,同時也伴隨著Nrf2的活性明顯升高。有研究也證實,在腎損傷過程中,Nrf2/ARE信號可被反饋性地活化,參與腎組織損傷與修復[6]。靶向敲除Nrf2不僅加劇了局部的氧化應激損傷,同時也可推動急性腎損傷向慢性腎纖維化轉變[7]。在缺血性腎損傷中,缺氧可誘導線粒體信號介導Nrf2水平下調,從而調控腎小管上皮細胞中HIF-1α的活化[8]。一旦恢復氧供應,Nrf2和HIF-1α相互作用,提供最佳的代謝方式,緩解局部氧化應激損傷[8]。因此,基于Nrf2具有潛在的腎損傷保護作用,開發誘導Nrf2活化的治療藥物是當下腎臟疾病新治療策略之一[9]。
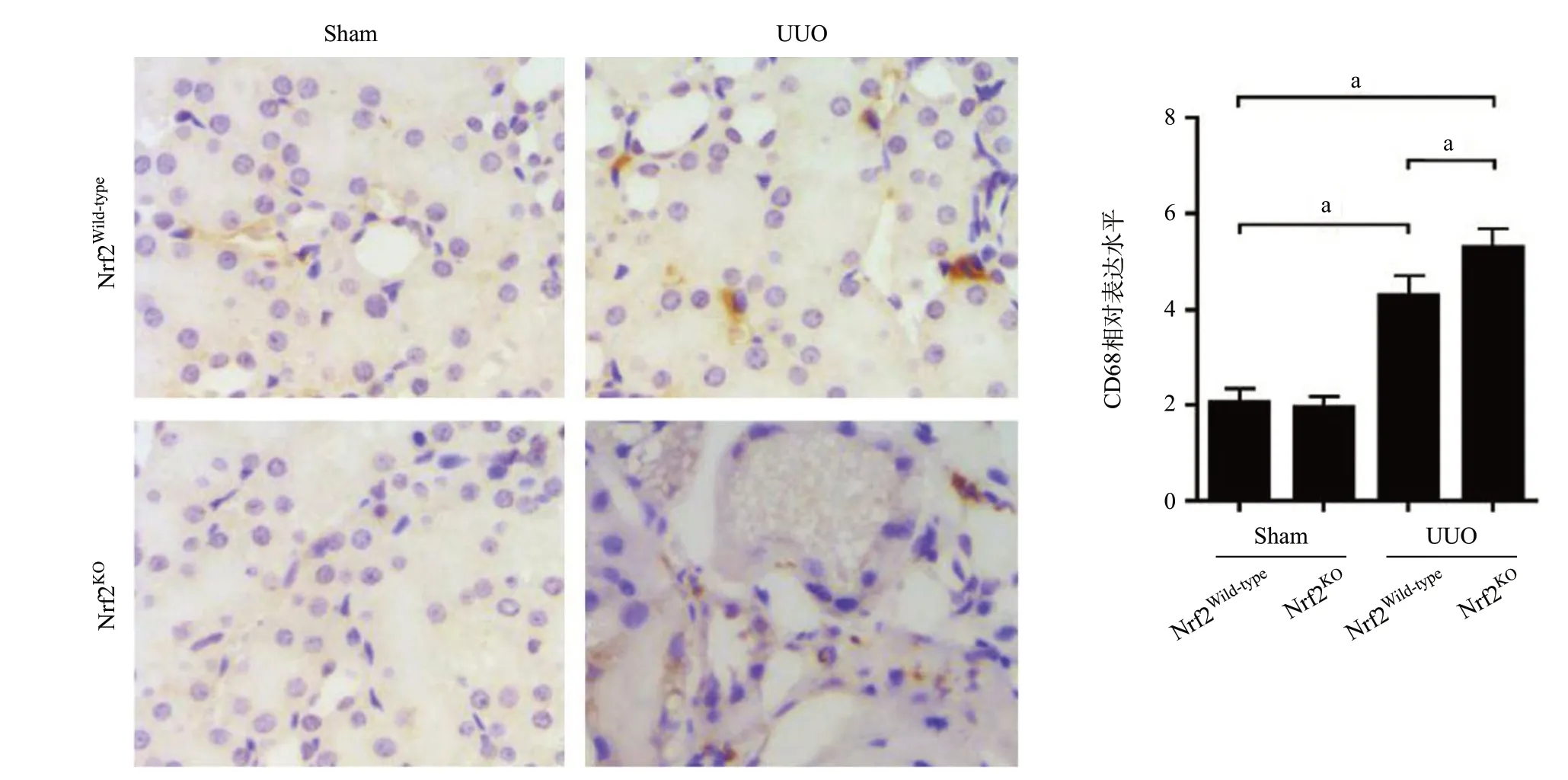
圖3 免疫組織化學染色檢測UUO模型中CD68的表達(aP<0.05,×400)
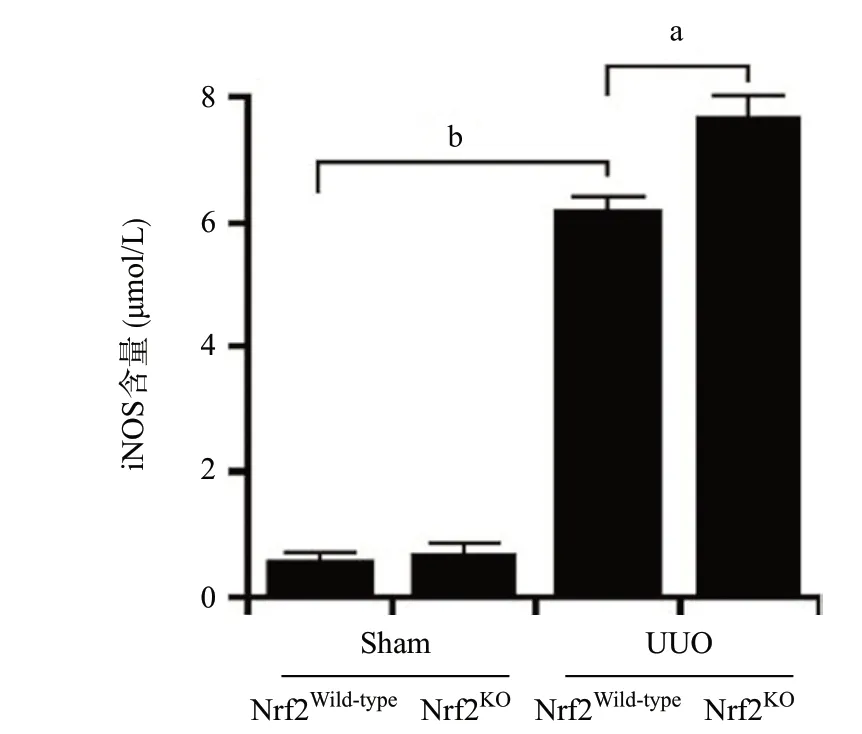
圖4 ELISA檢測UUO模型中iNOS的水平(aP<0.05,bP<0.01)

圖5 qRT-PCR檢測UUO模型中炎癥因子的釋放(aP<0.05)
在UUO腎纖維化模型中我們注意到,Nrf2的活化與巨噬細胞介導的炎癥損傷同時存在。本課題組前期研究表明,促炎型巨噬細胞的浸潤與活化是推動腎纖維化病變的重要誘因[10]。促炎型巨噬細胞可通過誘導TNF-α、IL-1β等炎癥因子的高表達,促進腎組織炎癥損傷,同時也可通過釋放MMP-9等細胞因子,誘導腎間質纖維化[11]。然而,Nrf2調控促炎型巨噬細胞活化的機制尚未完全明確。本研究發現,與Nrf2Wild-typeUUO組相比,Nrf2KOUUO組腎組織中CD68陽性的巨噬細胞的浸潤明顯增加,同時促炎型巨噬細胞標志物iNOS的表達也明顯增加。上述結果提示:敲除Nrf2加劇UUO模型腎組織促炎型巨噬細胞的浸潤和活化。
通過進一步研究,我們認為敲除Nrf2誘導促炎型巨噬細胞活化的機制可能是通過上調IRF5表達實現的。IRF5是維持巨噬細胞炎癥表型的一種關鍵轉錄因子[12]。研究發現,IRF5可促進Ly6C高表達的單核細胞分化為炎癥性CD11c+巨噬細胞,從而促進了腸道炎癥[13]。脂多糖可通過IRF5的介導,誘導炎癥型巨噬細胞活化,并促進TNF-α、IL-1β和IL-6等的釋放,引起神經系統炎癥反應。因此,IRF5可作為中樞神經系統炎癥性疾病的治療靶標[14]。我們的研究也發現,與Nrf2Wild-typeUUO組相比,Nrf2KOUUO組腎組織中IRF5的表達水平明顯增強,同時,炎癥因子TNF-α、IL-1β和IL-6的合成與釋放也明顯升高。這些證據支持了敲除Nrf2基因通過誘導IRF5介導的炎癥型巨噬細胞活化,促進炎癥因子表達和釋放,加劇了UUO腎纖維化模型中的炎癥損傷作用。
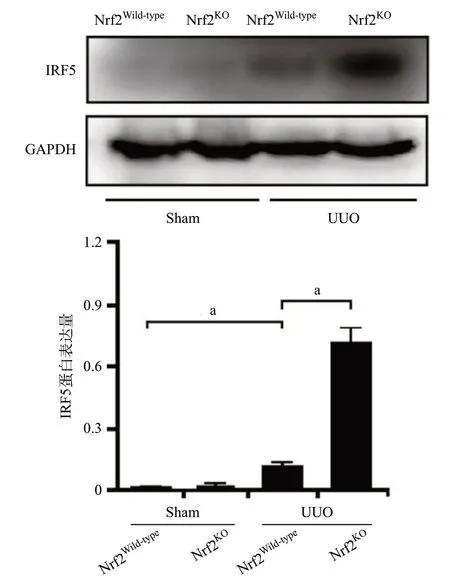
圖6 Western blot檢測UUO模型中IRF5的表達(aP<0.01)
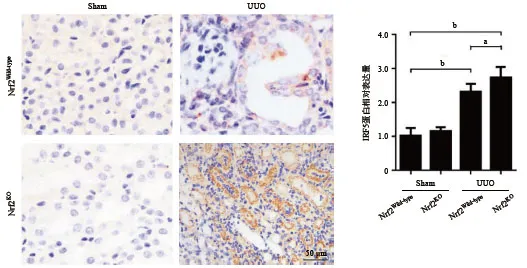
圖7 免疫組織化學染色檢測UUO模型中IRF5的表達(aP<0.05,bP<0.01,×400)
本研究也存在一些不足之處,沒有通過免疫雙熒光染色技術,分別對Nrf2及IRF5與CD68進行標記,從而明確炎癥型巨噬細胞作為Nrf2的靶細胞及其IRF5的調控作用,有待后續進一步研究。
綜上所述,在腎損傷與纖維化中,Nrf2基因敲除加劇UUO腎纖維化模型中的炎癥損傷作用。其機制可能與促進IRF5介導的炎癥型巨噬細胞浸潤,進而增加炎癥因子的合成與釋放有關。因此,Nrf2參與巨噬細胞活化機制的調控有助于從分子層面闡釋腎損傷與纖維化發生機制,同時也為腎損傷的臨床治療提供了一定的指導意義。

