犬細小病毒CPV-JL19株分離鑒定及遺傳進化分析
由海波,胡 博,王全凱,劉 昊,朱翔宇,張海玲,白 雪,徐 超*
(1.中國農業科學院 特產研究所 農業農村部經濟動物疫病重點實驗室,吉林 長春 130112;2.吉林農業大學,吉林 長春 130118;3.佛山科學技術學院,廣東 佛山 528000)
犬細小病毒(canine parvovirus,CPV)屬于細小病毒科、細小病毒屬,是家犬和多種野生食肉動物的常見病原[1]。CPV基因組由約5 200個核苷酸DNA分子組成,其中包含2個開放閱讀框(ORF)。其中一個ORF通過選擇性剪接相同的mRNA編碼2個結構蛋白(VP1和VP2),另一個ORF編碼2個非結構蛋白(NS1和NS2)。病毒衣殼為一個直徑約為25 nm的二十面體,由6個VP1和54個VP2組成[2]。構成衣殼的主要蛋白是VP2,VP2中幾個關鍵堿基和氨基酸的變化能夠改變抗原特征和宿主范圍。因此,目前大量研究均集中在VP2基因的進化,對非結構蛋白基因的研究有限[3]。并且與VP2基因序列相比,GenBank中可用的全基因序列相對較少。
1900年前后貓細小病毒(FPV)最早被發現,隨后經過多年環境變化與病毒進化,1978年前后演化出可以感染犬的CPV。CPV和FPV之間的氨基酸變化影響VP2蛋白與宿主細胞轉鐵蛋白受體(TfR)的相互作用,可能有助于CPV與家犬TfR結合的能力,因此被認為是犬類宿主轉移的決定因素[4-5]。在其出現不久后很快產生了兩種不同的抗原變體。其中CPV-2a于1979年出現,在VP2中共出現5個氨基酸取代(Met87Leu,Ile101Thr,Ala300Gly,Asp305Tyr,Asn375Asp);另一個是在1984年出現的CPV-2b,在VP2中增加了一個單獨的替代(Asn426Asp)[6]。隨后,新的變體出現在世界各地,包括New CPV-2a和New CPV-2b,每個都有多種氨基酸取代[7]。2000年,在意大利發現了另一種新的抗原變異,其特征是Asp426Glu取代,稱為CPV-2c[8]。相對于原始的CPV-2,CPV-2a、CPV-2b和CPV-2c的抗原變異型在犬中具有更高的致病性,并且宿主范圍擴大[9]。CPV原始型(CPV-2)迅速被其抗原變異體所取代,其進化速度接近RNA病毒[10],對疾病診斷和流行病學有很大的影響。
由于CPV的遺傳變異較快,目前的疫苗可能不能夠提供全面的保護。因此,進一步探究當前分離鑒定的CPV流行株的遺傳變異特性,為下一步制備有效的CPV疫苗提供適宜的疫苗株,這些對CPV的預防具有重要理論意義。本研究對吉林省長春市某動物醫院分離到的1株CPV進行鑒定,解析其遺傳變異規律及流行特性,為該地區CPV的預防、治療及疫苗研究提供理論依據。
1 材料與方法
1.1 臨床樣品及細胞株臨床樣品為吉林省長春市某動物醫院臨床表現為細小病毒病的犬肛拭子,并在中國農業科學院特產研究所進行分析。貓腎傳代細胞系(F81)由農業農村部經濟動物疫病重點實驗室保存。
1.2 主要試劑CPV單克隆抗體由農業農村部經濟動物疫病重點實驗室制備保存;熒光二抗購自Abcam公司;ExTaq聚合酶、dNTP、pMD18-T載體均購自TaKaRa公司;DNA提取試劑盒、膠回收試劑盒、DNA Marker均購自北京全式金生物技術有限公司。
1.3 病毒DNA提取與PCR鑒定取肛拭子浸泡液作為樣品,參照基因組提取試劑盒說明書提取病毒DNA,采用CPV鑒定引物進行PCR檢測。其引物序列P1:5′-GGATTTCTACGGGTACTTTC-3′;P2:5′-GGTGTGCCACTAGTTCCAGTAT-3′。P-CR擴增體系20 μL:模板1 μL,Ex Taq 1 μL,10×Ex Taq Buffer 2 μL,上、下游引物各1 μL,dNTP 1 μL,加ddH2O至20 μL。PCR擴增程序:94℃預變性4 min;94℃變性30 s,56℃退火30 s,72℃延伸90 s,共30個循環;72℃延伸10 min。PCR產物經1%瓊脂糖凝膠電泳鑒定。
1.4 病毒分離與培養無菌取肛拭子置1.5 mL EP管中于滅菌PBS(pH 7.2)內浸泡48 h,反復凍融3次,4℃、10 000 r/min離心10 min,取上清,經0.22 μm 濾膜過濾后,采用同步接毒的方式,在含5%胎牛血清的MEM培養液培養的F81細胞中接入全部處理后的病料上清,同時設正常細胞對照,于35℃、5% CO2培養箱中培養,每日觀察記錄細胞是否出現拉絲、脫落等典型病變(CPE),繼續盲傳3~5代,-80℃保存。
1.5 病毒形態學鑒定取分離毒株第5代細胞培養物10 mL于超濾管內,8 000 r/min離心20 min,取10 μL濃縮病毒液用0.1%磷鎢酸溶液進行電鏡負染觀察病毒的形態學特征。
1.6 血凝試驗在96孔V型血凝板上,每孔加pH 7.2的PBS 25 μL;第1排孔加入25 μL病毒液,依次進行倍比稀釋至11排孔并棄去25 μL,第12排孔為紅細胞對照;向各孔補加PBS 25 μL,每孔加入1%豬紅細胞懸液50 μL;將反應板輕輕振蕩搖勻1 min,置4℃ 60 min,以100%凝集(完全無淚珠樣流淌)的最高稀釋倍數為血凝效價。
1.7 間接免疫熒光試驗將F81細胞懸液鋪在6孔板中,同步接毒分離株病毒,36 h后棄上清液,用PBS洗3次;加入4%多聚甲醛固定30 min,PBS洗3次;加入0.5% Tristone,室溫10 min,PBS洗3次;加入5% BSA,37℃封閉1 h;加入1∶100稀釋的CPV單抗,37℃孵育1 h,PBS 洗3次;加入1∶100稀釋的FITC羊抗鼠IgG二抗,37℃避光孵育1 h,PBS清洗后加入終濃度0.1% DAPI,37℃避光感作5 min,在熒光顯微鏡下觀察。同時設未接種病毒的細胞做為陰性對照。
1.8 序列擴增及遺傳進化分析
1.8.1序列擴增 參考GenBank中CPV全基因組序列設計引物,分6個片段擴增CPV全基因組,引物序列見表1。PCR反應體系40 μL:模板 2 μL,Ex Taq Buffer 4 μL,dNTPs 2 μL,上、下游引物各2 μL,Ex Taq 聚合酶2 μL,加ddH2O至40 μL。PCR 反應程序:94℃預變性5 min;94C°變性30 s,55℃退火30 s,72℃延伸1 min,共30個循環;72℃延伸10 min。PCR產物經1%瓊脂糖凝膠電泳進行鑒定。

表1 引物信息
1.8.2測序及序列分析 PCR產物經膠回收后克隆入pMD18-T載體中,轉化至Trans5α感受態細胞后涂布于LB(Amp)固體培養基,37℃過夜培養,挑取平板上單克隆菌落于液體LB培養基中,經菌液PCR鑒定后,送生工生物工程(上海)股份有限公司測序。將所有片段利用DNAStar軟件進行序列拼接并上傳至GenBank。于NCBI網站在線Blast,將序列與GenBank數據庫中的序列進行比較,并通過DNAStar程序包的MegAlign程序對分離株序列與GenBank 發表的典型參考株進行氨基酸序列比對分析。利用Mega 5.0軟件,通過鄰接法構建完整編碼區的系統發育樹,分析分離株與其他毒株及疫苗株的進化關系。
1.9 動物回歸試驗選取4只3月齡健康比格犬,CPV抗體陰性,試驗組2只分別灌服第5代細胞培養液(TCID50為103/mL)30 mL,同時對照組2只灌服30 mL F81細胞培養液,隔離飼養,每日檢測動物體溫、體質量同時觀察實驗動物的臨床癥狀,每隔1 d采血進行血常規檢測。
2 結果
2.1 PCR鑒定結果對分離毒株的DNA進行PCR擴增反應,通過1%瓊脂糖凝膠電泳檢測,結果顯示在573 bp左右出現特異性條帶,與預期目的條帶大小一致(圖1)。
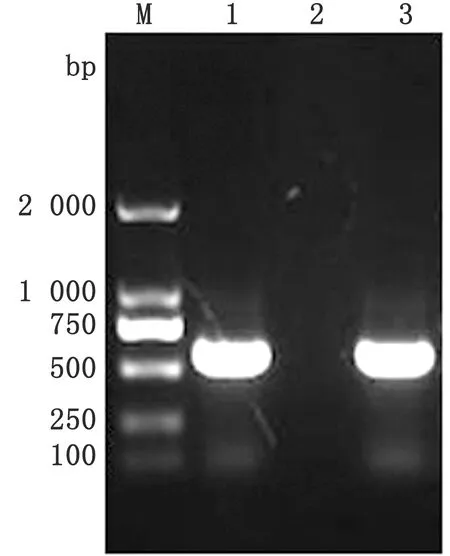
M.DL2000 DNA Marker;1.樣品;2.陰性對照;3.陽性對照
2.2 病毒分離采用F81細胞同步接毒的方法,從采集的肛拭子中分離到1株CPV,命名為CPV-JL19,與對照組F81細胞相比較(圖2A),接種CPV后的F81細胞出現拉網、變形及脫落等典型CPE(圖2B),而對照組細胞生長良好。
2.3 病毒形態學鑒定分離毒株第5代細胞培養物用0.1%磷鎢酸溶液進行電鏡負染觀察,可見圓形二十面體結構、直徑約20 nm、無囊膜的典型病毒樣粒子,與CPV的形態相符(圖3)。

A.接毒后的F81細胞;B.正常F81細胞

圖3 CPV-JL19 電鏡觀察病毒粒子形態
2.4 血凝試驗血凝試驗結果測得分離株第5代細胞培養物血凝特性穩定,其血凝效價為1∶29~1∶210(圖4)。
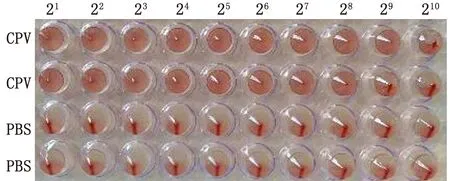
CPV和PBS,每個樣品2個重復
2.5 間接免疫熒光試驗接毒后36 h,F81細胞在熒光顯微鏡下可觀察到明顯的綠色熒光,對照組未接毒細胞在熒光顯微鏡下未觀察到熒光(圖5)。

A.CPV感染F81細胞;B.正常細胞
2.6 全基因組序列擴增及遺傳進化分析用分離株CPV-JL19的細胞培養物提取DNA,PCR擴增全基因組序列經瓊脂糖凝膠電泳鑒定,獲得與預期片段大小一致的目的基因(圖6)。對獲得的目的片段進行測序,將測序結果進行序列拼接,最終得到一段總長4 727 bp的序列,上傳至GenBank(登錄號:MN519258)。
使用DNAStar軟件SeqMan工具將測序結果與GenBank中已收錄的CPV全基因組序列進行對比,結果顯示,CPV-JL19株堿基序列與蒙古(5 MGL)、中國四川(SC/23/2017)和上海(CPV-SH1516)等地的分離株核苷酸同源性均較高,為99.9%,與CPV-2的同源性相對較低,為98.3%,與意大利(CPV_IZSSI)、巴西(CPV/Brazil)、中國北京(CPV-BJL3)和四川(CPV/SC)毒株的同源性分別為98.9%,98.4%,99.2%和99.8%(圖7),可以看出CPV-JL19株主要與國外分離株同源性較低,與國內四川、上海、北京等地的分離株同源性相對國外分離株較高。采用Mega 5.0軟件將此分離株序列與GenBank中部分CPV序列構建系統進化樹,分離株CPV-JL19主要位于國內分離株的分支群,與蒙古分離株處于一個小分支群,與中國四川、上海分離株親緣關系較近,與北京分離株相對較遠(圖8)。
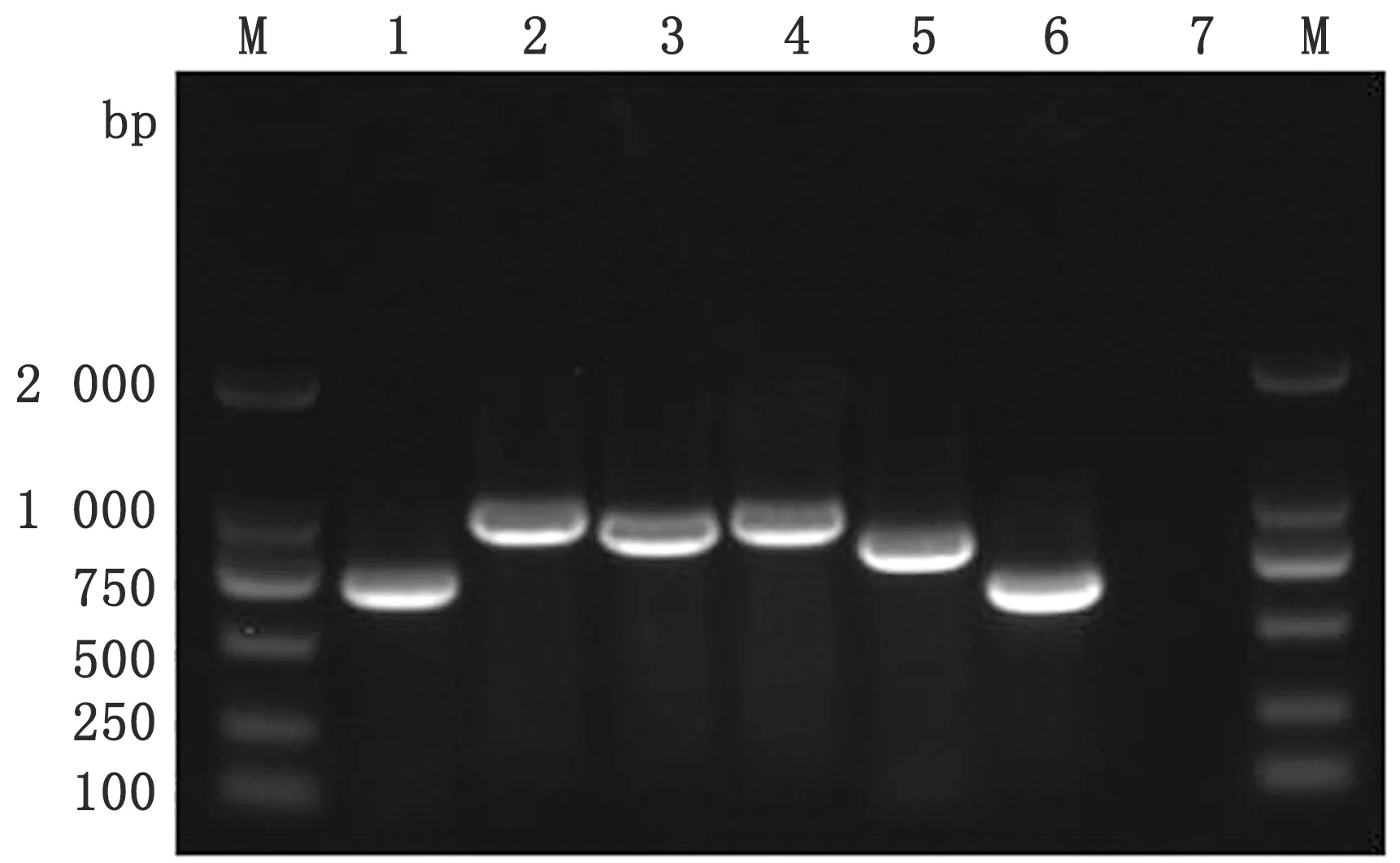
M.DL2000 DNA Marker;1.P1;2.P2;3.P3;4.P4;5.P5;6.P6;7.陰性對照

圖7 CPV-JL19分離株基因組同源性分析

圖8 CPV-JL19全基因組系統進化樹
2.7 VP2全基因氨基酸序列分析采用Mega 5.0軟件對分離株CPV-JL19 VP2基因的氨基酸序列與GenBank登錄的CPV VP2氨基酸序列進行比對,確定CPV-JL19為CPV-2c型。與北京CPV-2c型參考毒株(CPV-BJL3)相比第370位氨基酸由Gln→Arg,第440位氨基酸由Ala→Thr;與深圳分離株(Shenzhen-H1)相比,第48位氨基酸由His→Gln,第119位氨基酸由Asn→Val,第370位氨基酸由Gln→Arg;與國外分離株EC-08-2017(厄瓜多爾)相比,第139位氨基酸由Ile→Val,第267位氨基酸由Phe→Tyr,第324位氨基酸由Tyr→Ile,第370位氨基酸由Gln→Arg;與蒙古(5 MGL)、新加坡(M31-6)、中國四川(SC/18/2017)、中國上海(3-2-1-2016)等國內其他地區分離毒株無氨基酸位點變化(表2)。
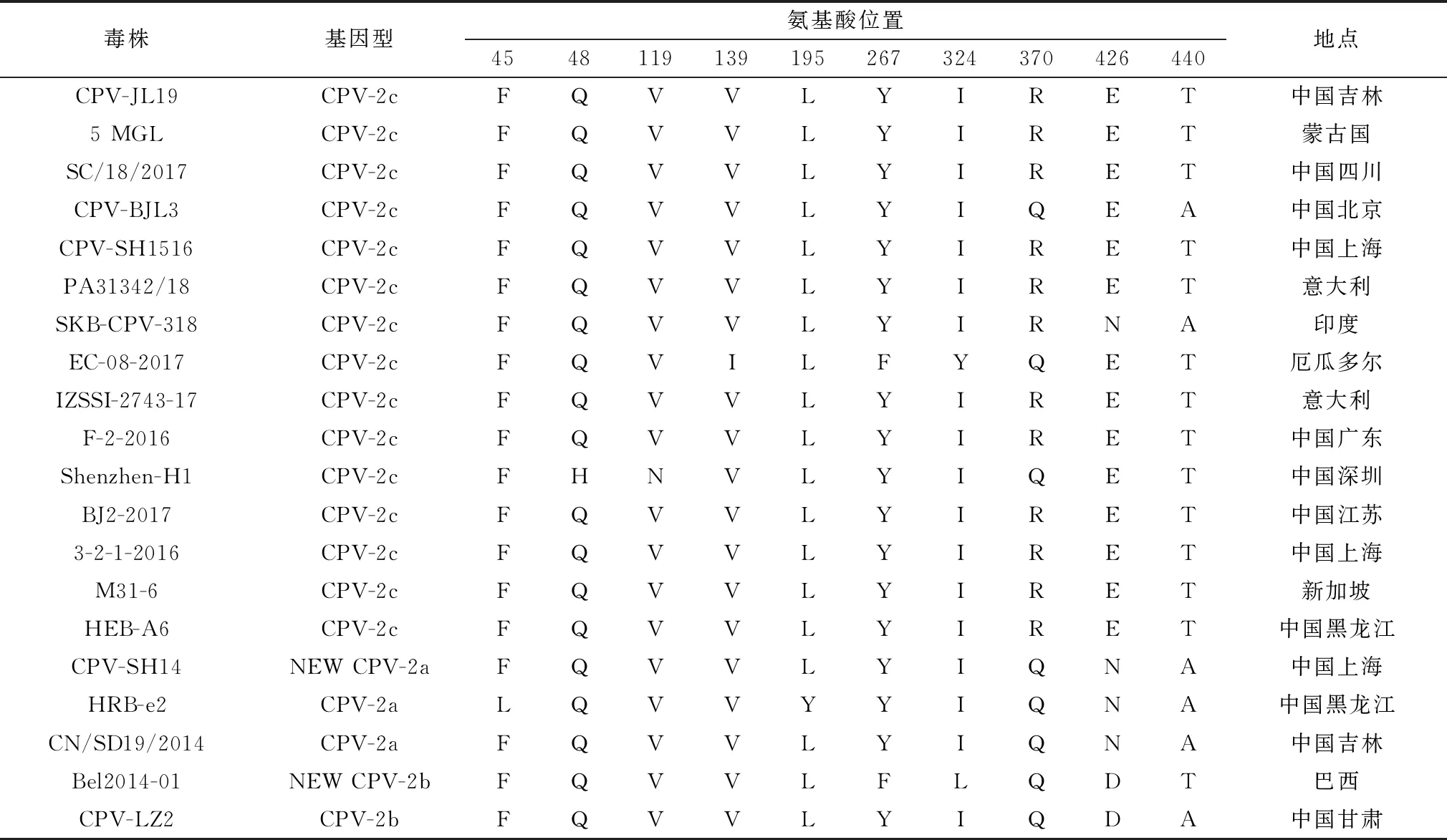
表2 VP2蛋白氨基酸序列的變異情況
2.8 動物回歸試驗用CPV-JL19分離株的第5代細胞培養物接種幼犬,6 d后開始發病,出現厭食、嘔吐、排稀便、體溫升高、體質量下降、白細胞數下降等典型臨床癥狀,隨后便血、脫水、絕食,最后攻毒組的2只犬全部死亡。病理剖檢發現尸體嚴重脫水,胃中無內容物,胃底黏膜出血,空腸和回腸局部充血、黏膜脫落,腸腔內有血樣糞便,腸系膜淋巴結腫脹等病理變化。而空白對照組無上述癥狀和病理變化。取血液樣品DNA進行PCR檢測,攻毒組核酸均為CPV陽性。
3 討論
本試驗成功分離得到1株CPV,通過PCR鑒定、電鏡觀察、間接免疫熒光、動物回歸試驗等鑒定方法及序列分析確定分離毒株為1株CPV-2c型強毒株,命名為CPV-JL19株,基因組全長4 727 bp,GenBank登錄號:MN519258。序列對比顯示,CPV-JL19株堿基序列與蒙古(5 MGL)、中國四川(SC/23/2017)和上海(CPV-SH1516)等地的分離株核苷酸同源性均較高,為99.9%。系統進化樹顯示,CPV-JL19株與蒙古分離株(5 MGL)處于一個小的進化分支。與蒙古國(5 MGL)、中國黑龍江(HEB-A6)等近期分離株無氨基酸位點變化。
目前,CPV-2c廣泛分布于歐洲(意大利、保加利亞、英國、德國、希臘、葡萄牙、瑞典和西班牙)、非洲(突尼斯)、亞洲(印度、越南)、大洋洲(澳大利亞)和美洲(美國、阿根廷和烏拉圭)[11-13]。2010年測序首次證實我國存在CPV-2c病毒[14],但2012年,亞洲才檢測到CPV-2c病毒[15],直到2014年我國分離并鑒定出CPV-2c病毒[9]。此后,南亞也檢測到CPV-2c病毒[16-18]。自2018年以來,在蒙古犬中CPV-2c亞型取代2b在抗原型中占據主導地位。并且在蒙古國的CPV-2c陽性樣本中檢測到3種不同的位點突變。而在相似的時間跨度內,從蒙古國和我國分離到的毒株序列也有驚人的相似性[19]。
我國目前CPV-2c主要在南方流行,在北方相對較少,在東北地區New CPV-2a占主導地位[9]。由于在未接種疫苗和接種疫苗的犬中均存在CPV的感染,這促使我們對目前我國流行的病毒變種進行描述和分離。CPV在我國的繼續發展,表明疫苗株可能需要調整以獲得最佳的抗感染保護,適當改變目前疫苗接種策略是十分必要的,因為田間株和疫苗株之間的毒株差異可能導致免疫失敗[20]。目前在世界范圍內現有的商業疫苗是基于CPV-2和CPV-2b的,雖然有幾項研究表明它們能夠交叉保護所有抗原類型[21-23]。但在接種CPV疫苗的犬只中,仍然存在出現臨床癥狀的犬[19]。我國目前可用的商業疫苗是基于CPV-2型的[9],而使用CPV-2型弱毒活疫苗的犬可能無法抵抗我國目前流行的CPV-2c病毒的感染。這也許可以解釋從未接種疫苗和接種疫苗的犬均能分離出CPV-2c病毒的原因。因此,在進一步檢測CPV-2疫苗對CPV-2c的有效性顯得非常重要。本研究為我國調整CPV疫苗株提供了依據。

