去甲基化酶KDM4B在牦牛卵泡發育過程中的表達
馬鴻程,熊顯榮,海 卓,閔星宇,郝振宇,李 鍵
(1.西南民族大學 畜牧獸醫學院,四川 成都 610041;2.青藏高原動物遺傳資源保護與利用教育部重點實驗室,四川 成都 610041;3.動物科學國家民委重點實驗室,四川 成都 610041)
牦牛(Bosgrunniens)主要分布于我國海拔3 000 m 以上的高原地區,其對低氧惡劣生存環境具有極強的適應性,是當地牧民生產生活的重要資源之一。然而牦牛產業發展相對緩慢,嚴重限制當地的經濟發展,其主要原因在于牦牛性成熟晚、繁殖周期長,繁殖性能較普通黃牛低下[1]。因此,開展牦牛繁殖方面的研究對豐富我國遺傳資源多樣性以及提高當地牧民的生活水平具有重要的價值。
卵巢是雌性牦牛重要的生殖器官,主要支持卵泡發育以及卵母細胞的生長和成熟[2]。包括顆粒細胞在內的多種體細胞通過間隙連接,在各種激素、蛋白質、細胞因子及卵泡內外環境的共同作用下直接或間接的參與卵泡發育[3]。與顆粒細胞中直接調節類固醇生成進而參與卵泡發育的相關分子相比,表觀遺傳通過間接方式在卵泡發育過程中起著必要的調控作用[4]。組蛋白賴氨酸甲基化修飾作為重要的表觀遺傳修飾方式之一,通過組蛋白甲基化酶(HMTs)和去甲基化酶(HDMs)相互協調作用于氨基酸殘基特定位點。組蛋白去甲基化酶家族由大約24個基因組成,可分為7個功能不同的亞家族。KDM4B是KDM4/JMJD2亞家族成員,該家族有KDM4A~KDM4E 5個成員[5]。KDM4B蛋白結構與KDM4A、KDM4C相似,均包含1個JmjC結構域、1個JmjN結構域、2個植物同源結構域(PHD)和2個Tudor結構域,其中JmjC結構域的酶功能依賴于α-酮戊二酸(α-KG)、Fe(Ⅱ)和分子氧作為去甲基化反應的輔因子,而JmjN結構域可以作為二聚體結構域并提供結構完整性[6-7]。牦牛KDM4B基因共編碼1 116個氨基酸[8],與KDM4亞家族的其他成員一樣,KDM4B可以將二甲基(me2)和三甲基(me3)賴氨酸脫甲基為單甲基(mel)狀態,對組蛋白殘基H3K9me3、H3K9me2、H3K36me3、H3K36me2、H4K20me2和H1.4K26me3均具有催化活性,其中H3K9me2/3是KDM4B的首選底物[9-10]。KDM4B在哺乳動物各組織器官中廣泛表達,尤其在卵巢、睪丸等生殖器官中高表達[11],研究發現KDM4B表達量在精子發生前增加同時H3K9me3顯著減少[12];另外KRIEG等[13]研究表明,卵泡細胞中KDM4B mRNA及蛋白表達與患者能否成功體外受精相關。提示KDM4B參與生殖過程調控。
目前關于KDM4B基因的研究主要集中在前列腺癌[14]、乳腺癌[15]等癌癥方面,在卵巢組織及其功能中的研究較少。而作為重要的去甲基化酶之一,KDM4B是否參與牦牛卵泡發育調控仍未知。因此,本研究以牦牛卵巢為對象進行免疫組織化學染色,分析KDM4B蛋白在卵泡發育進程中的表達定位,同時進行牦牛卵泡直徑大小與卵母細胞成熟率及卵泡細胞(卵母細胞、卵丘顆粒細胞及壁層顆粒細胞)中KDM4B mRNA表達量的相關性分析,為深入研究KDM4B基因在調控卵巢卵泡發育及卵母細胞減數分裂中的作用機制提供依據。
1 材料與方法
1.1 材料與試劑Trizol Reagent、Single Cell-to-CTTMKit微量RNA提取試劑盒購自美國Invitrogen公司;PrimeScrptTMRT Reagent Kit 反轉錄試劑盒、2×Phanta?Max Master Mix(Dye Plus)由南京諾唯贊提供;0.5%透明質酸酶(0.5 g透明質酸酶粉末、100 mL Medium199)、卵母細胞成熟液OM培養液(10%胎牛血清、Medium 199培養基)均購自賽默飛公司;1 mg/L促卵泡素(follicle-stimulating hormone,FSH)、1 mg/L促黃體素(luteinizing hormone,LH)購自Vetoquinol公司;1 mg/L 17β-雌二醇(17β-estradiol,E2);0.02 g/L丙酮酸鈉(C3H3NaO3)和0.03 g/L谷氨酰胺(glutamine,Gln) 均購自Sigma公司。
1.2 卵巢樣本采集卵巢樣本采自四川省廣漢市屠宰場。3~5歲健康雌性牦牛(n=9),屠宰后立即無菌采集卵巢組織,用含有雙抗(80 mg/L 青霉素和100 mg/L鏈霉素)的生理鹽水將采集到的卵巢沖洗干凈并隨機分為2組,1份用4%多聚甲醛固定液固定(用于后續免疫組織化學),另1份投入保溫瓶(含37℃生理鹽水、雙抗)中于3 h 內帶回實驗室。用37℃生理鹽水將卵巢沖洗數遍,根據卵泡直徑大小將卵泡分為大卵泡組(≥7 mm)、中卵泡組(3.0~6.9 mm)、小卵泡組(≤2.9 mm),共3組。用12號針頭注射器抽取卵泡液置于90 mm平皿,在體視顯微鏡下按組收集卵丘-卵母細胞復合物(cumulus-oocyte complex,COCs),部分在卵母細胞成熟液中沖洗數遍,0.5%透明質酸酶脫顆粒后分別收集卵母細胞(每組15枚)和卵丘顆粒細胞,其余COCs進行體外成熟培養。各組卵泡液離心后得到卵泡壁層顆粒細胞,用PBS洗滌數次后,-80℃保存備用。
1.3 牦牛卵巢組織中KDM4B的定位及表達取出固定于4%多聚甲醛固定液中的卵巢組織進行免疫組化法檢測KDM4B蛋白表達及定位。PBS洗凈固定液后進行浸蠟包埋制作成石蠟切片。染色前將切片置于60℃恒溫箱烘烤1~2 h后,依次使用二甲苯和乙醇脫蠟(6 min,3次),然后蒸餾水洗2次各5 min;3%H2O2于室溫中避光孵育30 min,以封閉內源性過氧化酶;再用pH7.4的PBS沖洗3遍后用5%胎牛血清封閉,滴加多克隆兔抗KDM4B抗體(BIOSS公司,100倍稀釋)4℃孵育過夜。PBS重復沖洗2次各5 min,后加多聚化山羊抗兔IgG于37℃孵育90 min;DAB(PBS 1 000 μL、DAB儲備液20 μL、3%H2O25 μL)顯色10~15 min;室溫下蘇木精復染30 s后進行脫水及透明,中性樹膠封片;顯微鏡下觀察拍照。以褐色或棕褐色判定為陽性細胞,顏色越深指示蛋白表達越強。
1.4 卵母細胞成熟培養在體視顯微鏡下選取結構緊密、細胞質均勻無皺縮,卵丘細胞致密的COCs,并用提前在培養箱中平衡10 h的OM培養液清洗2次。將包含GV期卵母細胞的COCs轉入平衡10 h的l mL OM成熟液中置于飽和濕度100%、二氧化碳5%的38.5℃恒溫培養箱中進行培養。連續培養24 h后用0.5%透明質酸酶脫顆粒,觀察第1極體排出率(以此標準來判定卵母細胞的減數分裂成熟)。
1.5 總RNA提取及反轉錄收集的卵母細胞嚴格按照Single Cell-to-CTTMKit試劑盒說明書合成cDNA,保存于―20℃備用。將卵丘顆粒細胞及壁層顆粒細胞嚴格按照Trizol法說明書步驟提取總RNA,核酸濃度儀檢測其濃度和D值后,選擇D值在1.8~2.0的RNA作為模板,按照TaKaRa公司PrimeScriptTMRT Reagent Kit反轉錄試劑盒說明書合成cDNA,-20℃保存備用。
1.6 引物設計及合成根據NCBI數據庫中GenBank所公布牦牛KDM4B基因的mRNA序列(MH510242.1)及GAPDH mRNA序列(AC-000162.1),利用NCBI(Primer-BLAST在線工具包)設計熒光定量引物,由南京金斯瑞生物科技公司合成,序列見表1。
1.7 牦牛KDM4B 基因在卵泡細胞中的表達以GAPDH作為內參基因,采用RT-qPCR方法檢測牦牛不同大小卵泡中卵母細胞、卵丘顆粒細胞及壁層顆粒細胞KDM4B mRNA的表達。將cDNA模板質量濃度調整一致(40 mg/ L),以保證數據準確。反應體系為15 μL:SYBR?Premix Ex TaqTMⅡ7.5 μL,上游引物0.5 μL,下游引物0.5 μL,ddH2O補足至15 μL。反應條件為:94℃預變性4 min,94℃變性45 s,59℃退火1 min,72℃延伸1 min,35個循環,72℃ 7 min。引物見表1,重復3次。
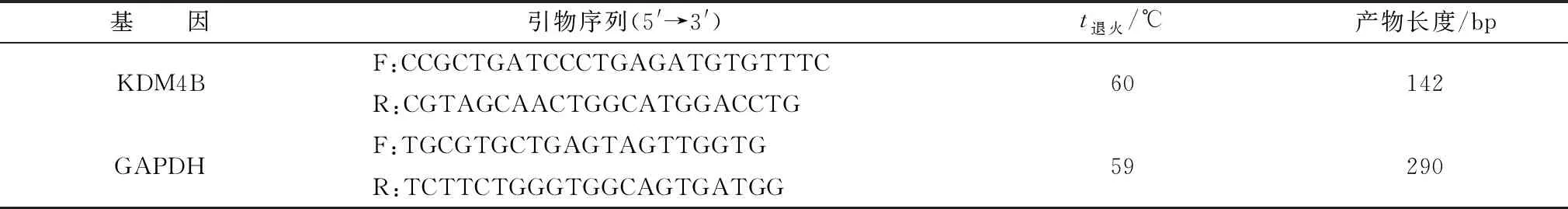
表1 引物信息
1.8 數據分析每組試驗重復3次,熒光定量結果用2-△△Ct均一化處理,采用SPSS 18.0軟件進行方差分析,ANOVA顯著性差異分析。P>0.05為差異不顯著,P<0.05為差異顯著,P<0.01為差異極顯著。
2 結果
2.1 KDM4B蛋白在牦牛卵巢組織中的表達與定位采用免疫組織化學方法檢測KDM4B蛋白在牦牛卵泡發育進程中的表達及定位。結果顯示,KDM4B蛋白在牦牛各發育時期卵泡中均有表達(圖1)。以褐色或棕褐色判定為陽性表達,主要見于牦牛原始卵泡(圖1A)、初級卵泡(圖1B)、次級卵泡(圖1C)、三級卵泡(圖1D)以及優勢卵泡(圖1E,F),其中優勢卵泡中呈強陽性表達。同時發現KDM4B蛋白主要定位于卵母細胞及顆粒細胞(GC),而卵泡膜細胞(TC)中表達量較少。
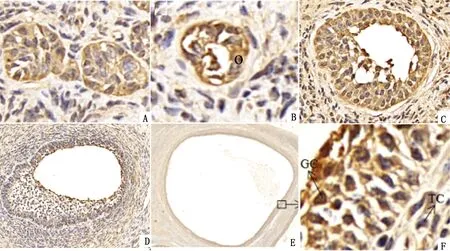
A.原始卵泡(×100);B.初級卵泡(×80);C.次級卵泡(×80);D.三級卵泡(×50);E.優勢卵泡(×50);F.E的局部放大(×100);GC.顆粒細胞;TC.膜細胞
2.2 卵泡大小與卵母細胞成熟率關聯性分析對各組卵泡中卵母細胞分別進行體外成熟培養,每組進行3次生物學重復并統計成熟率。結果顯示,卵母細胞卵丘擴展能力在小卵泡時期最差,中卵泡時期最強,而大卵泡中部分卵母細胞周圍的卵丘細胞致密度不如中卵泡時期。卵母細胞體外成熟率隨卵泡發育呈顯著上升趨勢,大卵泡組成熟率為91.30%、中卵泡組成熟率為85.77%、小卵泡組成熟率為63.51%。其中大卵泡組、中卵泡組成熟率顯著高于小卵泡組(P<0.05),但大卵泡、中卵泡組間成熟率差異不顯著(P>0.05)(表2)。

表2 卵母細胞成熟率
2.3 牦牛不同發育階段卵泡細胞中KDM4B mRNA表達分析以內參基因GAPDH作為參照,利用RT-qPCR方法檢測不同發育階段牦牛卵泡卵母細胞及其相對應卵丘顆粒細胞、壁層顆粒細胞中KDM4B基因的表達情況。結果顯示,KDM4B mRNA在牦牛不同發育階段卵泡細胞中呈動態表達(圖2)。隨著卵泡發育,卵母細胞中KDM4B基因表達量呈現下降趨勢,且中卵泡、大卵泡組卵母細胞中表達量顯著低于小卵泡組(P<0.05),但它們兩組間差異不顯著(P>0.05);不同組別卵泡中卵丘顆粒細胞與壁層顆粒細胞KDM4B基因表達量變化規律基本一致,即表達量隨卵泡發育程度呈現明顯的上升趨勢,其中,中卵泡、大卵泡組2種細胞中KDM4B表達量均極顯著高于小卵泡組(P<0.01),同時以各組別壁層顆粒細胞中表達量作為參照,卵丘顆粒細胞中表達量約為同時期壁層顆粒細胞中的2倍(P<0.01)。
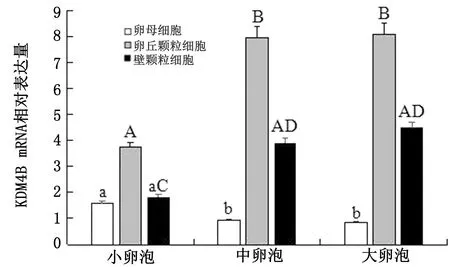
圖2 牦牛不同發育階段卵泡細胞中KDM4B mRNA的表達水平
3 討論
核小體被認為是染色質的基本重復單位,是由組蛋白H2A、H2B、H3、H4及DNA組成的八聚體。組蛋白通過包括甲基化在內的組蛋白尾部翻譯后修飾方式來調節DNA在轉錄機制中的功能。組蛋白賴氨酸甲基化是一個既能調節轉錄激活又能調節轉錄抑制的動態過程,在表觀遺傳中起著不可或缺的作用。研究表明,組蛋白去甲基化在DNA損傷[16]、造血干細胞維持[17]、脂肪代謝[18]及葡萄糖代謝[19]等多種生物學過程中發揮重要的調控作用。同時,去甲基化酶在生殖調控過程中扮演著重要的角色,如KDM1A通過在顆粒細胞及卵母細胞中的差異表達對卵泡發育起正向調控作用[20]。但目前關于KDM4B在雌性牦牛生殖調控中的作用研究國內外均未見報道。因此,探索KDM4B基因在牦牛卵泡發育中的表達模式對進一步研究組蛋白去甲基化在牦牛生殖中的作用機制具有重要意義。
本試驗通過免疫組織化學方法檢測了KDM4B蛋白在牦牛卵泡發育進程中的表達及定位,發現從原始卵泡到優勢卵泡的各發育階段中,KDM4B蛋白均有表達,其主要定位于卵母細胞及顆粒細胞,且表達強度隨著卵泡發育增加,發育至優勢卵泡時呈強陽性表達。KRIEG等[13]對體外受精患者的卵巢進行免疫組織化學檢測,發現KDM4B蛋白主要定位于各發育階段卵泡中的卵母細胞、壁層顆粒細胞(GCs)及卵丘顆粒細胞(CCs),且各時期卵丘顆粒細胞中的表達量高于其他卵泡細胞,這種動態的差異表達與卵母細胞能力密切相關。本試驗牦牛卵巢中KDM4B蛋白表達模式與其研究結果基本一致,提示KDM4B蛋白同樣在牦牛卵泡發育過程中發揮著重要的作用。
卵泡發育起始于胎兒時期,這是一個連續的、選擇性的過程,直到初情期后部分卵母細胞在卵泡內外環境共同作用下開始逐漸成熟并排卵[21-22]。卵泡發育程度以及顆粒細胞增殖分化對卵母細胞成熟率至關重要。本試驗首先對獲取于牦牛不同直徑卵泡中的卵母細胞進行體外成熟培養,發現隨著卵泡發育進程卵母細胞成熟率明顯上升,且小卵泡組成熟率顯著低于中卵泡組和大卵泡組。原因可能是成熟卵泡細胞中mRNA及蛋白儲存水平更高,顆粒細胞等卵泡細胞通過縫隙連接蛋白為卵母細胞提供更加良好的生長環境進而促進其發育成熟[3]。研究發現KDM4B通過調節相關生長轉化因子(如轉化生長因子-β/TGF-β等)的表達來激活通路,在顆粒細胞與卵母細胞相互調控中起著重要作用,進而影響卵母細胞發育成熟[23-24]。此外,KDM4B是雌激素依賴性基因表達的重要因素,同時有腔卵泡CCs中雌激素受體β(ER-β)表達量與卵母細胞成熟率呈正相關[25-26]。由此可知KDM4B可能對卵泡卵母細胞的發育具有一定的影響。
為進一步探究KDM4B基因在這一過程中的作用,本試驗運用RT-qPCR方法檢測了各組卵泡細胞中KDM4B mRNA的表達,結果表明其mRNA在各組卵泡卵母細胞、CCs及GCs中均有表達。其中卵母細胞中KDM4B mRNA表達趨勢與卵母細胞體外成熟率相反,即隨卵泡發育程度表達量呈下降趨勢,這可能與卵母細胞減數分裂進程恢復有關。研究發現隨著卵泡發育進程,卵母細胞減數分裂恢復,P53的表達在這一過程中逐漸升高[27],而LI等[28]發現干擾KDM4B表達會激活胃癌細胞中的P53,推測KDM4B作為P53的負調節因子而促進卵母細胞減數分裂成熟。因此卵母細胞中KDM4B表達隨卵泡發育而下降,減數分裂恢復使大卵泡中卵母細胞成熟率最高。隨著卵泡腔的形成,顆粒細胞逐漸分化形成直接包繞在卵母細胞周圍的CCs及緊貼著腔壁的GCs[29]。本試驗結果發現各組卵泡CCs、GCs中KDM4B表達規律一致,均隨卵泡發育呈明顯的上升趨勢。研究已證實顆粒細胞表面的雌激素受體(ER)及雄激素受體(AR)分別與雌激素和雄激素結合,對顆粒細胞的增殖分化起正向調控作用。同時KDM4B是ER信號轉導級聯的主要調節劑,其還通過抑制AR泛素化來增強AR蛋白的穩定性[25,30]。另有研究發現,低氧誘導因子HIF-1α在小鼠不同發育階段顆粒細胞中均有表達,且表達量隨卵泡發育增強[31]。同時POLLARD等[32]研究表明KDM4B是由HIF-1α從位于轉錄起始位點上游約500 bp的缺氧反應原件(HRE)直接誘導的。因此,顆粒細胞中KDM4B在核激素受體及HIF-1α的作用下調節顆粒細胞增殖分化,隨顆粒細胞增多進而促進卵泡發育及卵母細胞成熟。此外本研究發現,各組CCs中KDM4B相對表達量均高于同組GCs。研究表明與GCs相比,CCs在卵母細胞發育過程中提供了更多的營養,CCs缺失會嚴重影響卵母細胞的成熟[33-34]。推測KDM4B在CCs中表達量更高是由于其在CCs與卵母細胞間的分子交換過程中起著更加關鍵的作用,具體調節方式有待進一步驗證。綜上,KDM4B對卵母細胞及顆粒細胞有著不同的調節機制,通過促進卵母細胞減數分裂及顆粒細胞增殖分化進而參與卵泡發育調控。
本試驗首次通過免疫組化法及RT-qPCR法檢測了KDM4B在牦牛卵泡發育進程中的表達。結果顯示,KDM4B蛋白在牦牛卵泡各發育階段均有表達,其中優勢卵泡表達信號最強。不同大小卵泡卵母細胞中KDM4B mRNA表達趨勢與體外成熟率相反,隨著卵泡發育其表達量明顯下降。顆粒細胞中KDM4B mRNA表達隨卵泡發育呈上升趨勢。表明KDM4B基因參與卵泡發育調控,在卵母細胞減數分裂成熟及顆粒細胞增殖分化中發揮重要作用,具體調控機制有待進一步研究。

