環狀RNA hsa_circ_0070421對甲型流感病毒復制的影響
張玳寧,于秀華,張 舒,段 銘*
(1.吉林大學 動物醫學學院 人獸共患病研究所 人獸共患病研究教育部重點實驗室,吉林 長春 130062;2.吉林大學 第一醫院,吉林 長春 130021)
環狀RNA(circular RNA,circRNA)是近些年才發現的一種新的內源性非編碼RNA,具有獨特的閉合環狀結構,由前體mRNA反向剪接產生[1]。大約40年前,這些環狀轉錄本被認為是mRNA剪接的副產物[2],但隨著RNA測序技術的發展,現在已發現數以千計的circRNA。已有的研究結果表明,circRNA表達具有較高的組織特異性和發育階段特異性,且在基因表達調控中具有重要的生理功能[3],在癌癥、心血管疾病、中樞神經系統疾病等生理病理進程中扮演了重要的角色。
甲型流感病毒(influenza A virus,IAV),屬于正黏病毒科,單股負鏈RNA病毒,對人類及動物的生命健康具有重大危害,但是宿主編碼的circRNA在IAV與宿主細胞相互作用中的功能及其機制尚不清楚[4]。本實驗室前期基于基因芯片技術分析circRNA在IAV感染A549細胞中的表達,發現hsa_circ_0070421的表達顯著上調[5]。本研究探討了hsa_circ_0070421在IAV感染過程中的表達及其功能,研究結果有助于認知circRNA在IAV與宿主相互作用中的作用。
1 材料與方法
1.1 主要試劑聚肌苷酸胞苷酸(Poly I:C)和大腸桿菌O55:B5的脂多糖(LPS)購自Sigma-Aldrich公司;Cisplatin購自MedChem Express公司;超純瓊脂糖凝膠(UltraPure Agarose)購自Invitrogen公司;抗IAV-M1抗體購自Abcam公司;抗β-actin抗體購自Cell Signaling公司。
1.2 細胞培養A549和THP-1細胞在含有10%胎牛血清(FBS)(HyClone)和100 U/mL青霉素和100 mg/L鏈霉素的RPMI-1640(Corning)中培養;將MDCK、A172、Caco-2和SH-SY5Y細胞維持在含10% FBS的DMED(Corning)中培養,并置于37℃、4%CO2培養箱中生長。
1.3 病毒和病毒感染將流感病毒株A/PR/8/34(H1N1)在11日齡雞胚尿囊腔中增殖。用PBS洗滌細胞,并用感染復數(MOI)=3的病毒與含有1 mg/L TPCK處理的胰蛋白酶(Sigma-Aldrich)的培養基一起孵育1 h,吸附后,吸出上清液,將細胞培養指定的時間。
1.4 細胞處理A549細胞鋪24孔板,次日細胞密度達到60%~80%,分別加入LPS和Cisplatin,使其終質量濃度分別為1 mg/L和10 μmol/L,24 h后提取總RNA。
1.5 質粒、siRNA和轉染基于pHB-circBasic載體(HanBio)構建hsa_circ_0070421的真核表達質粒[5]。抑制hsa_circ_0070421表達的siRNA由上海吉瑪公司合成,序列為5′-GCUGCACAGGAUAACCACCTT-3′,根據Lipofectamine RNA-iMAX試劑(Invitrogen)說明書進行轉染。質粒和Poly I:C的轉染按照Lipofectamine LTX reagent轉染試劑(Invitrogen)使用說明書進行。以6 孔板為例:用250 μL Opti-MEM基礎培養基將所需量轉染試劑稀釋、混勻后靜置5 min,用250 μL Opti-MEM基礎培養基將所需要的質粒或poly I:C稀釋,混勻后靜置5 min,然后將處理好的轉染試劑和質粒1∶1混勻,靜置10 min后將混合液加入到培養板中,細胞置于CO2細胞培養箱中繼續培養。
1.6 RNA的提取、實時熒光定量PCR(qPCR)和半定量RT-PCR使用TRIzol試劑(Invitrogen)提取細胞總RNA,按照TaKaRa反轉錄試劑盒說明書進行反轉錄,反轉錄前42℃ 2 min反應,去除基因組DNA。RNA反轉錄的反應條件:37℃ 15 min,85℃ 5 min。取1 μL反轉錄產物使用FastStart Essential DNA Green Master(Roche)進行實時熒光定量PCR,反應程序:95℃ 10 min預變性;95℃ 10 s,60℃ 15 s,72℃ 20 s,共40個循環。對于半定量RT-PCR,反應條件:94℃ 5 min預變性;94℃ 30 s,60℃ 30 s,72℃ 30 s,共35個循環。均以GAPDH為內參基因,引物序列見表1。PCR產物通過1.5%瓊脂糖凝膠電泳檢測,電泳條件為電壓100 V,10 min,在凝膠成像儀(UVP EC3 Imaging System)上觀察結果。

表1 PCR引物序列及擴增片段長度
1.7 空斑試驗將MDCK細胞以2.5×105個/孔的密度均勻鋪于12孔細胞培養板中,加入梯度稀釋的細胞培養上清,37℃孵育2 h,棄掉上清,加入1%的超純瓊脂糖凝膠,在37℃、4%的培養箱中培養2~3 d后,利用結晶紫進行活細胞染色,統計空斑數量,計算獲得病毒樣品的感染性滴度(PFU/mL)=(每孔平均空斑個數×病毒稀釋倍數)/每孔病毒接種量(mL)。
1.8 蛋白提取和Western blot收集處理后的A549細胞并提取總蛋白,在10% SDS-PAGE凝膠中加樣電泳,每組含等量蛋白樣品。電泳后轉膜至PVDF膜,在5%脫脂奶粉中進行封閉。按照抗體說明書制備一抗IAV-M1和β-actin,在4℃冰箱內與膜孵育。二抗孵育后,利用 ECL化學發光顯色(Pierce),通過 ECL 化學發光成像系統采集信號,用 Image J 軟件對電泳圖進行灰度值的分析。
2 結果
2.1 IAV感染后宿主hsa_circ_0070421的表達顯著上調前期circRNA組學數據提示hsa_circ_0070421與IAV感染密切相關。用收斂引物和分散引物分別擴增cDNA和基因組中的hsa_circ_0070421,結果cDNA中的hsa_circ_0070421為環狀結構(圖 1A)。取IAV感染不同時間點樣品用熒光定量PCR方法再次驗證,結果IAV感染A549細胞后宿主hsa_circ_0070421的表達隨感染時間的延長逐漸增加,在感染后24 h表達量最高(圖 1B),而不同MOI 的IAV感染A549細胞后hsa_circ_0070421的表達與病毒感染劑量呈顯著正相關(圖 1C),說明hsa_circ_0070421的表達與IAV感染復制密切相關。選取不同器官或組織來源的5種人源細胞系,應用半定量RT-PCR檢測其hsa_circ_0070421的表達水平。結果如圖 1D所示,hsa_circ_0070421在研究選取的細胞系中表達水平有所差異,除Caco-2外,其他4種細胞系中均可檢測到該circRNA的表達,且表達量高低與病毒M基因的表達呈正相關。以上結果表明,hsa_circ_0070421的表達即呈現出細胞類型的廣泛性,也兼具特異性,并且其表達量與IAV的感染復制密切相關。
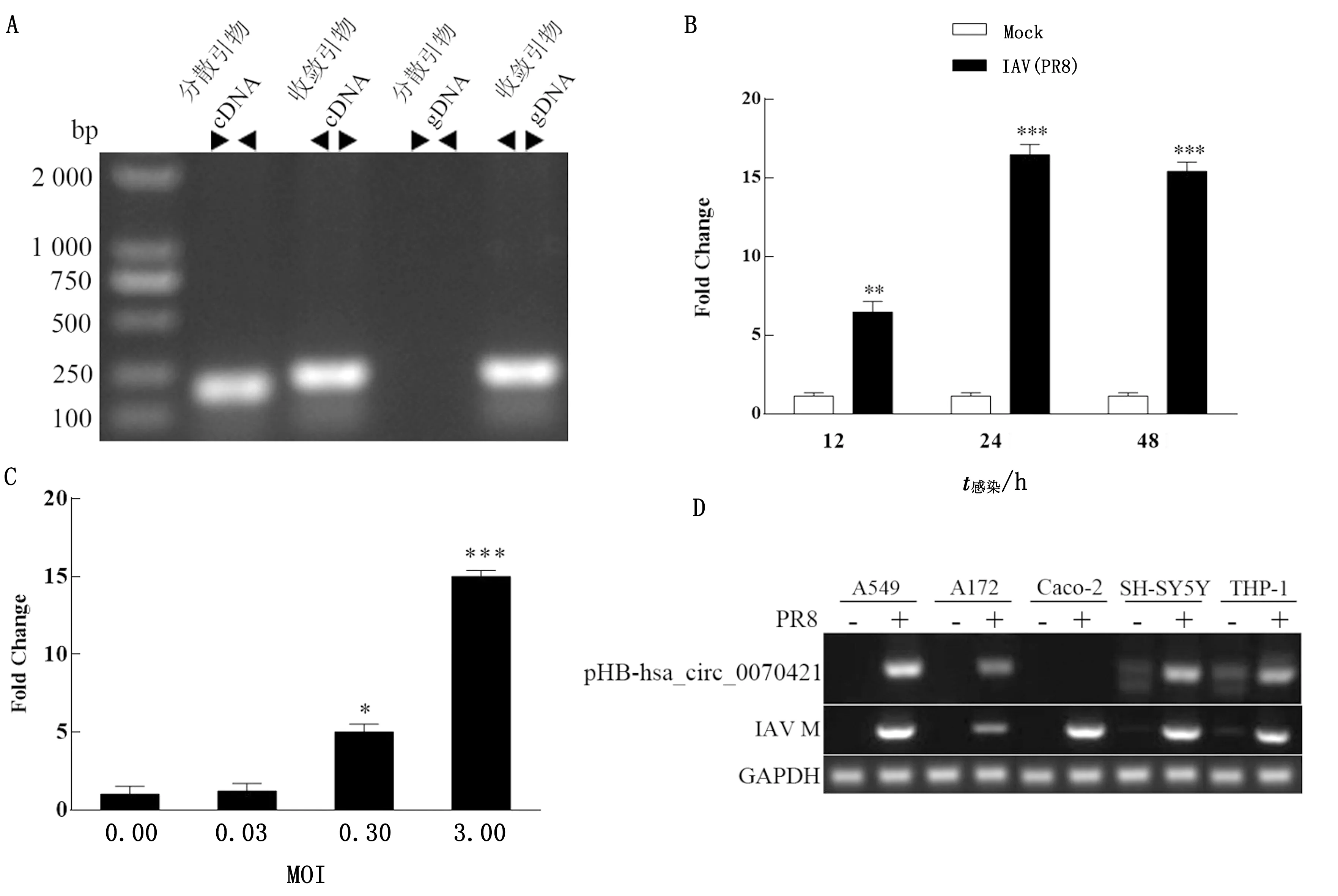
A.收斂引物和分散引物擴增的hsa_circ_0070421電泳圖;B.IAV(PR8)感染A549細胞不同時間對hsa_circ_0070421表達的影響; C.不同MOI 的IAV(PR8)感染A549細胞后24 h對hsa_circ_0070421表達的影響;D.不同細胞系感染IAV(PR8) 24 h后 hsa_circ_0070421的表達。*P<0.05;**P<0.01;***P<0.001。下同
2.2 Poly I:C和IFN有效誘導hsa_circ_0070421表達為了研究IAV感染后hsa_circ_0070421表達的誘因,分別使用聚肌苷酸胞苷酸(polyinosinic:polycytidylic acid,Poly I:C)、干擾素-β(interferon,IFN-β)、細菌脂多糖(lipopolysaccharides,LPS)、凋亡誘導劑Cisplatin和血清饑餓法處理A549細胞,結果如圖2A所示,Poly I:C處理A549細胞后,hsa_circ_0070421的表達在12 h極顯著增加;IFN-β刺激A549細胞后,hsa_circ_0070421的表達隨時間的延長極顯著增加(圖 2B);LPS刺激細胞后,hsa_circ_0070421表達的上調幅度遠小于Poly I:C和IFN-β的刺激(圖2C);Cisplatin(10 μmol/L)和血清饑餓處理細胞后,hsa_circ_0070421表達水平不受影響(圖 2D)。這些數據表明,IAV復制過程中產生的大量病毒RNA及其所激活的Ⅰ型IFN相關的抗病毒天然免疫應答可能是hsa_circ_0070421表達的主要誘因。
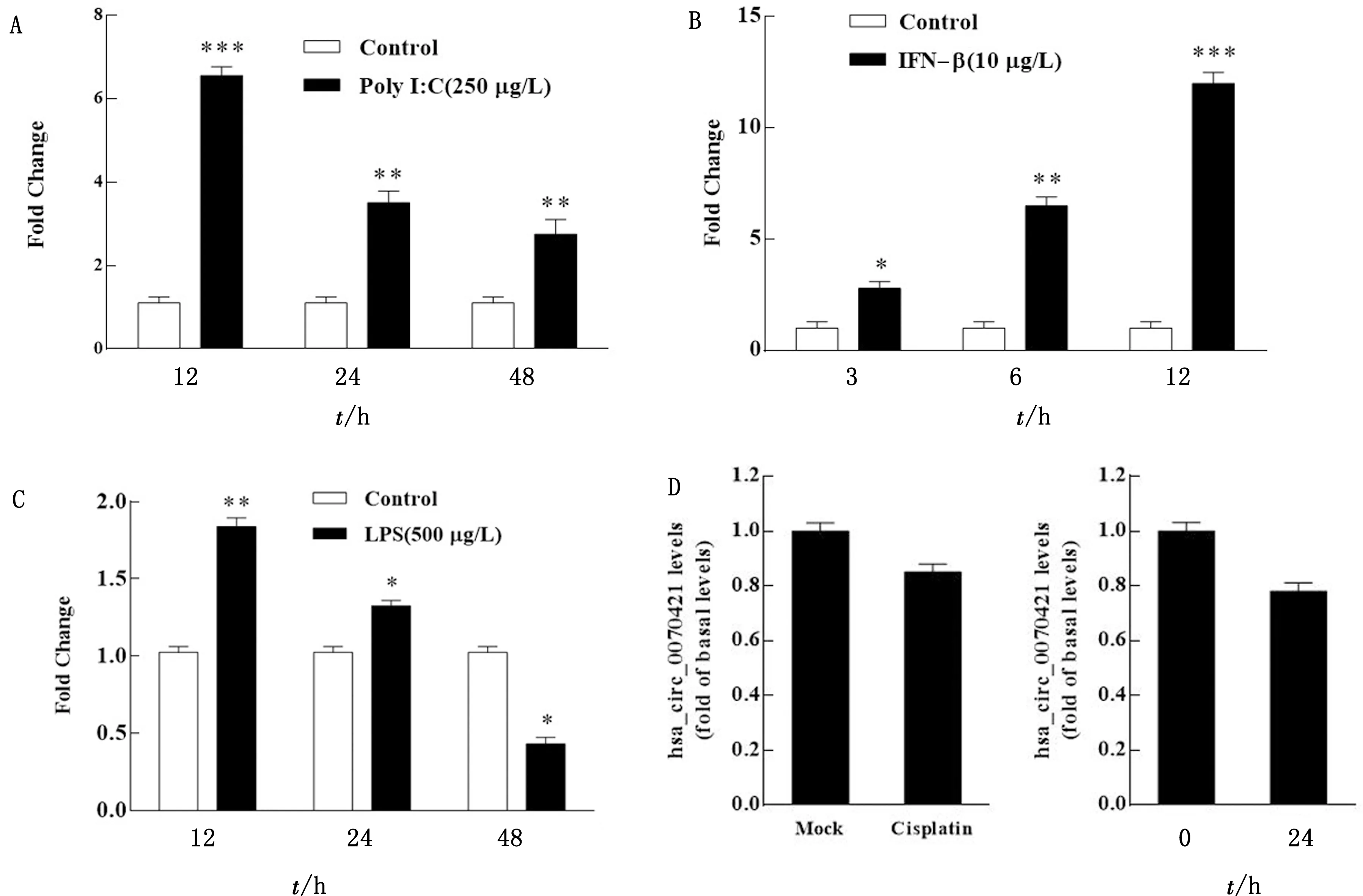
A.Poly I:C轉染A549細胞不同時間后hsa_circ_0070421的表達;B.IFN-β刺激A549細胞不同時間后hsa_circ_0070421的表達;C.LPS處理A549細胞不同時間后對hsa_circ_0070421的表達;D.Cisplatin和血清饑餓處理A549細胞24 h后hsa_circ_0070421的表達
2.3 hsa_circ_007042抑制IAV復制為了探究hsa_circ_0070421對IAV復制的影響,應用過表達和用siRNA敲低hsa_circ_0070421的方法處理細胞,并在病毒mRNA、蛋白和病毒粒子水平上檢測hsa_circ_0070421對病毒復制的影響。結果顯示,與對照組相比,hsa_circ_0070421的過表達顯著抑制 IAV M基因和M1蛋白的表達,且病毒的感染滴度降低;反之,與用對照siRNA轉染的細胞相比,轉染hsa_circ_0070421 siRNA的A549細胞可促進IAV M基因和M1蛋白的表達復制,且病毒的感染滴度升高(圖3)。上述結果表明,hsa_circ_0070421具有抑制IAV復制的功能。
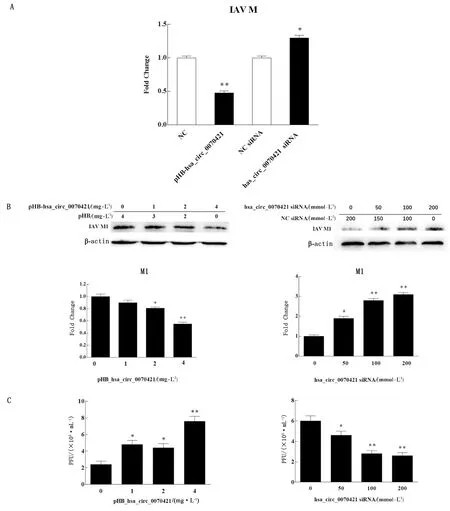
A.hsa_circ_0070421在mRNA水平對IAV復制的影響;B.hsa_circ_0070421在蛋白水平對IAV復制的影響;C.hsa_circ_0070421對IAV子代病毒粒子產生的影響
3 討論
1976年,人們首先在植物類病毒中發現了共價閉合的circRNA[6],之后,研究人員又在動物細胞和真菌酵母中發現了circRNA[7-9],但鑒于生物技術的局限性和結構的特殊性,circRNA在當時被認為是RNA錯誤剪接或剪接過程中形成的副產物。直到2012年,SALZMAN等[10]對circRNA進行了比較全面系統的研究報道,人們才開始重新認識并深入研究這一類“生物暗物質”。近年來,circRNA的生物學功能已成為生命科學領域研究的熱點之一。已有的相關研究表明,circRNA發揮生物學功能的作用機制豐富多樣,除了作為miRNA海綿起作用外,還可以調節mRNA可變剪接、作為翻譯的模板、調節rRNA和tRNA的生物發生和作為裝配蛋白質復合物的支架[11]。值得注意的是,不同circRNA在特定疾病背景下異常表達,表明其與人類疾病的發生和發展密切相關,比如癌癥、心血管疾病、神經系統疾病、代謝病和病原感染等。
近幾年,研究人員對宿主編碼circRNA在病毒感染宿主細胞過程中的作用也展開了相關的研究。基于芯片或RNA高通量測序技術,人們已經研究了10余種病毒感染后宿主circRNA表達模式的改變,包括單純皰疹病毒1型、人巨細胞病毒、乙肝病毒、豬傳染性胃腸炎病毒、豬流行性腹瀉病毒、馬立克病毒和J亞群禽白血病病毒等[12-18]。這些組學數據不僅證實病毒感染能改變宿主circRNA的表達模式,而且說明circRNA在病毒與宿主的相互作用中扮演重要的角色,既有可能是宿主抗病毒感染的工具,也有可能成為病毒重塑有利于自身復制的細胞內微環境的利器。上述差異表達circRNA在病毒感染致病或宿主抗病毒應答中的功能及其分子機制的研究尚未廣泛展開,亟待探究。
源于本實驗室前期組學數據的遴選結果,選擇差異表達顯著上調的hsa_circ_0070421作為研究目標。本研究首先從IAV感染后不同時間點、不同毒株和不同MOI多角度驗證IAV感染與宿主hsa_circ_0070421表達的關聯。在5種細胞系中檢測了hsa_circ_0070421的表達,結果顯示該circRNA廣泛表達于多種器官或組織來源的細胞中,但其生物學功能在不同細胞類型中可能不盡相同。隨后利用凋亡誘導劑和血清饑餓排除了hsa_circ_0070421表達上調與病毒感染時的其他細胞表型或極端的生理條件之間的關聯。Poly I:C是雙鏈RNA的類似物,是一種常用的Toll樣受體3激動劑和IFN誘導劑,可用來模擬RNA病毒復制過程中的病毒RNA中間體。Poly I:C和IFN-β的處理顯著誘導hsa_circ_0070421表達,表明該circRNA表達是病毒RNA在細胞內累積并激活從模式識別受體到Ⅰ型IFN相關抗病毒免疫應答的產物,可能具有類似IFN刺激基因的功能。功能學試驗顯示hsa_circ_0070421能夠抑制IAV復制和增殖,更好地佐證了其是宿主抗病毒天然免疫應答的一員,但其抗病毒作用的分子機制尚需在后續的研究中進一步闡明。
綜上所述,本研究發現和鑒定了hsa_circ_0070421抗IAV復制的新功能,研究結果豐富了對circRNA功能的理解,為探究IAV與宿主相互作用提供了新的視角。

