結直腸癌患者外周血CTC改變與預后的關系*
郭志娟, 吉茹, 王振飛, 孟丹陽, 王金花
(內蒙古醫科大學附屬人民醫院 病理科, 內蒙古 呼和浩特市 010010)
隨著手術、放療、化療及靶向治療的應用,結直腸癌(colorectal cancer,CRC)患者的5年、10年生存率達到了65%和58%,但仍然導致腫瘤死亡的第三大癌癥[1-2]。復發、轉移依然是CRC患者死亡的首要原因,因此CRC治療的關鍵是找到能早期發現疾病及監測疾病病情進展的方法。循環腫瘤細胞(circulating tumor cells,CTC)是在腫瘤形成和進展過程中從原發灶或轉移灶脫落進入血液循環的腫瘤細胞,能夠真實反映腫瘤的情況,對研究腫瘤轉移機制、判斷臨床治療效果、監測腫瘤復發有重要作用[3]。有研究證實,腫瘤細胞在腫瘤形成早期甚至在原發病灶形成之前就播散到循環系統中,并先于原發腫瘤進化成轉移病灶,而且這種腫瘤細胞的播散及進化可能貫穿于腫瘤進展的整個過程[3]。本研究以86例接受手術治療的CRC患者為研究對象,采用CyttelTM擴增型CTC陰性富集技術分別于術前1天、術后第7及30天時進行CTC檢查,使用χ2檢驗和Spearman相關性分析CTC與其他腫瘤標志物的相關性,采用KaPlan-Meier曲線及Cox比例風險模型分析患者的總體生存情況,探討外周血CTC在CRC患者中的變化及其對預后的影響。
1 對象與方法
1.1 研究對象
本研究納入2018年1月—2019年12月在腹部外科接受手術的CRC患者86例,其中男45例、女41例,年齡(54.45±12.69)歲。納入標準: (1)符合2007年世界衛生組織關于CRC診斷標準[4];(2)所有原發病灶均為CRC;(3)均行腫瘤根治切除術治療、且術后經病理學檢查確診。排除標準: (1)存在肝腎功能異常以及心、腦和血液系統等疾病患者;(2)存在其他系統惡性腫瘤患者;(3)臨床資料不完整者。本研究經醫院倫理委員會批準同意(KY201903),患者或家屬均知情同意并簽署知情同意書。
1.2 方法
1.2.1標本采集 于術前1 d及術后第7及30天時,采集受檢患者外周血5.0 mL,采用檸檬酸葡萄糖(ACD)抗凝,室溫保存,24 h內送檢。
1.2.2細胞富集 取上述全血加入50 mL離心管,補充緩沖液至45 mL,離心、棄上清液,輕搖混勻沉淀細胞;再加CS2至45 mL,混勻后離心、棄上清液。吸取適量磁微粒混懸液至2 mL EP管,置于磁力架上,待溶液澄清后、吸棄溶液,反復洗滌3次,用CS1重懸磁微粒補至原體積。取已經預裝3 mL CS3的50 mL離心管,將上述液體輕輕疊加至CS3表層,配平后離心。吸取中間層全部液體,轉移至15 mL離心管,補充CS1,離心、棄上清,反復2次。加入CF1固定液100 μL,輕柔吹打混勻,涂片。
1.2.3熒光原位雜交技術(fluorescence in situ hybridization,FISH)操作 涂片完全干燥后,取CF2室溫固定8~10 min,小心洗去CF2后放置于已預熱的染色缸中靜置10 min。依次在染色缸Ⅲ、Ⅳ、Ⅴ中靜置2~5 min,室溫晾干。之后避光條件下操作,加入探針10 μL、蓋片、封片。雜交儀76 ℃變性5 min、37 ℃雜交1.5 h。洗片、洗滌后將抗體加至標本區,濕盒內室溫下避光、孵育1~1.5 h。洗片后DAPI復染、蓋片。
1.2.4CTC診斷 熒光顯微鏡下由2位經過專業培訓檢驗人員進行CTC鑒定及計數、并拍照。CTC定義為表面磁珠不超過2個,CEP8/7探針≥3個信號,核染陽性(DAPI+),白細胞共同抗原陰性(CD45-)的細胞; CTC數目≥2,提示患者體內存在惡性腫瘤細胞,體內懷疑存在惡性腫瘤病灶,存在潛在轉移風險或已發生遠處轉移,視為CTC陽性;CTC數目<2提示本次未檢測到CTC或者CTC水平趨于正常,病灶性質為良性傾向,視為CTC陰性。
1.2.5病理診斷 手術標本由有經驗的醫師取材,脫水、制片后,由2位副主任醫師及以上診斷醫師出具診斷報告,按美國癌癥聯合會(AJCC)和國際抗癌聯盟(UICC)第8版TNM系統進行分期。
1.3 觀察指標
使用χ2檢驗和Spearman法分析CTC檢出率與患者一般臨床特征、腫瘤分化程度、腫瘤病理組織學類型及腫瘤標志物的關系,比較患者3個時間點的外周血CTC計數,比較CTC陽性和CTC陰性患者預后及生存情況。
1.4 統計學分析
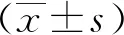
2 結果
2.1 CRC患者一般臨床特征及基線CTC計數
86例CRC患者中CTC陽性例數為55例,檢出率為63.95%,共檢出745個CTC。如表1結果所示,CTC檢出率與患者TNM分期和分化程度有關(P<0.05),與性別、年齡、腫瘤部位、腫瘤直徑以及淋巴結轉移等臨床特征無關(P>0.05)。見表1。
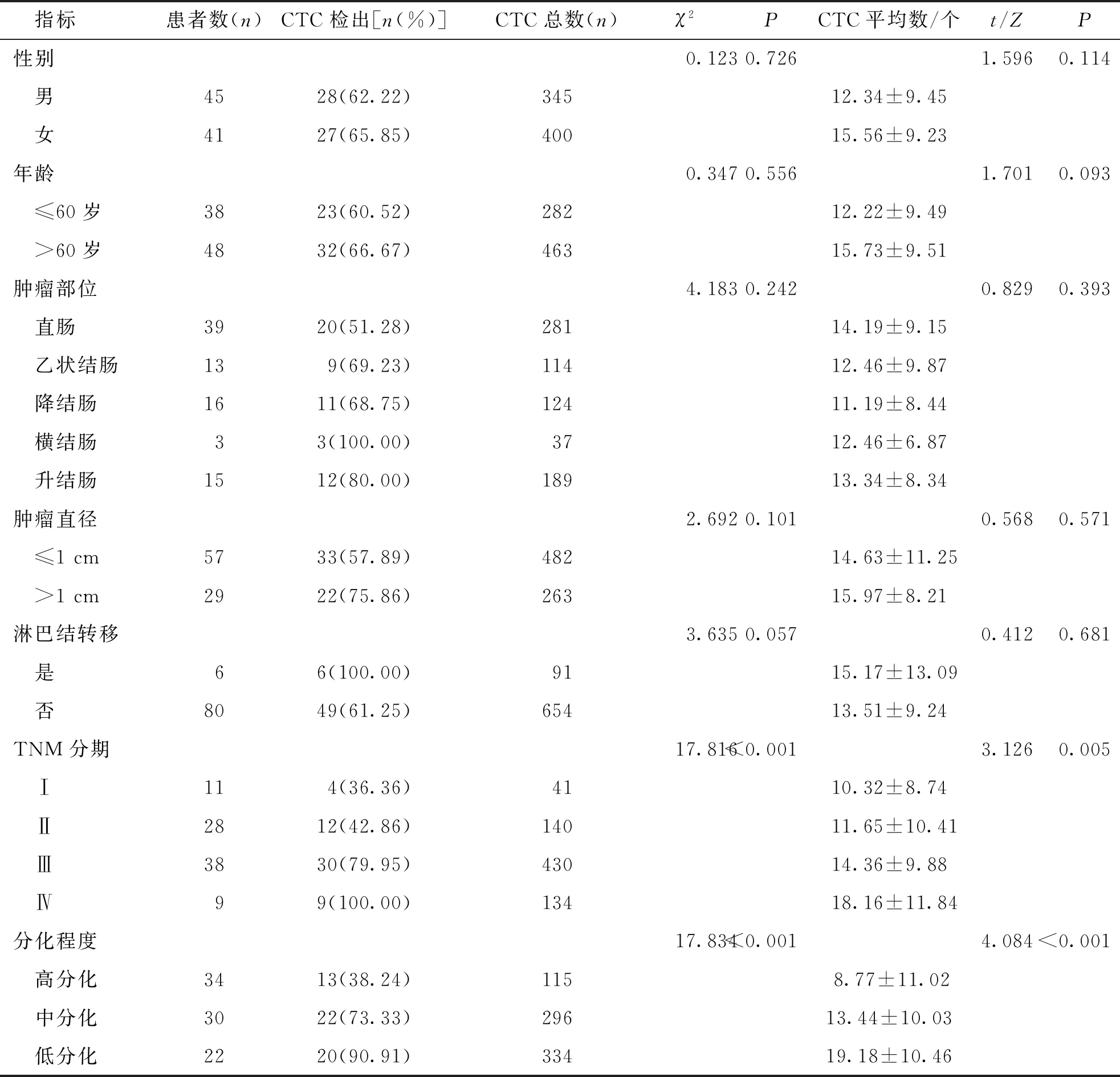
表1 86例CRC患者的一般臨床特征及基線CTC計數
2.2 不同分化程度CRC患者的基線CTC計數
結果顯示,與中、低分化組比較,高分化組患者基線CTC陰性患者的比例明顯增加,差異有統計學意義(P<0.001);中、低分化組患者基線CTC陰性患者的比例比較,差異無統計學意義(P>0.05)。見表2。
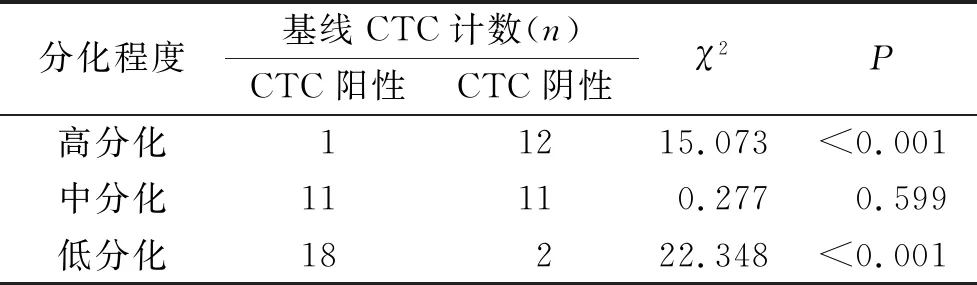
表2 不同分化程度CRC患者的基線CTC計數比較
2.3 不同病理組織學類型CRC患者基線CTC計數
結果顯示,不同病理組織學類型的基線CTC計數陽性與陰性CRC患者比例比較,差異無統計學意義(P>0.05)。見表3。
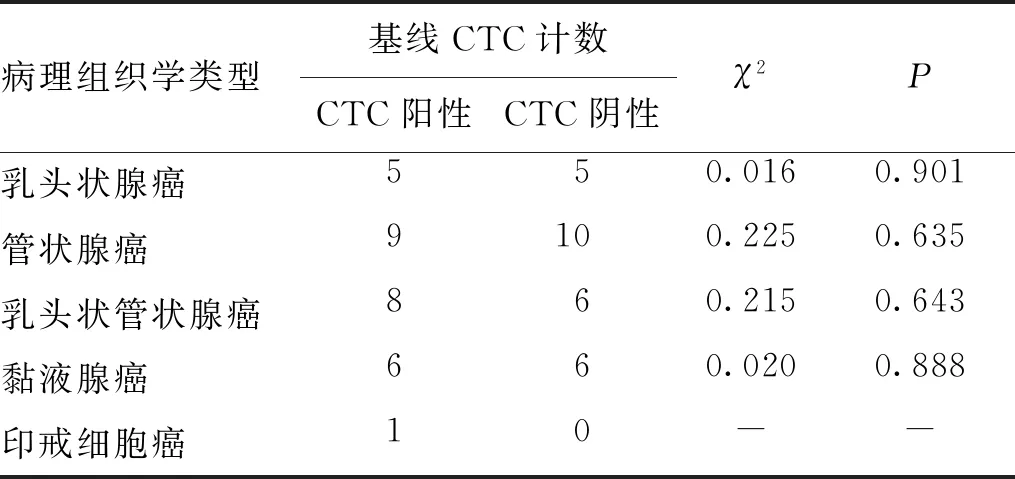
表3 不同病理組織學類型CRC患者的基線CTC計數比較
2.4 不同腫瘤標志物檢測結果與CRC患者基線CTC計數的相關性
結果顯示,腫瘤標志物中陽性率最高的為癌胚抗原,達51.16%(44/86),與CTC陽性率的63.95%最為接近,χ2檢驗和SPearman分析顯示,CTC陽性率與癌胚抗原有相關性(P<0.05),與CA199和CA125無明顯相關性(P>0.05)。見表4。
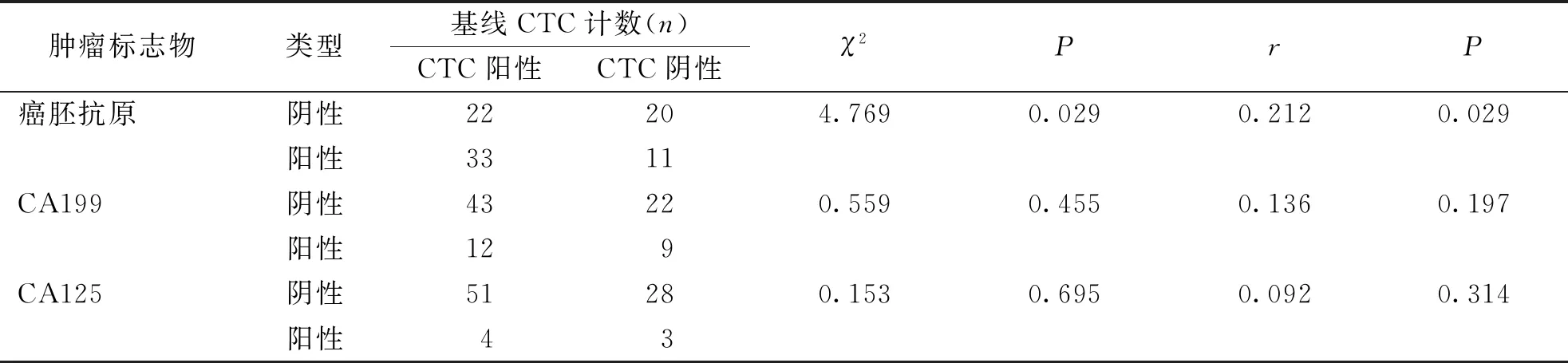
表4 不同腫瘤標志物檢測結果與CTC檢測結果相關性
2.5 外周血CTC變化
結果顯示,CRC患者手術前1 d及手術后第7及30天時的外周血CTC計數分別為13.34±9.59、9.39±9.39及5.46±6.18;與手術前1 d比較,手術后第7及30天時的外周血CTC計數降低,差異有統計學意義(P<0.01),見圖1。預后分析結果顯示,CTC陽性組較CTC陰性組患者部分緩解(PR)和穩定(SD)比例下降,總生存時間縮短(P<0.05)。
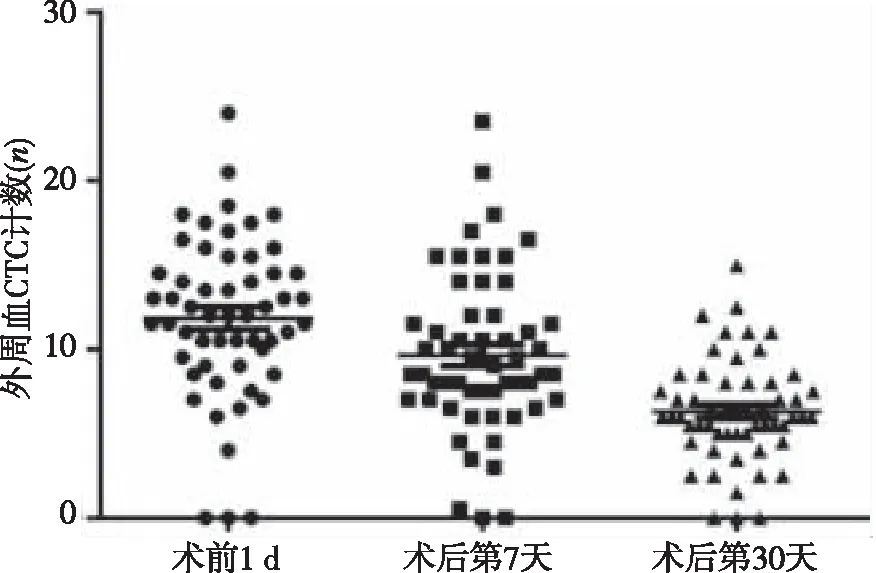
圖1 CRC患者手術前后的外周血CTC變化
3 討論
近年來,大量研究發現,外周血CTC在肺癌、乳腺癌以及CRC等惡性腫瘤的診斷和預后評估中具有重要的作用,具有方便、快捷且創傷低的優勢,有極大的臨床應用潛力[5-7]。Aggarwal等[8]通過對50例小細胞肺癌(SCLC)患者行前瞻性研究發現,CTC<50的患者較CTC≥50患者的無進展生存期(PFS)和總生存時間(OS)明顯增長顯著相關,提示CTC與SCLC患者的疾病階段和生存相關,這表明CTC可用作臨床反應的替代生物標志物。Chudasama等[9]研究發現,與低增殖CTC的患者相比,具有高增殖(Ki-67)狀態的CTC的患者的PFS(P=0.001 1)和總體生存率(P=0.009 5)明顯降低。Adriana等[10]通過利用對行化療治療的結腸癌患者于化療1周后檢測CTC發現,CTC陽性率與患者預后密切相關,且CTC可作為結腸癌患者制定個體化治療方案的參考指標。目前,有關CTC的研究主要涉及外周血中的RNA和DNA表達、細胞信號傳導途徑以及血清生物標志物[11-14]。在一些醫院中已經開展了外周血CTC的臨床檢測[15],但是,主要用作對手術及化療進行初步分析和評估的工具[16-18],缺乏較大樣本量的臨床CTC研究,且很少有研究探討外周血CTC數目與原發性惡性腫瘤及其病理組織學特征的相關性。
本研究對于CRC患者手術前CTC的數目,及其與腫瘤分化程度、淋巴結轉移、腫瘤大小以及化療效果和OS等關系進行了研究,并且比較了手術前以及手術后第7天和30天的CTC數目。本研究結果顯示,86例結腸癌患者中CTC陽性例數為55例,檢出率為63.95%,共檢出CTC數745個,其中橫結腸癌CTC檢出率最高,達100%,且結腸癌CTC檢出率74.46%(35/47)明顯高于直腸癌51.28%(20/39),這與汪棟等[19]研究報道類似。相關性分析顯示,CTC檢出率與患者TNM分期和分化程度有關(P<0.05),與性別、年齡、腫瘤部位、腫瘤直徑、病理組織學類型以及淋巴結轉移等臨床特征無關(均P>0.05)。復發轉移是導致結腸癌患者死亡的最主要因素[20-23],因此,作為與轉移高度相關的CTC,推測其在預測結腸癌復發和轉移具有重要的臨床意義。此外,在對CTC檢出率與不同類型腫瘤標志物相關性研究發現,腫瘤標志物中陽性率最高的為癌胚抗原,達51.16%(44/86),與CTC陽性率的63.95%最為接近,且CTC陽性率與癌胚抗原相關性密切(P<0.05),而與CA199和CA125無明顯相關性(P>0.05)。因此,對于結腸癌患者,可行癌胚抗原和CTC聯合檢測,以提高預測預后的準確性。
此外,本研究結果顯示,與手術前1 d比較,手術后第7天及30天的外周血CTC計數均明顯降低(P<0.01),提示外周血CTC可以作為評估手術效果和預后的臨床指標。Liu等[24]的一項分析結果顯示,外周血CTC數目與腫瘤體積相關。腫瘤體積過小與無法檢測到外周血CTC有關。本研究中的所有患者均接受了腫瘤根治性切除術。絕大多數腫瘤細胞已經被清除,最大限度地減少了CTC從腫瘤原發灶釋放進入外周血[25]。本研究觀察到的術后第7 天和30天的外周血CTC計數顯著減少可能可以作為評估手術效果和患者預后的重要指標之一。
綜上所述,CRC患者外周血中可以檢測到較高的CTC計數。外周血CTC計數與CRC的低分化相關,從一定程度上反映了腫瘤的惡性程度。此外,術后第7天和30天外周血CTC計數顯著降低,提示動態監測CRC患者外周血CTC對于評估治療效果和患者預后具有重要意義,未來還應該進行更大樣本量和長期隨訪,來進一步確定外周血CTC計數的臨床意義。

