非小細胞肺癌患者外周血PD-L1蛋白的表達及其對治療效果的評估作用*
王麗, 劉成鳳, 魏麗群, 尚靜, 彭瑛, 張燕
(1.樂山市中醫醫院 腫瘤血液科, 四川 樂山 614000; 2.西南醫科大學附屬醫院 檢驗部, 四川 瀘州 646000; 3.西南醫科大學附屬中醫醫院 腫瘤血液二科, 四川 瀘州 646000)
研究發現,肺癌的已成為了人類死亡的重要因素之一[1-2]。研究指出,非小細胞肺癌(non-small-cell lung cancer,NSCLC)患者的預后不良與腫瘤轉移具有密切的關聯[3]。循環腫瘤細胞是自發或經外界因素進入外周血循環的腫瘤細胞[4],腫瘤轉移的初始階段癌細胞可少量存活并形成轉移灶[5]。T淋巴細胞是可被抗原特異性激活的腫瘤免疫應答效應細胞[6],而程序性細胞死亡配體1(recombinant programmed cell death protein 1 ligand 1,PD-L1)是一種通過與PD-1受體結合而調控免疫應答的負性T細胞類共刺激分子[7]。PD-L1基因在體內廣泛表達,受體主要為PD-1,因PD-1可對T細胞進行調控,因此PD-1配體與其結合后會抑制T細胞活化[8]。腫瘤學檢查的傳統方法主要是影像學和組織病理學方法,但均存在一定的缺點,如影像學檢測無法對微小轉移灶進行發現和跟蹤,組織病理學檢查的重復性差,這些檢查對腫瘤的發展進程無法實時監測[9]。近年來液態活檢技術因循環腫瘤細胞獲取簡便、創傷小、易于連續監測的優點已成為實時療效監測和腫瘤無創診斷的工具,該技術發展潛力巨大,在腫瘤領域具有一定的臨床研究價值[10-11],但關于外周血循環腫瘤細胞活檢技術用于預測臨床療效及預后的研究較少,且PD-L1蛋白表達在臨床療效中的診斷效果更為少見,因此本研究擬通過分析NSCLC患者外周血循環腫瘤細胞中PD-L1蛋白表達與治療效果的相關性,為NSCLC患者的治療和預后檢測提供實驗依據。
1 對象與方法
1.1 對象
選擇2018年10月—2019年4月臨床診斷和病理學分析確診的原發性NSCLC患者作為實驗組,納入標準:(1)NSCLC初治患者;(2)年齡≥18周歲,性別不限;(3)入組前1個月內未進行NSCLC相關治療;(4)認知、精神疾溝通能力均正常;(5)自愿參與本次研究并簽署知情同意書。排除標準:(1)合并其他惡性腫瘤或全身感染者;(2)合并心、肝、腎等臟器功能不全者;(3)妊娠期或哺乳期者。納入32例患者作為實驗組,男18例、女14例,年齡21~67歲、平均(48.21±6.44)歲,體質量指數(body mass index,BMI)21~26 kg/m2、平均(23.32±1.79)kg/m2。同時選取32例健康志愿者作為對照組,男20例、女12例,年齡20~70歲、平均(46.79±6.15)歲,BMI 21~25 kg/m2、平均(22.48±1.57)kg/m2。2組受試者一般資料比較,差異均無統計學意義(P>0.05)。本研究已獲得醫院倫理委員會批準(20180902)。
1.2 方法
1.2.1治療方法 實驗組患者采用替吉奧聯合奈達鉑化療,口服替吉奧(江蘇恒瑞醫藥股份有限公司,國藥準字H20113281)40 mg/次、2次/d,連續14 d;靜脈滴注奈達鉑(江蘇奧賽康藥業股份有限公司,國藥準字H20064294)、500 mL/次、75 mg/m2溶入生理鹽水、1次/d,連續42 d。
1.2.2靜脈血采集 采集2組受試者治療前1 d的清晨空腹靜脈血10 mL置于乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA;德國Merck公司)抗凝管中,血液采集完成的1 h內進行腫瘤細胞的富集。
1.2.3磁珠富集和循環腫瘤細胞評估 使用質量分數40%的羥乙基淀粉550料液、質量分數60%的泛影葡胺料液制取并過濾獲取2組受試者的淋巴細胞分離液,將淋巴細胞分離液和血液混合加熱至25 ℃,加抗凝血7.5 mL和等量磷酸鹽緩沖溶液(phosphate buffered solution,PBS;山東博科生物產業有限公司)混勻,緩慢貼壁倒入加熱后的淋巴細胞分離液上層面,室溫、2 000 r/min離心15 min;取環狀乳白色單核細胞層,加PBS 5 mL洗滌處理2次,室溫2 000 r/min離心15 min,并將沉淀細胞重懸置于磁珠緩沖液(備案號20180004,洛陽吉恩特生物科技有限公司)中,并加抗體20 μL,4 ℃孵育15 min;加磁珠緩沖液2 mL,離心取上層,取重懸細胞500 μL經過磁珠甲基丙烯酸甲酯-苯乙烯共聚物(methyl methacrylate-styrene copolymer,MS)分流柱,重復2次洗滌MS分流柱,采集分流出的溶液,室溫3 000 r/min離心15 min,棄上清液,取沉淀物均勻放置于載玻片,風干,4%多聚甲醛固定;熒光顯微鏡下觀察循環腫瘤細胞陽性表達(細胞呈長型、橢圓形、圓形,其核質比血細胞體積大,淡黃色、棕黃色及棕黑色分別表示弱陽性、中等陽性及強陽性)并計算陽性率[12]。
1.2.4PD-L1蛋白檢測 取富集后循環腫瘤細胞玻片,加封閉液,室溫孵育30 min,加稀釋后PD-L1抗體、CD45熒光抗體,室溫孵育2 h,CYP2洗3次、3 min/次,加稀釋后熒光抗體DRG,37 ℃孵育30 min,加DAPI細胞染色液10 μL,蓋玻片封片,置于熒光顯微鏡下讀片,將PD-L1(+)DAPI(+)CD45(-)的細胞判定為PD-L1陽性循環腫瘤細胞;以人肺腺癌細胞系NCI-H1975為陽性對照,以健康人外周血作為陰性對照組。其中PD-L1兔單克隆抗體購自上海Roche公司,PD-L1蛋白檢測試劑盒購自江蘇萊爾生物醫藥科技有限公司。
1.2.5血清干擾素-γ(interferon γ,IFN-γ)和群集分化8(cluster differentiation 8,CD8)+T細胞浸潤水平檢測 采集實驗組患者治療前1 d清晨空腹靜脈血10 mL,3 000 r/min離心15 min,取上層血清,使用酶聯免疫吸附法(enzyme linked immunosorbent assay,ELISA)試劑盒對血清IFN-γ進行檢測,并于熒光顯微鏡下觀察并計算CD8+T細胞比率。
1.2.6臨床療效和預后判斷[13]觀察實驗組患者治療結束后30 d的臨床療效,按RESIST療效評價標準,CR(完全緩解)全部病灶消失維持4周,PR(部分緩解)病灶縮小≥30%維持4周,SD(穩定)縮小不足30%或增大不足20%,PD(進展),病灶增加20%,同時規定治療結束后30 d內復發為預后較差,未復發為預后良好。
1.2.7臨床資料收集 收集實驗組患者的臨床指標,包括性別、年齡、腫瘤組織學類型、吸煙、疾病疾病家族史、遠處轉移及腫瘤原發灶(tumor, T)、區域淋巴結受累(node, N)、遠處轉移(metastasis, M)及TNM分期。
1.3 統計學分析
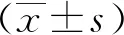
2 結果
2.1 外周血循環腫瘤細胞
實驗組患者外周血循環腫瘤細胞檢出率明顯高于對照組,差異有高度統計學意義(P<0.01)。見表1。
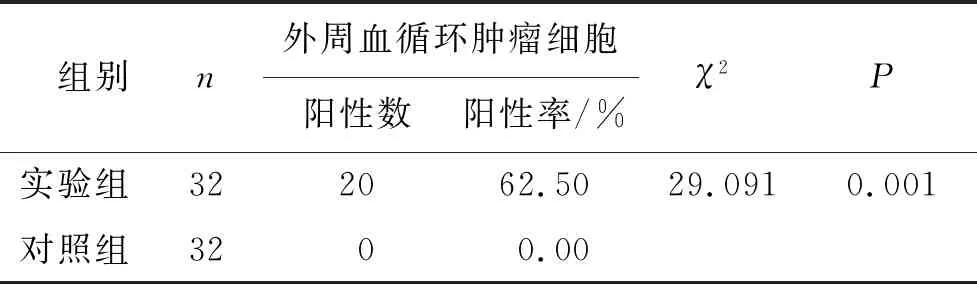
表1 實驗組和對照組受試者外周血循環腫瘤細胞
2.2 實驗組患者外周血循環腫瘤細胞中PD-L1蛋白的表達
20例循環腫瘤細胞陽性的實驗組患者外周血中有14例檢測到不同程度的PD-L1熒光信號,陽性表達率為70.00%,其中弱陽性、中等陽性及強陽性表達分別為7、4及3例。見圖1。
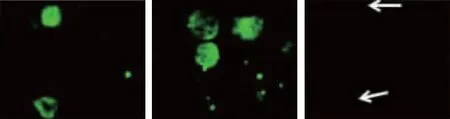
弱陽性 中等陽性 強陽性
2.3 實驗組患者外周血循環腫瘤細胞PD-L1蛋白表達與臨床病理特征的關系
實驗組患者外周血循環腫瘤細胞中PD-L1蛋白表達與患者年齡、性別、組織學檢測及疾病家族史等無關(P>0.05),與吸煙、TNM分期和遠處轉移有關(P<0.05)。見表2。
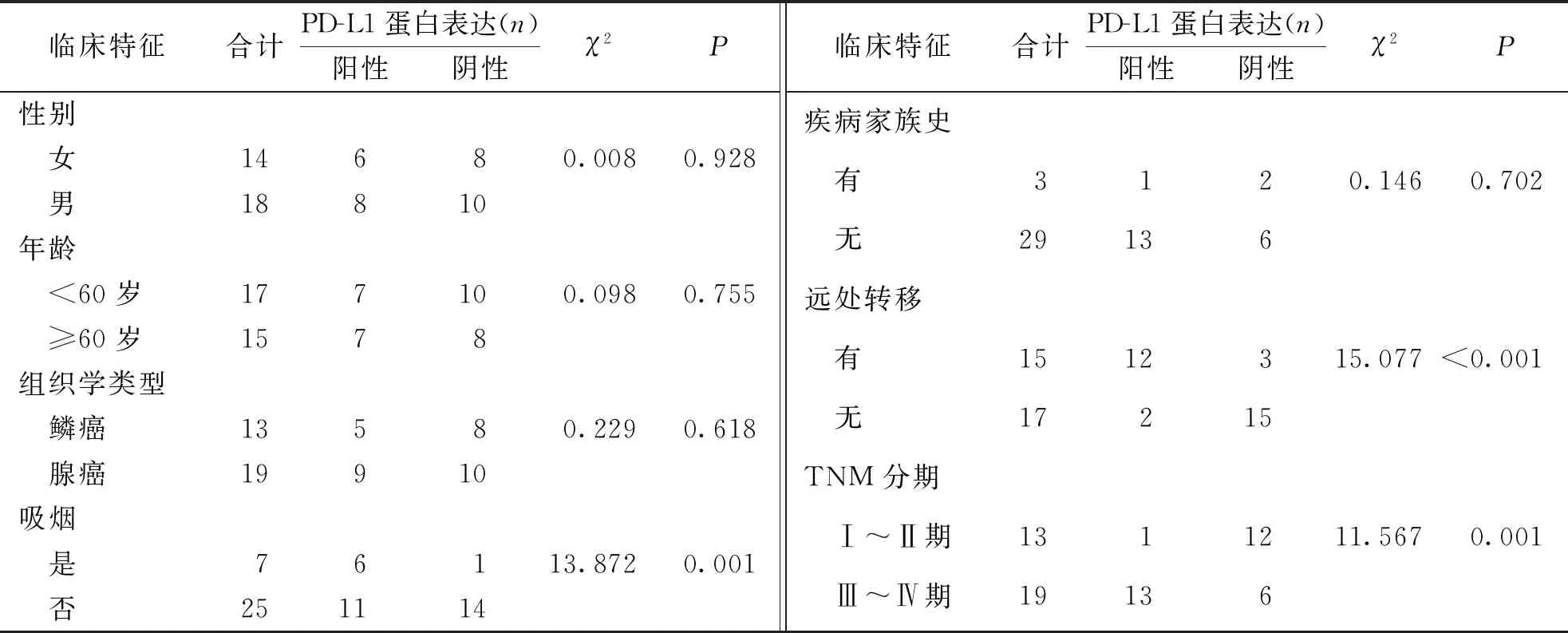
表2 實驗組患者外周血循環腫瘤細胞PD-L1表達與NSCLC臨床病理特征的關系
2.4 實驗組患者外周血血清IFN-γ及CD8+ T與循環腫瘤細胞PD-L1表達與的相關性
實驗組患者外周血循環腫瘤細胞PD-L1蛋白表達陰性者血清IFN-γ水平及CD8+T細胞或單核細胞比例高于陽性者,差異有統計學意義(P<0.05);IFN-γ≤29 ng/L時與PD-L1蛋白表達呈正相關(r=0.658,P<0.05),IFN-γ>29 ng/L時二者呈負相關(r=-0.476,P<0.05);CD8+T細胞或單核細胞比例≤43%時與PD-L1蛋白表達呈正相關(r=0.733,P<0.05),CD8+T細胞或單核細胞比例>43%時二者呈負相關(r=-0.357,P<0.05)。見表3。

表3 實驗組患者外周血循環腫瘤細胞PD-L1表達與血清IFN-γ及CD8+T的關系[n(%)]
2.5 實驗組患者外周血循環腫瘤細胞中PD-L1表達與臨床療效及預后的相關性
Spearman分析顯示,實驗組患者外周血循環腫瘤細胞中PD-L1表達與其臨床療效呈負相關(r=-0.622,P<0.001);實驗組患者外周血循環腫瘤細胞中PD-L1表達與其預后呈負相關(r=-0.557,P<0.001)。見表4。

表4 實驗組患者外周血循環腫瘤細胞PD-L1表達與臨床療效及預后的關系
3 討論
肺癌是常見的惡性腫瘤,由于其早期癥狀的不明顯性,極易錯過手術治療的最佳時間,導致確診時間較晚,死亡風險較高[14]。因此,早期發現和診斷是治療肺癌、延長患者生活質量和生存時間的最好方法[15]。胃癌、胰腺癌及肺癌等多種惡性腫瘤均可通過誘導PD-L1蛋白高表達形成機體免疫抑制性,以此逃避機體產生的抗腫瘤反應[16]。研究報道,各類腫瘤細胞內PD-L1蛋白均呈現高表達,且與癌細胞免疫逃逸相關[17-18]。有報道發現PD-L1蛋白表達與腫瘤間質細胞有著一定關系,在原發性肝癌患者的癌旁單核巨噬細胞可通過促進PD-L1分子表達避開T細胞免疫[19-20]。本研究發現外周血循環腫瘤細胞檢出率實驗組高于對照組,且與患者吸煙、疾病分期和遠處轉移具有一定的相關性,治療后無論療效如何循環腫瘤細胞陽性檢出率均下降,同時PD-L1蛋白在療效較差組的循環腫瘤細胞血液內表達較療效良好組升高,這說明PD-L1在NSCLC的肺泡巨噬細胞和淋巴細胞內的表達水平高于癌細胞內水平,其陽性表達可能和NSCLC及淋巴結轉移具有正相關性,且和預后具有明顯的負相關性。Liu等[21]發現47例NSCLC患者的循環腫瘤細胞及淋巴細胞、巨噬細胞的陽性表達率為48.93%、61.70%,同時其表達情況與肺癌患者淋巴轉移和臨床分析具有正相關性,與預后生存具有負相關性;Sughayer等[22]對208例NSCLC患者體內PD-L1蛋白表達進行研究,結果顯示PD-L1陽性檢出率達到65.3%,并與淋巴轉移和吸煙史呈負相關性。上述研究均與本研究結果相似。
本研究結果顯示循環腫瘤細胞PD-L1蛋白表達與患者吸煙、疾病分期和遠處轉移密切相關,Spearman分析結果則提示PD-L1表達與臨床療效、預后均呈負相關關系,提示通過對NSCLC患者的外周血循環腫瘤細胞中PD-L1表達水平進行檢測,有利于探究患者免疫微環境中的免疫抑制特征,幫助臨床腫瘤免疫治療的有效應用。
IFN-γ可提高抗原遞呈能力,提高巨噬細胞功能,提高Th1細胞的活性及細胞免疫力,調節T細胞的活化與增殖[23]。細胞毒性T淋巴細胞可分泌多種免疫調節因子,殺傷抗原物質,是機體重要的免疫防線[24]。本研究中實驗組患者中陰性者血清IFN-γ水平及CD8+T細胞或單核細胞比例均高于陽性者,且二者與PD-L1蛋白表達均存在相關性,這提示NSCLC細胞可通過PD-L1分子對微環境中IFN-γ水平及CD8+T細胞或單核細胞比例進行調節,對免疫功能產生影響,提示通過監測PD-L1蛋白表達能夠了解NSCLC患者的免疫能力。然而Nunesx等[25]對手術治療NSCLC患者進行研究發現,52例患者組織中PD-L1均表達,但與患者的年齡、吸煙史、性別、TNM分期等無相關性,與患者的預后效果亦無關。這與本研究結果不同,可能與本研究樣本量較少有關,今后應進一步探究,提高研究的準確性。另外,本研究納入對象均為初發NSCLC患者,未對復發NSCLC患者進行研究分析,亦可能會導致研究結果偏差。
綜上所述,檢測NSCLC患者循環腫瘤細胞的血液中PD-L1表達情況可幫助指導臨床治療,但對于實現NSCLC患者治療效果的評估仍存在一定的局限性,如PD-L1的表達受多種因素的影響,從而使得其特異性較差。因此,今后可通過更為深入的研究確定PD-L1作為預測NSCLC治療效果有效生物標志物的可行性,并研制出涵蓋多層面的預測生物標志物體系。

