MiR-206和CDK 4在神經腦膠質瘤中的表達及臨床意義
王曉華 胡金鈺
海陽市人民醫院神經外科,山東 265100
神經腦膠質瘤是大腦和脊髓質細胞癌變導致原發性顱腦惡性腫瘤[1],具有進展快、高復發率、高病死率、預后差等特點[2]。神經膠質瘤是最常見的惡性腦瘤之一,約占惡性腦瘤的55%左右[3]。神經腦膠質瘤的發生是一個多基因、多環節異常改變的綜合進展過程,分子機制錯綜復雜,致使臨床上治療和預后改善效果甚微。目前臨床主要采用膠質瘤全切術配合放化療治療神經腦膠質瘤,但總體治療效果仍不甚理想[4]。因此,探究其發病機制,可為臨床更好的治療提供幫助。miRNA與癌癥的發生和進展過程有關。有關研究顯示,miR-206在膠質母細胞瘤組織中低表達,通過靶向調控BCL-2表達影響膠質母細胞瘤的發展[5]。細胞周期依賴性激酶4(cyclin-dependent kinase 4,CDK4)參與細胞周期調控,與乳腺癌細胞增殖、侵襲性生長密切相關[6]。研究表明CDK4在膠質母細胞瘤中高表達,與腫瘤細胞增殖有關,抑制CDK4表達可靶向治療膠質母細胞瘤[7]。但miR-206與CDK4在神經腦膠質瘤組織中的表達及與預后的關系尚不清楚。本研究旨在探究miR-206與CDK4在神經腦膠質瘤組織中的表達及與神經腦膠質瘤患者臨床病理特征及預后的關系。
1 資料與方法
1.1 一般資料 選擇2014年8月至2015年10月在本院就診的神經腦膠質瘤患者74例為研究對象,入院時統計患者臨床病理資料。患者中男40例,女34例;年齡范圍15~58歲,<50歲者39例,≥50歲者35例;腫瘤大小≤3 cm者32例,>3 cm者42例;WHO分級中Ⅰ~Ⅱ級36例,Ⅲ~Ⅳ級38例;核分裂≤2者29例,>2者45例。(1)納入標準:①所有患者均符合《中國腦膠質瘤分子診療指南》(2014)診斷標準[8]且經術后病理學確診為神經腦膠質瘤患者;②患者均為原發膠質瘤且首次行膠質瘤全切術;③經溝通后獲得患者及家屬同意獲取組織,并簽署知情同意書。(2)排除標準:①患者膠質瘤全切術后復發,再次手術者;②合并其他惡性腫瘤、全身系統性疾病及免疫性疾病者;③依從性差無法配合完成治療者;④非正常死亡患者。本研究經本院醫學倫理委員會批準通過。
1.2 方法
1.2.1 標本采集及與預處理 患者行膠質瘤全切術中取膠質瘤組織及瘤周組織(>3 cm),以生理鹽水洗凈,一部分放于液氮中速凍5 min后置于-80℃冰箱用于提取總RNA,另一部分備用。
1.2.2 膠質瘤組織及瘤周組織中miR-206和CDK4 mRNA表達水平分析 取出凍存標本,冰上解凍,按照Trizol試劑盒(美國Invitrogen公司生產)說明書提取組織總RNA,經瓊脂糖電泳檢測后確保RNA純度且無降解,取2μg以miRNA反轉錄試劑盒(TaKaRa公司生產)反轉錄為cDNA。熒光定量PCR反應體系參照SYBR Green PCR master mix試劑(TaKaRa公司生產)說明加配反應體系,每個樣品設置3次生物學重復。反應體系:2×Master mix 8μl、cDNA 1μl、20×SYBRI 1μl、PCR forward primer 0.5μl、PCR reverse primer 0.5μl、加無RNase H2O至總體積為20μl。體系加配完成后,放入Bio-Rad熒光定量PCR儀進行反應,反應程序設置:97℃預熱3 min,95℃變性45 s,63℃退火30 s,共40個循環。反應結束后收集數據。miR-206以U6為內參基因,CDK4以β-actin為內參基因,采用2-ΔΔCt算法計算miR-206和CDK4 mRNA相對表達水平。引物由北京六合華大基因公司合成,引物序列見表1。
1.2.3 組織CDK4蛋白表達檢測 以10%中性緩沖甲醛固定膠質瘤組織及瘤周組織,完成固定后行石蠟包埋切片HE染色,中性樹脂進行封片,置于顯微鏡下進行觀察。觀察時隨機取10個高倍鏡視野進行病理切片觀察,并對陽性細胞數量進行統計。CDK4陽性大多數位于細胞核中,均以棕黃色顆粒特異性分布于細胞核者視為陽性細胞。由2名主治病理醫生分別獨立執行,采用雙盲法閱片。按照陽性細胞百分比記分:<5%0分,5%~20%1分,21%~50%2分,51%~75%3分,>75%4分;按照染色程度:無色0分,淡黃色1分,棕黃色2分,褐黃色3分。取兩組積分乘積,≤2分為陰性,>2分為陽性。
1.2.4 生物信息學軟件預測miR-206和CDK4的關系 關于miR-206與CDK4之間的關系主要采用生物信息學網站(http://www.microrna.org)進行預測分析。
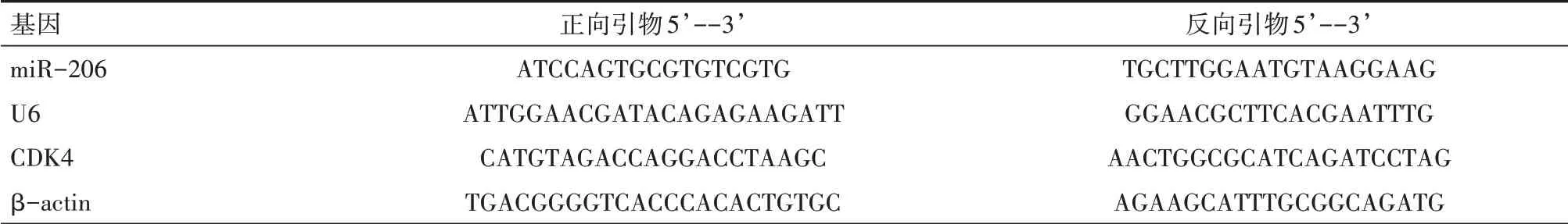
表1 qRT-PCR引物序列
1.3 隨訪 以復診或電話等方式對神經腦膠質瘤患者術后生存情況進行隨訪,記錄患者從手術治療到腫瘤進展引起死亡的患者例數計算無進展生存率(progressive-free survival,PFS)。隨訪時間為期36個月,自手術當天始,截止至2018年11月1日。所有患者均完成隨訪,無一例患者失訪。
1.4 統計學方法 以統計學軟件SPSS 17.0對本研究數據進行統計分析,計數資料以例(%)表示,比較行χ2檢驗;正態分布的計量資料以(±s)表示,比較行配對t檢驗;Kaplan-Meier分析神經腦膠質瘤患者術后3年生存情況。COX回歸模型分析影響神經腦膠質瘤患者預后的危險因素;Pearson相關性分析法分析神經腦膠質瘤組織中miR-206和CDK4 mRNA表達水平的相關性,各組數據均以P<0.05為差異有統計學意義。
2 結 果
2.1 膠質瘤組織和瘤周組織miR-206和CDK4 mRNA表達分析 神經腦膠質瘤患者膠質瘤組織中miR-206表達水平顯著低于瘤周組織(P>0.05),CDK4 mRNA表達水平顯著高于瘤周組織(P>0.05),詳見表2。
表2 74例神經腦膠質瘤患者膠質瘤組織和瘤周組織miR-206和CDK4 mRNA表達分析(±s)

表2 74例神經腦膠質瘤患者膠質瘤組織和瘤周組織miR-206和CDK4 mRNA表達分析(±s)
注:miR-206為微小RNA-206,CDK4為細胞周期依賴性激酶4,U6與β-actin均為內參基因
組織類型瘤周組織膠質瘤組織t值P值miR-206/U6 1.02±0.17 0.68±0.14 12.764<0.001 CDK4/β-actin 1.01±0.18 1.48±0.27 12.205<0.001
2.2 神經腦膠質瘤CDK4蛋白表達分析 免疫組化結果顯示CDK4蛋白位于細胞核中,染色呈淺黃色、棕黃色,見圖1。神經膠質瘤組織CDK4蛋白陽性表達率顯著高于瘤周組織[66.22%(49/74)比22.97%(17/74)](χ2=28.003,P<0.001)。
2.3 miR-206、CDK4表達水平與神經腦膠質瘤患者臨床病理特征關系 根據膠質瘤組織中miR-206表達水平將患者分為miR-206高表達組和miR-206低表達組,根據免疫組化結果將患者分為CDK4陽性表達組和CDK4陰性表達組。結果顯示miR-206、CDK4表達水平與神經腦膠質瘤患者腫瘤長徑、病理分級、腫瘤組織壞死有關(均P<0.05),與患者性別、年齡無關(均P>0.05),見表3。
2.4 miR-206、CDK4表達水平與神經腦膠質瘤患者預后的關系 對74例神經腦膠質瘤患者進行為期36個月的隨訪,Kaplan-Meier法分析顯示,miR-206高表達患者的PFS中位時間28.12個月、無進展生存率45.95%,顯著高于miR-206低表達患者的PFS中位時間16.69個月、無進展生存率32.35%;CDK4陽性表達患者的PFS中位時間16.32個月、無進展生存率35.71%,顯著低于CDK4陰性表達患者的PFS中位時間27.38個月、無進展生存率45.72%,詳見圖2。
2.5 影響神經腦膠質瘤患者預后的危險因素分析COX單因素分析顯示miR-206表達水平、CDK4表達水平、腫瘤長徑、WHO分級、腫瘤組織壞死是影響神經腦膠質瘤患者預后的危險因素,多因素分析結果顯示miR-206表達水平、CDK4表達水平是影響神經腦膠質瘤患者預后的獨立危險因素,詳見表4。
2.6 神經腦膠質瘤組織中miR-206、CDK4表達的相關性分析 Pearson相關性分析結果顯示miR-206和CDK4表達水平呈負相關(r=-0.642,P<0.001),詳見圖3A。生物信息學分析顯示CDK4與miR-206具有靶向關系,詳見圖3B。

表3 74例神經腦膠質瘤患者miR-206、CDK4表達水平與臨床病理特征的關系[例(%)]
3 討 論
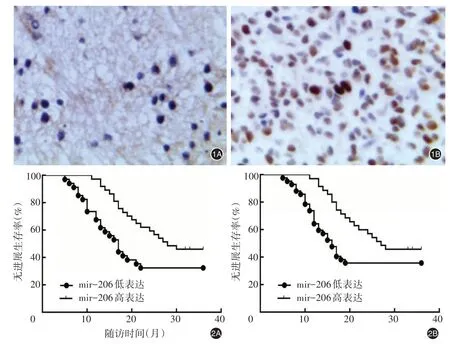

圖1 細胞周期依賴性激酶4(CDK4)在神經腦膠質瘤患者組織中的表達分析(HE染色 ×400);1A:陰性表達,1B:陽性表達 圖2 74例神經腦膠質瘤患者微小RNA-206(miR-206)(2A)和細胞周期依賴性激酶4(CDK4)(2B)表達水平與無進展生存率的關系 圖3 74例神經腦膠質瘤患者組織中微小RNA-206(miR-206)、細胞周期依賴性激酶4(CDK4)表達結果;3A:相關性分析,3B:生物信息學分析

神經腦膠質瘤是中樞神經系統中最常見、最具侵襲性、致命性顱內腫瘤[2]。生活方式改變和工作壓力增加,使神經腦膠質瘤發病率逐年升高。但神經膠質瘤的發病機制尚未完全清楚。研究表明,長期吸煙、酗酒、熬夜、環境污染、病毒感染、遺傳等多種因素與神經腦膠質瘤發生有關,目前尚未有研究表明某個因素與神經膠質瘤患者發病有直接因果關系[9]。隨著現代醫學科技的快速發展,如手術切除治療、放射療法、化學療法及綜合療法等應用于神經腦膠質瘤治療,但復雜的發病原因導致神經腦膠質瘤患者治療后總體預后較差[10]。因此,深入研究神經腦膠質瘤發生發展的分子機制,對神經腦膠質瘤患者病程監測及預后判斷有重要意義。
惡性腫瘤的發生發展與多種基因表達異常有關,miRNAs是一類特殊的非編碼小分子RNA,通過與靶基因3’UTR區域發生特異性結合,調控靶基因的表達,參與惡性腫瘤的發生發展及遷移過程[11]。已有研究表明miRNAs在神經腦膠質瘤的發生發展過程中發揮著關鍵作用。miR-200c在膠質瘤組織中低表達,抑制膠質瘤組織的生長和癌細胞的轉移[12],提示miRNA主要通過影響腫瘤組織的生長,參與膠質瘤的發展進程。miR-206是一種保守非編碼RNA小分子,與多種腫瘤發展進程密切相 關[13]。有 關 研 究 表 明,miR-206在神經腦膠質瘤中表達下調,其可通過直接靶向抑制卷曲蛋 白7(FZD7)mRNA WNT/β-catenin途徑,從而在神經腦膠質瘤中發揮腫瘤抑制作用,miR-206有可能是治療神經腦膠質瘤的潛在靶標[14]。此外,Hao等[5]研究發現miR-206在膠質母細胞瘤組織中表達下調,與腫瘤細胞增殖和侵襲有關。本研究結果顯示miR-206在神經腦膠質瘤組織中的表達水平顯著低于瘤周組織,與Zhou等[14]研究趨勢一致,表明miR-206表達水平 可能與神經腦膠質瘤發生有關。進一步研究發現miR-206表達水平與神經腦膠質瘤患者腫瘤長徑、病理分級、腫瘤組織壞死有關,提示miR-206可能參與調控癌細胞增殖,影響患者腫瘤大小和病理分級。Kaplan-Meier分析結果顯示miR-206低表達患者術后3年的無進展生存率顯著低于miR-206高表達患者,提示miR-206可能通過影響腫瘤大小、病理分級、核分裂程度,間接影響患者的預后。COX分析結果顯示miR-206表達水平是影響神經腦膠質瘤患者預后的獨立危險因素。以上研究結果提示miR-206低表達可能參與神經腦膠質瘤的發生過程,可能通過影響神經腦膠質瘤患者的發病進程,影響患者預后。

表4 COX回歸模型分析影響74例神經腦膠質瘤患者預后的危險因素
CDK4是一種細胞周期重要調控分子,能與細胞周期素D結合,促進細胞周期的轉換,它的活性與結合周期素依賴性激酶抑制素還是與周期素結合有關[15]。研究表明CDK4主要調控癌細胞G1期向S期轉換過程[16],提示CDK4表達可能與惡性腫瘤的進展有關。在膠質母細胞瘤中CDK4高表達,參與膠質母細胞瘤病程進展,抑制CDK4表達可改善患者病情發展[7],提示CDK4可能調控病程發展,影響患者治療效果。本研究結果顯示CDK4在神經腦膠質瘤組織中mRNA表達水平顯著高于瘤周組織,與Xu和Li[7]研究結果類似,表明CDK4可能參與神經腦膠質瘤發病過程。免疫組化結果顯示神經腦膠質瘤組織中CDK4蛋白陽性表達率顯著高于瘤周組織,表明CDK4在神經腦膠質瘤組織中的mRNA與蛋白表達水平存在一致性。進一步分析發現,CDK4蛋白表達與腫瘤大小、病理分級、核分裂有關,CDK4高表達患者術后無進展生存率顯著低于低表達者,提示CDK4高表達可能促進腫瘤增殖,導致不良預后。COX分析顯示CDK4表達水平是神經腦膠質瘤患者預后的獨立影響因素,提示檢測CDK4表達水平對神經腦膠質瘤患者預后判斷有一定意義。過往研究發現,miRNAs主要通過調控靶基因表達參與癌癥發展,Georgantas等[17]研究表明miR-206通過靶向調控CDK4表達誘導黑色素瘤G1期停滯。凌晨等[15]學者通過探討miR-206/CDK4信號在卵巢癌生長和化療增敏中的作用顯示,通過采用miR-206 mimics轉染卵巢癌細胞,CDK4表達呈現明顯抑制的情況,而在使用miR-206特異抑制劑后能明顯恢復CDK4在卵巢癌細胞中的表達,另外熒光素酶報告基因活性分析顯示,miR-206能特異結合到CDK4 3’UTR,抑制熒光素酶活性,因此其認為miR-206通過直接靶基CDK4,從而抑制細胞周期其他因子的表達,降低卵巢癌細胞的生長。還有學者實驗研究發現,轉染miR-206前列腺癌細胞中CDK4和細胞周期素G相關蛋白激酶(GAK)的表達水平顯著降低,因此其認為miR-206可干擾兩者的表達[18]。而本研究結果顯示miR-206與CDK4 mRNA水平呈負相關,且生物信息學分析顯示miR-206可靶向結合CDK4,提示miR-206可能通過靶向結合CDK4,進而參與神經腦細胞瘤發病進程,影響患者預后。
綜上所述,miR-206在神經腦膠質瘤組織中表達下調,CDK4表達上調,miR-206可能通過負向調控CDK4表達參與神經腦膠質瘤發病進程,影響患者預后。本研究樣本量較少,可能存在一定實驗誤差;此外,miR-206對CDK4調控機制有待進一步研究。
利益沖突:作者已申明文章無相關利益沖突。

