NOD2基因在巨噬細胞抗結核分枝桿菌中的作用
朱莉萍,賈春敏,陳南山
(1.武漢市金銀潭醫院 ICU,武漢 430040;2.武漢市金銀潭醫院 內科,武漢 430040;3.武漢市金銀潭醫院 結核科,武漢 430040)
結核分枝桿菌是結核病的致病菌,人體感染結核分枝桿菌后,大多數感染者處于潛伏狀態,約有5%的感染者出現臨床癥狀,這種差異主要是由宿主的免疫力不同引起的[1]。當結核分枝桿菌經呼吸道進入肺組織時,肺泡中的巨噬細胞將通過吞噬作用控制或消除結核分枝桿菌的感染[2]。巨噬細胞表達的PRR在上述過程中具有重要作用,如細胞表面的TLR和細胞內的核苷酸結合寡聚化結構域樣受體(nucleotide binding oligomerization domain-like receptor,NLR)[3-4]。核苷酸結合寡聚化結構域2(nucleotide binding oligomerization domain 2,NOD2)是NLR家族的成員。研究發現,NOD2可通過誘導一氧化氮和抗菌肽防御素4B的分泌參與人肺泡巨噬細胞抗結核分枝桿菌感染的免疫過程[5]。鑒于炎癥反應[6]和自噬[7]在巨噬細胞的免疫過程中具有重要作用,本研究利用人巨噬細胞U937對結核分枝桿菌的吞噬能力,試從炎癥反應、自噬角度分析NOD2基因在巨噬細胞抗結核分枝桿菌免疫反應中的作用。
1 材料與方法
1.1 樣本來源及分組人巨噬細胞U937購自上海子實生物科技有限公司,結核分枝桿菌購自上海恒斐生物科技有限公司。以受結核分枝桿菌感染的U937細胞為感染組, 以未經結核分枝桿菌感染的U937細胞為對照組。
1.2 試劑與儀器Lipofectamine 3000轉染試劑盒購自Invitrogen公司,反轉錄試劑盒購自GeneCopoeia公司,引物由蘇州泓迅生物科技股份有限公司合成,ELISA試劑盒購自南京森貝伽生物科技有限公司,蛋白一抗IL-6兔多克隆抗體、IL-8兔多克隆抗體、TNF-α抗體購自Proteintech公司。細胞培養箱購自上海玉研科學儀器有限公司,酶標儀、qRT-PCR儀購自BIORAD公司,全自動凝膠成像儀購自北京大龍興創實驗儀器有限公司,超凈工作臺購自江蘇蘇凈集團,高壓滅菌鍋購自江陰濱江醫療設備有限公司,水浴鍋購自上海一恒科學儀器有限公司,離心機購自SCILOGEX有限公司,移液槍購自Eppendorf公司,培養皿、無菌離心管、24孔板、96孔板購自Corning公司。
1.3 方法
1.3.1 細胞培養 從液氮罐中取出U937細胞,置37 ℃水浴中快速解凍。低速離心后棄上清液,加入培養液吹打細胞,混勻后將其培養于37 ℃、5%CO2培養箱中。當細胞密度過大時,吸出細胞液于離心管中,低速離心后棄上清液,加入新的培養液適度稀釋細胞,再將其轉移至新的培養瓶中培養。收集對數生長期細胞,低速離心后棄上清液,將細胞重懸于細胞凍存液中,放入細胞凍存盒,于-80 ℃冰箱放置過夜,次日移入液氮罐中保存。
1.3.2 細胞轉染 根據參考文獻[8]合成NOD2 siRNA引物序列。將U937細胞以2×106個/mL密度接種于96孔板,參照Lipofectamine 3000轉染試劑盒說明書中的步驟進行操作。每組設置5個復孔,將NOD2 siRNA和無序序列(NC)轉染至U937細胞,繼續培養4 h,再用無血清培養液洗滌細胞,加入培養液,置于37 ℃、5%CO2培養箱中培養。
1.3.3 內吞細菌試驗 采用平板劃線法得到結核分枝桿菌單個菌落,將結核分枝桿菌和轉染的細胞重懸于培養液中,調整細菌密度(650 nm波長處的光密度約為0.6)。將處于對數生長期的U937細胞接種于24孔板(1×105個/孔),培養24 h,再更換為不含抗生素的培養液繼續培養30 min。將細菌以10∶1的比例與U937細胞混合,置37 ℃、5%CO2培養箱中培養30 min。用預冷緩沖液沖洗細胞外細菌,并加入含有慶大霉素的培養液,殺死殘留在細胞膜上的細菌。
1.3.4 菌落計數 收集內吞結核分枝桿菌的U937細胞,低速離心后棄上清液,裂解細胞,均勻涂板,于37 ℃培養12~24 h,觀察菌落生長情況并計數。計算U937細胞對結核分枝桿菌的殺傷率:48 h時的殺傷率為(lgN24 h-lgN48 h)/lgN24 h×100%,72 h時的殺傷率為(lgN24 h-lgN72 h)/lgN24 h×100%,N為平均菌落數。
1.3.5 U937細胞中NOD2 mRNA表達的qRT-PCR檢測 收集內吞結核分枝桿菌的U937細胞,完全裂解細胞后,以氯仿-異丙醇體系提取細胞中總RNA,經反轉錄擴增合成cDNA,混入SYBR GREEN Mix進行qRT-PCR。根據參考文獻[9]設計NOD2和GADPH的引物序列(表1)。參數設置:94 ℃預變性3 min;94 ℃變性20 s、55 ℃退火20 s、72 ℃延伸1 min,共30個循環。采用2-ΔΔCt法,以GADPH的表達為內參,計算NOD2 mRNA的相對表達量。

表1 qRT-PCR引物
1.3.6 細胞上清液中細胞因子水平的ELISA檢測 收集內吞結核分枝桿菌的U937細胞上清液,根據ELISA試劑盒說明書中的步驟進行操作,檢測細胞上清液中IL-6、IL-8及TNF-α的水平。
1.3.7 細胞中相關蛋白表達的Western blotting檢測 收集內吞結核分枝桿菌的U937細胞,充分裂解后以12 000×g離心10 min,取上清蛋白液。檢測蛋白濃度后取70 μg蛋白混入蛋白上樣緩沖液,置于100 ℃水浴變性10 min。配制10%濃縮膠和5%分離膠,進行電泳。待蛋白完全分離后在冰上濕轉至PVDF膜。取出PVDF膜, 將其浸于5%脫脂牛奶中,室溫下孵育2 h,封閉非特異性位點。洗膜3次,置于相應的蛋白一抗中,4 ℃孵育過夜。洗膜3次,浸于蛋白二抗中,37 ℃反應40 min。洗膜3次,添加化學發光劑,應用全自動凝膠成像儀顯示蛋白條帶。以β-actin的表達為內參,計算細胞中p62和微管相關蛋白輕鏈3(microtubule-associated protein light chain 3, LC3)的表達水平。
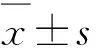
2 結果
2.1 各組細胞內NOD2mRNA表達水平的比較采用qRT-PCR檢測各組細胞中NOD2 mRNA的表達。結果顯示,與對照組比較,感染組U937細胞中NOD2 mRNA的表達水平顯著上升(P<0.05);與NC組比較,NOD2 siRNA組U937細胞中NOD2 mRNA的表達水平顯著下降(P<0.05)。(圖1)
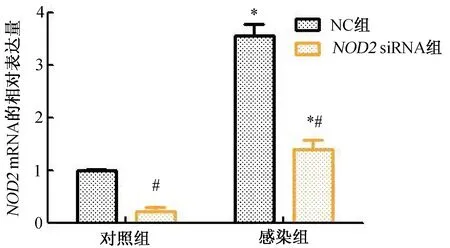
注:與對照組比較,*P<0.05;與NC組比較,#P<0.05。圖1 各組細胞內NOD2 mRNA表達水平的比較
2.2 NOD2對U937細胞吞噬能力的影響于吞噬24、48及72 h時收集細胞,檢測U937細胞中的結核分枝桿菌密度。與NC組比較,不同時間點NOD2 siRNA組U937細胞中的結核分枝桿菌密度明顯降低(P<0.05, 圖2);吞噬48及72 h,NC組U937細胞對結核分枝桿菌的殺傷率分別為(38.41±5.69)%和(61.16±8.23)%,NOD2 siRNA組U937細胞對結核分枝桿菌的殺傷率分別為(36.98±5.27)%和(57.28±7.49)%,2組差異均無統計學意義(均P>0.05)。
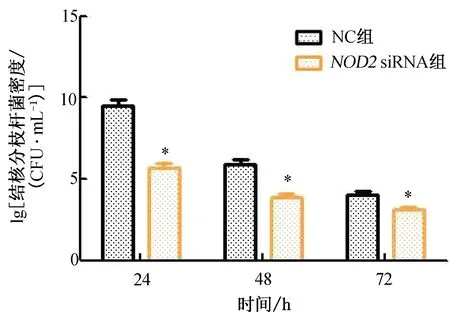
注:與NC組比較,*P<0.05。圖2 NOD2對U937細胞吞噬能力的影響
2.3 NOD2對U937細胞上清液中細胞因子水平的影響與對照組比較,感染組上清液中IL-6、IL-8及TNF-α水平顯著上升(P<0.05);與NC組比較,NOD2 siRNA組上清液中IL-6、IL-8及TNF-α水平顯著下降(P<0.05)。(圖3)
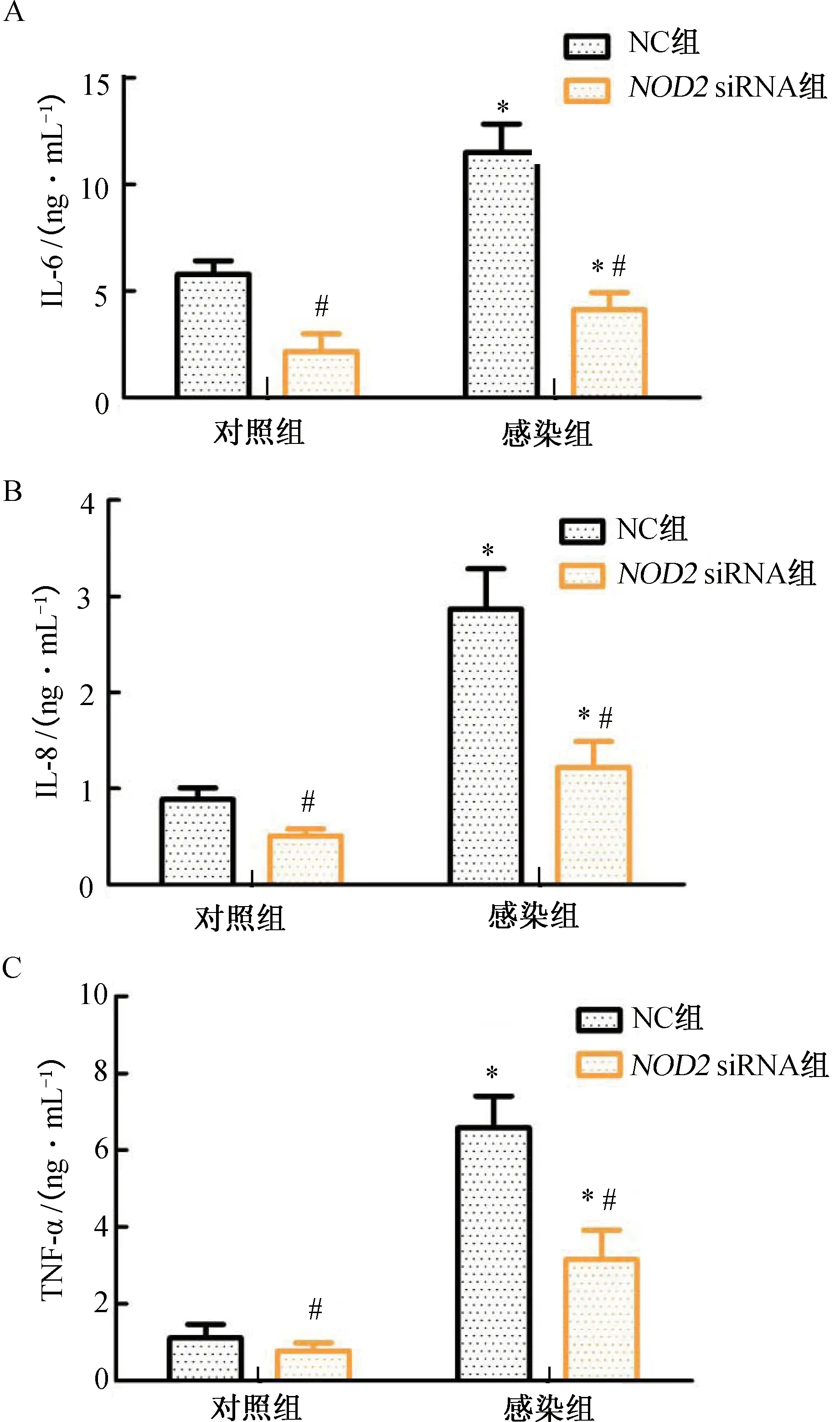
注:A.IL-6表達量;B.IL-8表達量;C.TNF-α表達量。與對照組比較,*P<0.05;與NC組比較,#P<0.05。圖3 NOD2對U937細胞上清液中細胞因子水平的影響
2.4 NOD2對U937細胞自噬的影響與對照組比較,感染組U937細胞中p62、LC3Ⅰ/LC3Ⅱ水平顯著上升(P<0.05);而NC組與NOD2siRNA組U937細胞中p62、LC3Ⅰ/LC3Ⅱ水平比較, 差異無統計學意義(P>0.05)。(圖4)
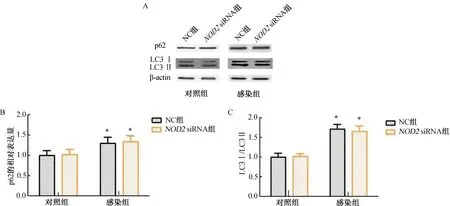
注:A.p62、LC3Ⅰ/LC3Ⅱ蛋白條帶圖;B.p62的相對表達量;C.LC3Ⅰ/LC3Ⅱ水平。與對照組比較,*P<0.05。圖4 NOD2對U937細胞自噬的影響
3 討論
巨噬細胞是固有免疫系統的重要組成部分,主要分布于肺泡上皮細胞表面,可通過自身的PRR對入侵的細菌產生免疫反應[10]。研究發現,結核分枝桿菌進入人體后,會被巨噬細胞吞噬,巨噬細胞同時募集多種免疫細胞,形成結核性肉芽腫組織;若肉芽腫組織無法控制病原菌的復制,會形成干酪樣壞死結構,并釋放被包裹著的病原菌,最終發展成結核病[11]。肉芽腫組織在結核病的發生、發展中具有雙重作用:一方面,肉芽腫組織可在一定程度上限制病原菌的復制、擴散;另一方面,肉芽腫組織也有“屏蔽”其他免疫細胞及外源性藥物的作用[12]。而巨噬細胞不僅是結核分枝桿菌主要的效應細胞,也是其主要的寄生場所。Gordon等[13]研究發現,巨噬細胞功能與結核性肉芽腫組織的形成、轉歸密切相關。本研究發現,巨噬細胞U937感染結核分枝桿菌后,細胞中NOD2 mRNA的表達水平顯著上調,提示NOD2可能參與了U937細胞對結核分枝桿菌的免疫反應,這與Landes等[14]的研究結果相符。
為進一步探究NOD2在巨噬細胞吞噬結核分枝桿菌中的作用,本研究將NOD2 siRNA轉染U937細胞。結果顯示,沉默NOD2后U937細胞中NOD2 mRNA的表達水平顯著下降,這提示U937細胞中NOD2基因干擾成功。巨噬細胞抵抗病原菌感染時會分泌多種細胞因子,如IL-6、IL-8及TNF-α等,其中IL-6和TNF-α具有促炎作用,而IL-8屬于趨化因子,可促進巨噬細胞的聚集[15]。本研究結果顯示,沉默NOD2基因后U937細胞對結核分枝桿菌的吞噬能力及細胞上清液中IL-6、IL-8、TNF-α的表達水平顯著下降,但其殺傷能力并無變化。這可能是因為敲低NOD2的表達后,U937細胞的吞噬數量減少,使其效應炎癥反應強度減弱,不利于巨噬細胞殺傷結核分枝桿菌,這也再次驗證了NOD2基因可影響巨噬細胞抗結核分枝桿菌的免疫反應,這一效應可能與其介導炎癥反應有關。
自噬是機體高度保守且受精密調控的過程,對于細胞穩態、生長分化等有重要作用。有效的自噬對巨噬細胞清除結核分枝桿菌至關重要。研究發現,結核分枝桿菌感染后會阻礙自噬體的融合與成熟,從而抑制細胞自噬[16]。LC3和p62在自噬體的形成過程中有重要作用。本研究發現,巨噬細胞感染結核分枝桿菌后,細胞中p62、LC3Ⅰ/LC3Ⅱ水平顯著上調,這提示結核分枝桿菌感染會降低巨噬細胞的自噬水平。但沉默NOD2后,細胞中p62、LC3Ⅰ/LC3Ⅱ水平無明顯變化,這提示NOD2在自噬過程中可能不發揮主要作用。
綜上所述,巨噬細胞感染結核分枝桿菌后,細胞中NOD2 mRNA的表達水平異常升高,而沉默NOD2 后巨噬細胞吞噬結核分枝桿菌的能力下降,這表明NOD2基因可能參與巨噬細胞抗結核分枝桿菌的免疫過程,可能與誘導IL-6、IL-8及TNF-α的分泌有關。但人體免疫系統是一個復雜且精密的系統,NOD2在抗結核分枝桿菌感染中的免疫作用尚需利用動物模型進一步驗證。

