基質(zhì)金屬蛋白酶及其抑制劑與口腔扁平苔蘚相關(guān)性研究進(jìn)展*
張紫欣 綜述 劉 雪 審校
(濟(jì)寧醫(yī)學(xué)院口腔醫(yī)學(xué)院,濟(jì)寧 272013)
口腔扁平苔蘚(oral lichen planus,OLP)是一種常見的慢性炎癥性口腔黏膜疾病,其組織病理學(xué)特征為:伴隨密集亞上皮性淋巴細(xì)胞的浸潤,基底膜被破壞、基底角質(zhì)細(xì)胞發(fā)生凋亡。基質(zhì)金屬蛋白酶(matrix metalloproteinase,MMPs)可以通過降解細(xì)胞外基質(zhì)中的多種蛋白成分造成基底膜的損傷,并參與炎癥、變性、腫瘤轉(zhuǎn)移等相關(guān)病理過程。目前學(xué)術(shù)界關(guān)于OLP發(fā)病機(jī)制較為主流的觀點(diǎn)是:該疾病的發(fā)生發(fā)展由抗原特異性機(jī)制——細(xì)胞毒性T細(xì)胞的激活和非特異性機(jī)制——肥大細(xì)胞脫顆粒MMPS激活所介導(dǎo)[1]。金屬蛋白酶組織抑制劑(tissue inhibitor of metalloproteinase,TIMPs)通過直接抑制或間接活化酶原抑制MMPs的活性來維持其與MMPs的動(dòng)態(tài)平衡[2]。OLP患者血清中MMPs的水平異常上調(diào),TIMPs水平異常下調(diào),提示OLP及其癌變與MMPs及TIMPs之間平衡狀態(tài)的打破有著緊密聯(lián)系。
1 MMPs的種類、特點(diǎn)與功能
MMPs是一類依賴Zn2+和Ca2+的蛋白水解酶,目前已分離鑒別出26個(gè)成員,分別命名為MMP1-26。根據(jù)MMPs的底物特異性和結(jié)構(gòu)特征,MMPs一般被分為6類:膠原酶類(MMP-1、MMP-8、MMP-13、MMP-18)、明膠酶類(MMP-2、MMP-9)、基質(zhì)降解酶類(MMP-7、MMP-26)、間質(zhì)溶解素類(MMP-3、MMP-10、MMP-11)、膜型基質(zhì)金屬蛋白酶 (MT-MMP) 和其他類(MMP-12、MMP-19、MMP-20、MMP-21、MMP-23、MMP-27、MMP-28)[3]。
MMPs以酶原的形式維持細(xì)胞外基質(zhì)(extracellular matrix,ECM)的正常組織結(jié)構(gòu)和功能,并在組織重建和細(xì)胞間多種可溶性因子的調(diào)控過程中發(fā)揮重要作用,尤其在腫瘤的發(fā)生、侵襲和轉(zhuǎn)移過程中有極其突出的表現(xiàn),其催化機(jī)制依賴于活化中心Zn2+、Ca2+的活性和穩(wěn)定性。
2 TIMPs的種類、特點(diǎn)與功能
TIMPs是內(nèi)源性的基質(zhì)金屬蛋白酶抑制劑(MMP inhibitor,MMPI),是一種低分子量分泌型蛋白家族,對MMPs有特異性強(qiáng)效抑制作用,但TIMPs半衰期短、易失活,故其在臨床上的應(yīng)用具有一定局限性[3]。目前TIMPs家族已經(jīng)發(fā)現(xiàn)了4位成員,即:TIMP-1、TIMP-2、TIMP-3、TIMP-4。TIMP-1廣泛存在于體液與機(jī)體組織中,除對MMP-19、MMP-14、 MMP-16、 MMP-24親和力較低以外,對其他MMPs均有較好的抑制作用。
TIMPs不僅可以有效抑制機(jī)體內(nèi)MMPs的過度表達(dá),還可以直接與細(xì)胞膜表面特異性受體結(jié)合,借助細(xì)胞膜表面信號傳導(dǎo)通路,在刺激細(xì)胞增殖的同時(shí),抑制細(xì)胞凋亡,精細(xì)調(diào)控細(xì)胞分化并協(xié)調(diào)組織新生血管的形成[4]。
3 MMPs與TIMPs的動(dòng)態(tài)平衡
基質(zhì)蛋白的分解以及組織結(jié)構(gòu)的重建由TIMPs與MMPs共同參與調(diào)節(jié)。在正常機(jī)體中,TIMPs的合成和降解受到MMPs的調(diào)節(jié),并且二者按1∶1的比例存在一定的平衡關(guān)系。當(dāng)MMPs與TIMPs 之間的平衡被打破時(shí),細(xì)胞外基質(zhì)的降解與合成會發(fā)生紊亂,導(dǎo)致其正常生理功能失調(diào),造成皮膚膠原變少,皮膚變薄[5],進(jìn)而誘導(dǎo)皮膚和黏膜部位發(fā)生病變。
4 MMPs、TIMPs與OLP發(fā)病機(jī)制
4.1 OLP的免疫致病機(jī)制
與OLP病因相關(guān)的自身免疫因素,尤其是細(xì)胞功能的紊亂,在疾病的發(fā)生及演變中起著重要作用[6]。在OLP的發(fā)病過程中,抗原特異性與抗原非特異性機(jī)制均參與其中,后者主要包括肥大細(xì)胞的去顆粒化和MMPs的活化,細(xì)胞因子、趨化激素與MMPs等物質(zhì)由OLP病損部位的肥大細(xì)胞釋放,促進(jìn)了 T 淋巴細(xì)胞激活、移動(dòng)、增生與分化[7]。
在OLP的發(fā)病機(jī)制中,角質(zhì)形成細(xì)胞作為靶細(xì)胞被某種未知的抗原攻擊,并通過其趨化因子吸引免疫細(xì)胞聚集。隨后,樹突狀細(xì)胞增多并進(jìn)行抗原的呈遞,CD4+T細(xì)胞被激活并分泌可促進(jìn)CD8+T細(xì)胞等免疫細(xì)胞活化增殖的各類細(xì)胞因子。最后,增殖活化的CD4+T細(xì)胞和CD8+T細(xì)胞通過釋放各種細(xì)胞因子和MMPs促使角質(zhì)細(xì)胞的凋亡,引起OLP的病理性損傷[8]。因此,MMPs能促進(jìn)基底膜發(fā)生降解,受損的基底膜可能無法提供角質(zhì)細(xì)胞存活信號,導(dǎo)致角質(zhì)細(xì)胞凋亡。此外,基底膜降解可促使CD8+細(xì)胞毒性T細(xì)胞進(jìn)入上皮,導(dǎo)致角質(zhì)細(xì)胞的進(jìn)一步死亡[9]。由此可以推斷,MMPs在OLP的免疫致病機(jī)制中發(fā)揮著重要作用。見圖1。
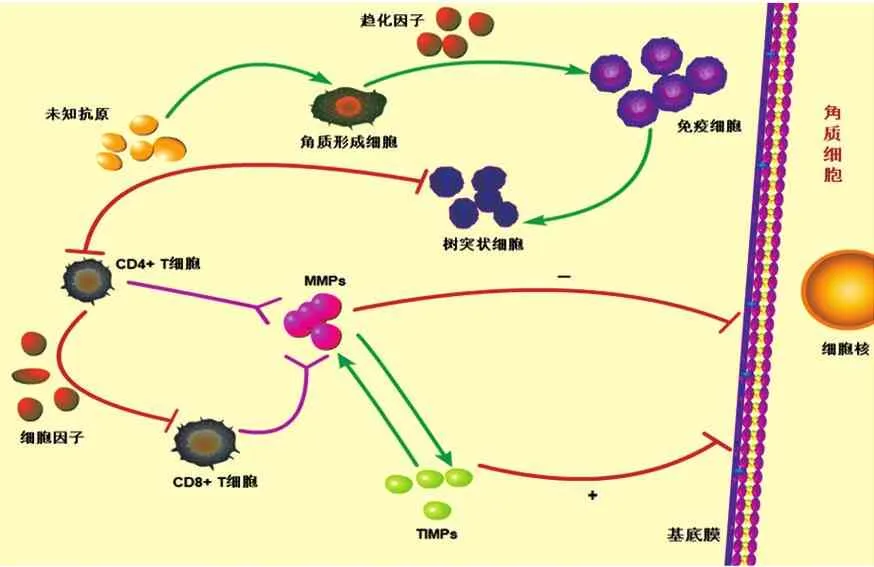
圖1 MMPs及TIMPs在OLP病變發(fā)生發(fā)展中的相互作用機(jī)制
4.2 MMPs及TIMPs在OLP致病機(jī)制中的作用
MMPs與其抑制劑TIMPs之間的平衡失調(diào)對OLP病損部位基底細(xì)胞的損傷及重建中有著重要的影響。IV型膠原成分是基底膜中最主要的組成部分,只有像MMP-1、MMP-2、MMP-3、MMP-9和MMP-10這樣的IV型膠原酶才能特異性地降解IV型膠原成分,并在此基礎(chǔ)之上損壞基底膜的連續(xù)性與完整性。
MMPs家族中分布最廣泛的成員是MMP-2,MMP-2可以通過降解IV型膠原來破壞基底膜,從而參與OLP的炎癥損傷過程,并且在一定程度上與腫瘤的侵襲轉(zhuǎn)移有關(guān)[10]。MMP-2極有可能參與了OLP的發(fā)生、發(fā)展和癌變,而MMP-2與TIMP-2之間的平衡失調(diào)也可能是導(dǎo)致OLP的誘因之一[11]。
MMPs是ECM降解所必需的蛋白水解酶,MMP-13在某種程度上可激活MMP-9和MMP-2,進(jìn)而破壞ECM[12],而MMP-9與MMP-2同屬可特異性降解基底膜帶IV型膠原的明膠酶類,可促進(jìn)淋巴細(xì)胞的轉(zhuǎn)移,過表達(dá)的MMP-9特異性降解基底膜,進(jìn)而導(dǎo)致角質(zhì)形成細(xì)胞凋亡,同時(shí)角質(zhì)形成蛋白分泌基底膜結(jié)構(gòu)蛋白的能力大大降低,受損基底膜的修復(fù)功能因此失調(diào),致使基底膜的損傷進(jìn)一步加劇。損傷的基底膜產(chǎn)生存活素的能力減弱,不僅使角質(zhì)形成細(xì)胞的凋亡加快,而且為T細(xì)胞向表皮內(nèi)的移入創(chuàng)造了條件,使局部炎癥反應(yīng)進(jìn)一步放大[13]。MMP-9與機(jī)體基底膜帶的破損有著密切關(guān)系,MMP-9參與了OLP的病理過程,可能通過擴(kuò)張血管,使得血管基底膜帶的崩解或喪失,導(dǎo)致機(jī)體的血腦屏障受到嚴(yán)重破壞[14]。TIMP-1表達(dá)水平隨著MMP-2和MMP-9活性的升高而增加的原因可能是:高表達(dá)的MMP-9對基底膜造成了損傷,為促進(jìn)基底膜的修復(fù),機(jī)體損傷修復(fù)系統(tǒng)被激活,促使TIMP-1的濃度增加,為阻止基底膜被進(jìn)一步破壞,TIMP-1還具有生長因子活性[15]。但朱建華等[16]研究顯示:MMP-9的表達(dá)水平雖然升高,但隨著OLP病情加重,TIMP-1的含量并無明顯升高,其原因可能是與TIMP-l的同源抑制劑如TIMP-2的表達(dá)水平升高有關(guān),導(dǎo)致雖然OLP病情加重,但TIMP-1的表達(dá)水平升高不明顯。
MMP-3也在OLP病程中發(fā)揮重要作用。MMP-3表達(dá)水平可以作為OLP患者和牙周炎患者預(yù)后的動(dòng)態(tài)檢測指標(biāo)之一[17-18]。除此之外,MMP-1、MMP-7、MMP-8、MMP-10的表達(dá)水平在OLP病理組織中有所升高。
綜上所述,在OLP的病損部位,多種MMPs都呈現(xiàn)高表達(dá)或過表達(dá)現(xiàn)象,而正常組織MMPs的表達(dá)水平非常低,只有當(dāng)機(jī)體需要進(jìn)行組織重塑時(shí),MMPs的產(chǎn)生和激活才會被迅速誘導(dǎo),提示在OLP病變過程中MMPs家族所介導(dǎo)的反應(yīng)可能直接影響OLP的發(fā)展進(jìn)程,且均與腫瘤癌變進(jìn)程有一定的關(guān)聯(lián)。MMPs與TIMPs之間的平衡關(guān)系也對ECM的降解和基底膜區(qū)的破壞有著重要影響,OLP患者病損部位MMP-9和TIMP-1的表達(dá)水平可作為預(yù)測OLP發(fā)生、惡化及預(yù)后評估的指標(biāo)。
5 MMPs與OLP癌變
OLP已被WHO界定為癌前狀態(tài)疾病,OLP惡性轉(zhuǎn)化率可達(dá)2.28%。OLP絕大多數(shù)癌變?yōu)楦叻只目谇击[狀細(xì)胞癌(oral squamous cell carcinoma,OSCC)。吸煙、酒精、免疫抑制劑、慢性炎癥、某些病毒、基因突變的積累以及新鮮水果和蔬菜的低飲食增加了OLP患者的惡性轉(zhuǎn)化風(fēng)險(xiǎn)。OLP病理組織中MMPs的高水平表達(dá)[17,20-24]可介導(dǎo)作為物理屏障的細(xì)胞外基質(zhì)的破壞和基底膜的過度降解,從而誘導(dǎo)癌細(xì)胞浸潤,進(jìn)而發(fā)生擴(kuò)散轉(zhuǎn)移,加快OLP癌變進(jìn)程。
在網(wǎng)格型OLP、侵蝕性O(shè)LP、OSCC早期和OSCC晚期患者的唾液和血清中,MMP-3的濃度順次升高且差異具有統(tǒng)計(jì)學(xué)意義,提示唾液和血清中MMP-3的濃度與惡變的程度為正相關(guān),表明MMP-3有可能作為診斷OLP和OSCC以及其預(yù)后評價(jià)的血清學(xué)標(biāo)志物[17]。抑癌基因RECK具有TIMPs的功能,能在轉(zhuǎn)錄水平上抑制各類MMPs的生物活性。根據(jù)MMP-2表達(dá)水平的依次增加可推測其在OLP致病機(jī)制中起到一定作用且金屬蛋白酶抑制劑RECK表達(dá)的高低可作為判斷OLP癌變潛能的檢測指標(biāo)之一[20]。
MMP-9組織內(nèi)高表達(dá),進(jìn)而破壞基底膜被廣泛認(rèn)為是惡性細(xì)胞轉(zhuǎn)移侵襲的關(guān)鍵動(dòng)作,MMP-9協(xié)助惡性細(xì)胞在OLP和OSCC組織中發(fā)生了侵襲和轉(zhuǎn)移,促進(jìn)了OSCC的發(fā)展,佐證了MMP-9在OLP癌變的過程中發(fā)揮著關(guān)鍵作用,還有研究認(rèn)為MMP-9可以作為檢測OSCC分級的血清學(xué)標(biāo)志物之一[21]。
大量研究通過對比健康群體和OSCC患者體內(nèi)MMPs的表達(dá)水平,從而進(jìn)一步證明MMPs與OLP癌變具有密切聯(lián)系。MMP-9在OSCC患者唾液中的表達(dá)顯著高于健康對照組,且低分化的OSCC組唾液中MMP-9的平均水平顯著高于中、高分化OSCC組,提示MMP-9表達(dá)水平的高低可以作為OSCC診斷、治療和隨訪的血清學(xué)標(biāo)志物[22]。OSCC患者血清中MMP-2及MMP-9水平較健康受試者均明顯升高,MMP-2與腫瘤分級和淋巴結(jié)受累均顯著相關(guān),然而MMP-9僅與淋巴結(jié)受累有關(guān)[23]。可見MMP-9是否可以作為腫瘤分級的血清學(xué)標(biāo)志物有待進(jìn)一步研究。OSCC患者唾液中MMP-1的表達(dá)水平顯著高于健康對照組。綜上所述,OSCC患者血清中MMP-1,MMP-2,MMP-3以及MMP-9的表達(dá)水平都存在不同程度的上調(diào),推進(jìn)了癌細(xì)胞的浸潤度和轉(zhuǎn)移性,從而破壞了機(jī)體正常的組織學(xué)屏障[24]。明確OLP癌變標(biāo)志物可幫助臨床評估OLP癌變風(fēng)險(xiǎn)以及早期腫瘤分級,MMPs種類眾多,各成員能否作為OLP癌變的血清學(xué)檢測標(biāo)志物目前仍不明確。
6 小結(jié)與展望
OLP的發(fā)生發(fā)展和癌變與血清、唾液中MMPs的異常高表達(dá)以及MMPs/TIMPs的平衡失調(diào)有著密切關(guān)系。OLP作為一種癌前病變,定期對患者體內(nèi)MMPs表達(dá)水平以及MMPs/TIMPs比值進(jìn)行監(jiān)測,對于早期診斷OLP是否存在惡性轉(zhuǎn)化的不良征象尤為重要。因此,臨床上可通過檢測病變組織的MMPs表達(dá)水平以及MMPs/TIMPs比值來作為診斷和監(jiān)測OLP病情發(fā)展及癌變的參考指標(biāo)。
眾多因素的干擾導(dǎo)致OLP難治愈、病程長,亟需對OLP與MMPs及TIMPs的潛在相關(guān)性進(jìn)行科學(xué)、深入的研究,以期為臨床有效防治OLP提供可靠的理論依據(jù)。
 濟(jì)寧醫(yī)學(xué)院學(xué)報(bào)2021年2期
濟(jì)寧醫(yī)學(xué)院學(xué)報(bào)2021年2期
- 濟(jì)寧醫(yī)學(xué)院學(xué)報(bào)的其它文章
- 護(hù)理專業(yè)《藥物學(xué)基礎(chǔ)》課程思政的探討與實(shí)踐*
- 情境模擬教學(xué)法應(yīng)用于婦產(chǎn)科腹部手術(shù)患者術(shù)后護(hù)理的教學(xué)效果*
- 基于云班課的翻轉(zhuǎn)課堂教學(xué)實(shí)踐
——以藥學(xué)專升本《有機(jī)化學(xué)》課程為例* - 髖臼骨折治療研究進(jìn)展
- 腹腔鏡聯(lián)合術(shù)前使用亮丙瑞林治療子宮內(nèi)膜異位癥的Meta分析*
- 舒適化護(hù)理聯(lián)合線上探視模式在重癥監(jiān)護(hù)室中的應(yīng)用
