一起雞H9亞型禽流感和傳染性支氣管炎共感染病例的診斷
孟斌,郭繁霞,王紅梅,孫培明,薛聰*
一起雞H9亞型禽流感和傳染性支氣管炎共感染病例的診斷
孟斌1,郭繁霞2,王紅梅3,孫培明1,薛聰*1
(1.臨沂大學農林科學學院,山東 臨沂 276000;2.臨沂科技職業學院,山東 臨沂;3.山東省莒南縣檢驗檢測中心,山東 莒南)
為了對送檢的一起以呼吸道癥狀為主要臨床表現,以氣管黏膜彌漫性出血、肺臟出血為主要剖檢變化的病例進行診斷,本試驗采集病死雞組織樣本進行RT-PCR以及測序鑒定。結果表明,使用H9亞型禽流感病毒HA基因、雞傳染性支氣管炎病毒M基因特異性引物,分別可以擴增獲得528 bp、740 bp的目的片段。測序分析結果進一步確證該病例為H9亞型禽流感病毒和雞傳染性支氣管炎病毒混合感染所致。
隨著我國養禽業的快速發展和養殖規模的不斷擴大,雞的傳染病尤其是呼吸道疫病的發生逐漸增加并趨于復雜化。在雞群中,有一類由多種致病因子協同作用,形成很難用針對單個病原體的方法防制的復合型呼吸道疾病[1]。其中,禽流感病毒(Avian influenza virus, AIV)H9亞型和傳染性支氣管炎病毒(Infectious bronchitis virus,IBV)是臨床常見的兩種呼吸道病毒。
H9亞型AIV屬于正黏病毒科,A型流感病毒屬,是H9亞型禽流感(Avian influenza, AI)的病原。雞感染H9亞型AI后會出現呼吸道癥狀、產蛋率下降、孵化率降低、免疫力降低。IBV屬于冠狀病毒科(Coronaviridae),冠狀病毒屬(Coronavirus),可以導致雞傳染性支氣管炎(Infectious bronchitis,IB)。IBV主要侵害雞的呼吸系統、消化系統和泌尿生殖系統,導致呼吸道癥狀,產蛋率下降、產畸形蛋以及腹瀉。H9亞型AI和IB兩種呼吸道疾病都能通過空氣在雞群迅速傳播,咳出的飛沫經呼吸道傳播,經污染的飲水、飼料等間接地經消化道傳播,并且兩者的混合感染時有發生[2]。本試驗基于山東省臨沂市某雞場的呼吸道癥狀病雞,經臨床診斷初步確定為H9亞型AI和IB混合感染,進一步采集組織樣本進行RT-PCR檢測、測序驗證,最終確診為H9亞型AIV和IBV混合感染。
1 材料與方法
1.1 試驗材料 動物組織總RNA提取試劑盒、DNA提取試劑盒、M-MLV購自杭州新景生物公司;RNA酶抑制劑、2×Taq PCR MasterMix(含染料)購自北京索萊寶生物公司;dNTP Mixture(10 mM)購自寶日醫生物公司;GeneGreen核酸染料、DNA Marker、瓊脂糖凝膠回收試劑盒購自天根生化科技公司。無水乙醇、DEPC等化學試劑均為國產分析純產品。
1.2 樣品采集與處理 2019年12月,山東臨沂某養雞場飼養的25日齡雛雞出現明顯呼吸道癥狀,大群表現為精神不振、食欲減退,咳嗽、噴嚏、氣管啰音,并伴有呼吸困難表現。癥狀嚴重的雛雞迅速消瘦,繼而死亡,給養殖戶造成較大的經濟損失。剖檢病死雞,記錄眼觀病變,并采集氣管、肺臟等病料作為檢測樣品。
1.3 核酸提取 將采集的病理組織樣品,按照核酸提取試劑盒說明書所述方法提取核酸,用于后續病原檢測。
1.4 病原檢測 根據GenBank發表的H9亞型AIV HA基因保守區序列,設計一對特異性檢測引物Flu-H9-F、Flu-H9-R(見表1)。IBV檢測引物參照《雞傳染性支氣管炎診斷技術》(GB/T 23197-2008)。另外,參照文獻[3]方法對送檢樣品進行NDV、ILTV、FAV檢測。試驗所用引物由生工生物工程(上海)股份有限公司合成。反轉錄(RT)為10 μl體系:5×M-MLV Buffer 2 μl、dNTP Mixture(10 mM)0.5 μl、Random Primers(25 μm)1 μl、RNA酶抑制劑 0.5 μl、M-MLV1 μl,RNA Template 5 μl。反應程序為:25 ℃ 10 min,42 ℃孵育60 min,95 ℃ 5 min,最后在冰上冷卻,用于后續PCR反應。PCR采用20 μl反應體系:2×Taq PCR MasterMix 10 μL,特異性上游、下游引物各1 μl,cDNA模板2 μl,補加ddH2O至20 μl。反應條件為:94 ℃ 預變性3 min;94 ℃變性30 s,52 ℃ 退火30 s,72 ℃ 延伸45 s,34個循環,循環結束后72 ℃ 延伸10 min,4 ℃保存。取PCR產物,經1 % 瓊脂糖凝膠電泳后,在紫外凝膠呈像儀下觀察結果。
1.5 測序分析 參照《雞傳染性支氣管炎診斷技術》檢測與判定標準,為進一步驗證試驗結果的準確性,將上述RT-PCR獲得的IBV擴增產物用膠回收試劑盒回收純化后送生工生物公司進行測序。將測序結果提交美國國家生物技術信息中心(NCBI)進行BLAST分析。以上述同樣方法,對RT-PCR獲得的H9亞型AIV擴增產物進行測序與分析。
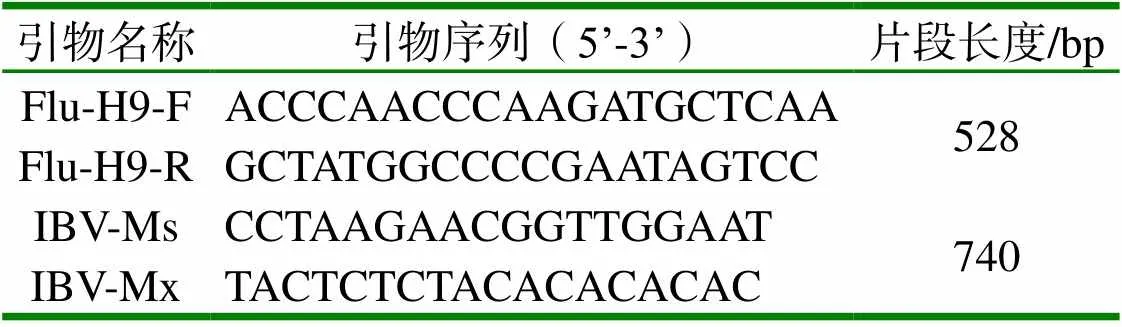
表1 PCR引物序列
2 結果與分析
2.1 剖檢病變 對病死雞進行剖檢,呼吸系統的病理變化非常明顯,主要表現為:氣管黏膜彌漫性出血,黏膜表面有較多黏液。有的病例發生支氣管栓塞,管腔中有黃色栓塞物。肺臟出血、腫脹,呈暗紅色。采集有明顯病變的肺臟、氣管樣本用于后續病原檢測。
2.2 病原檢測 病原檢測結果表明:使用H9亞型AIV特異性引物Flu-H9-F、Flu-H9-R可以擴增獲得約528bp大小的目的片段(圖1A);而使用IBV特異性引物IBV-Ms、IBV-Mx可以擴增獲得約740bp大小的目的片段(圖1B),電泳結果均與預期擴增片段大小相一致。樣本的NDV、ILTV、FAV檢測結果均為陰性。RT-PCR檢測結果初步表明:該病例存在H9亞型AIV與IBV混合感染。
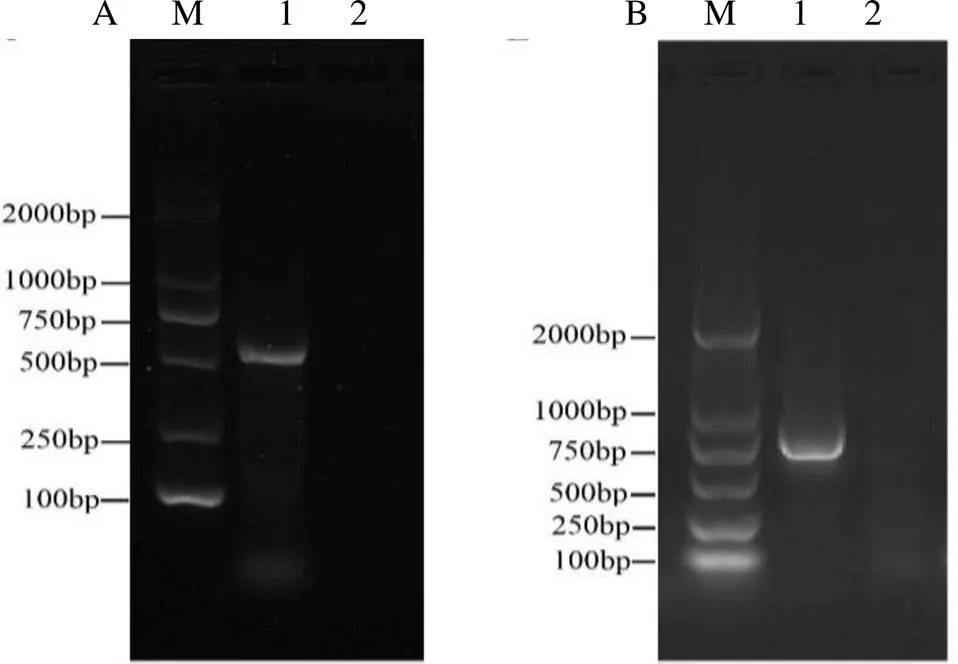
圖1 PCR鑒定結果
A. H9亞型AIV鑒定; B. IBV鑒定M:DNA分子量標準; 1-2分別為臨床樣本、陰性對照
2.3 測序分析 將RT-PCR擴增產物經切膠回收純化后,送生物公司測序。使用NCBI數據庫對測序結果進行BLAST分析,結果表明:上述H9亞型AIV PCR產物測序比對結果與A/chicken/ Jiangsu/J2177/2017(H9N2)株(登錄號MK 553996)核苷酸序列同源性最高,為99.6 %;參考株J2177屬于國內流行較為廣泛的Y280-like分支。IBV PCR產物測序比對結果與IBV YX10株(登錄號JX840411)核苷酸同源性最高,為99.8 %;IBV參考株YX10屬于QX型。測序分析結果進一步確證該病例存在H9亞型AIV與IBV混合感染。
3 討論
(1)雞的呼吸道傳染病一直是嚴重危害養禽業健康發展的重要疫病。AIV和IBV作為雞呼吸道疾病的常見病原體,在我國許多地區均有報道[4]。禽流感有多個亞型,在我國流行最為廣泛的是H9亞型AIV,在分類上屬于低致病性禽流感病毒(LPAIV)。H9亞型AIV感染雞后,常表現輕微的呼吸道癥狀,產蛋量、種蛋受精率、孵化率會受到較大影響,并且會導致免疫力降低[5]。(2)雖然單純H9亞型AIV感染死亡率一般不高,但是當與IBV等病原共感染時,會加重雛雞的臨床癥狀以及病理變化,導致較高的發病率和死亡率,造成嚴重的經濟損失[1,6]。近年來,AIV與IBV混合感染現象在國內多地均有發生:2010-2013年從山東、遼寧、吉林、黑龍江等地規模化肉雞場采集的111份H9亞型AIV陽性樣品中,有74份同時檢測到IBV陽性,混合感染率高達67 %,雞群死亡率達10 % 以上[4]。混合感染的協同致病作用,被認為是導致雞的呼吸道疾病愈加嚴重、防控更加困難的重要原因[1]。(3)目前,疫苗免疫接種是預防H9亞型AI和IB等呼吸道傳染病的重要舉措。雖然H9僅是A型流感病毒的1個亞型,但其譜系復雜,容易出現變異甚至抗原性改變,導致AIV很難得到有效控制。另外,目前眾多的H9亞型AIV疫苗也給養殖戶選用疫苗造成了諸多困惑[7]。如果選擇的疫苗毒株與現場流行毒株的抗原性不相符,免疫雞群仍可能會出現疫情。本研究中H9亞型AIV PCR產物測序比對結果與Y280-like分支的H9N2參考毒株J2177/2017株同源性最高。Y280-like分支屬于國內流行較為廣泛的H9亞型AIV,因此應選擇與流行株抗原性匹配的Y280-like分支疫苗用于防控。與H9亞型AIV相似,IBV也處于不斷變異之中。IBV血清型較多,且各血清型間交叉保護作用差異較大,這為IB防控帶來挑戰[3]。本研究中IBV PCR產物測序比對結果與QX型的毒株YX10株同源性最高。這與文獻中報道的QX型是目前山東省雞群中IBV流行的主要基因型相一致[3]。因此IB的免疫防控應選擇QX型疫苗,或者與4/91型疫苗、H120疫苗聯合使用。(4)為了有效防控AI和IB,除了有針對性的選擇與流行株基因型、抗原性相匹配的疫苗,還應注意疫苗免疫水平,制定科學合理的免疫程序。最后值的注意的是,疫苗免疫接種只是防控AI和IB流行的最后一道防線,只有結合平時飼養管理、生物安全、疫病防控等綜合措施,才能取得滿意的效果。
[1] 劉秀梵. 雞多病因呼吸道病及其防制對策[J]. 動物科學與動物醫學, 2001(2): 4-7.
[2] 李智超, 孟春春, 栗永華, 等. 基于中國知網數據的雞傳染性支氣管炎病毒混合感染分析[J]. 中國動物傳染病學報, 2018, 26(5): 73-76.
[3] 尹丹, 楊晶, 李璐瑤, 等. 7株雞傳染性支氣管炎變異流行病毒的分離鑒定[J]. 中國獸醫雜志, 2020, 56(4): 24-27, 142.
[4] 劉東, 劉紅祥, 王群義, 等. 規模化肉雞場H9N2亞型禽流感與傳染性支氣管炎流行病學調查[J]. 中國家禽, 2014, 36(6): 62-64.
[5] 刁有祥主編. 禽病學[M]. 北京: 中國農業科學技術出版社, 2008: 75-79.
[6] Seifi S, Asasi K, Mohammadi A. An experimental study on broiler chicken co-infected with the specimens containing avian influenza(H9 subtype) and infectious bronchitis(4/91 strain)viruses[J]. Iranian Journal of Veterinary Research, 2012, 13(2): 138-142.
[7] 叢彥龍, 鐘穎, 孫藝學, 等. H9N2亞型禽流感病毒流行病學及其疫苗的研究進展[J]. 中國獸醫學報, 2017, 37(2): 386-392.
山東省現代農業產業技術體系家禽創新團隊項目(SDAIT-11-17);山東省自然科學基金培養基金(ZR2019PC031);國家大學生創新創業訓練項目(201910452007)
(2021–01–30)
S858.3
B
1007-1733(2021)05-0026-03

