短時高溫好氧固態發酵對豬糞細菌群落結構的影響
張建龍,王亞妮,董樂輝,陳國忠*,姜琳琳,于馨,朱洪偉,鄭維波,劉燕
試驗研究
短時高溫好氧固態發酵對豬糞細菌群落結構的影響
張建龍1,2,3,王亞妮1,董樂輝4,陳國忠1,2,3*,姜琳琳1,2,3,于馨1,2,3,朱洪偉1,2,3,鄭維波1,2,3,劉燕1,2,3
(1.魯東大學生命科學學院,山東 煙臺 264025;2.山東省養殖環境控制工程實驗室,山東 煙臺;3.煙臺市動物病原微生物與免疫學重點實驗室,山東 煙臺;4.山東益生種畜禽股份有限公司,山東 煙臺)
為了研究畜禽糞便固態發酵前后微生物的變化,采用高通量測序技術,通過可操作分類單元分析、α多樣性分析和物種組成分析,比較了豬糞短時高溫好氧固態發酵前后的細菌群落組成,結果表明,發酵前后可操作分類單元總數分別為151個和126個,發酵后細菌群落多樣性指數降低;發酵前相對豐度最高的分別是變形菌門59.48 %、擬桿菌門23.97 % 和厚壁菌門13.79 %,發酵后變形菌門和擬桿菌門分別減少至0.66 % 和1.00 %,而厚壁菌門增加至99.01 %,是發酵豬糞的優勢菌群。本研究表明發酵后豬糞細菌群落多樣性下降,抗生素抗性基因潛在攜帶者相對豐度降低,耐高溫的有機質降解菌成為優勢菌屬,該研究對豬糞的資源化處理具有理論指導意義。
豬糞;高通量測序;細菌群落結構
集約化養殖導致畜禽糞便大量堆積,嚴重污染環境[1]。豬糞中含有大量的病原微生物,處理不當會導致對環境的二次污染[2],暴發大規模的傳染性疾病[3]。高溫好氧堆肥可防止抗生素、抗生素抗性基因和抗性細菌從糞肥釋放到農田土壤中[4],改善土壤,提高農作物產量[5]。在高溫好氧堆肥過程中微生物群落結構會發生顯著的變化[6]。據報道Kato等[7]研究發現堆肥加速了牛糞中微生物群落的演替,使微生物豐富度下降的同時保持了微生物的多樣性。Mao等[8]在研究堆肥前后豬糞中微生物的群落演替時發現厚壁菌門是嗜熱階段的絕對優勢菌門,保持良好的微生物群落結構對豬糞堆肥起到了重要的指導性作用。
高通量測序技術能夠通過從環境樣本中直接獲取總的DNA進行文庫構建,從而提高測序效率[9]。本研究采用高通量測序的手段,對短時高溫好氧固態發酵前后的豬糞進行微生物多樣性分析,闡明短時高溫好氧固態發酵前后豬糞細菌群落及物種的組成和相對豐度,進而可以確定豬糞發酵過程中的優勢菌群,并通過對比總結出豬糞發酵前后細菌群落的演替規律,對豬糞發酵制備有機肥的資源化處理技術具有理論指導意義。
1 材料與方法
1.1 材料
豬糞由養殖戶提供,發酵菌劑AT酵素由百威國際生物股份有限公司提供,花生殼粉采購自煙臺市農貿市場。
1.2 方法
1.2.1 短時高溫好氧固態發酵 將豬糞和花生殼粉按比例混拌均勻,碳氮比調節為25:1,控制含水量60 %,從不同位點隨機采樣5份,合并為1份,記為BEFE,作為發酵前樣本。將物料加入百威高速發酵設備(百威國際生物股份有限公司)內,每1 t原料添加1 kg發酵菌劑,啟動電源加熱至50 ℃,啟動攪拌每1 h轉1圈,曝氣速率為15 L/min。發酵10 h后加熱至80 ℃ 維持1 h,加熱至100 ℃ 再維持1 h,結束發酵,出料,在室外建成一個長2 m、寬1 m、高0.8 m的堆體,每天進行1~2次翻堆,腐熟6 d。當發酵結束后,在堆肥不同位點隨機采集樣品5份,合并為1份,記為AEFE,作為發酵后樣本。每個樣本采集3份,置于-80℃冰箱保存備用。
1.2.2 高通量測序 將樣品送北京諾禾致源生物信息科技有限公司進行16S rRNA高通量測序,測序引物515F/907R,序列為515F:5'-GTGCCA GCMGCCGCGG-3',907R:5'-CCGTCAATTCM TTTRAGTTT-3',測序的區域是V4-V5區,測序平臺是Illumina Miseq。
1.2.3 數據處理 對得到的測序原始數據進行篩選處獲得優化序列,然后在97 % 的相似水平上進行可操作分類單元聚類分析,用Mothur軟件計算得到豐富度指數、均勻度指數、香農指數、辛普森指數和覆蓋率,利用R語言工具分析樣本在不同分類水平上的群落結構。用SPSS統計軟件進行單因素方差分析,顯著性差異結果表示為<0.05。
2 結果
2.1 豬糞樣品的測序質量
通過引物對樣品的16S進行測定,豬糞發酵前后高通量測序總的堿基數分別為70 750和80 333,其中合并的堿基數分別為66 493和75 328,各占所測堿基總數的93.98 % 和93.77 %。從序列長度來看,所測序列長度分別在264 bp ~ 402 bp和265 bp ~ 394 bp之間,平均測序長度為372 bp和371 bp。
2.2 豬糞樣品菌群的α多樣性
2.2.1 稀釋曲線 為了判斷本樣品測序數據量是否合理,筆者對發酵前后豬糞的測序序列進行隨機抽樣,然后利用稀釋曲線進行評估。發酵后和發酵前的曲線隨著測序深度的增加最終接近平臺期趨于平穩,說明本次取樣的合理性,測序深度已經基本覆蓋樣本中的所有物種。
2.2.2 群落多樣性指數 香農指數和辛普森指數代表了微生物的多樣性。由表1可以看出發酵后細菌群落的香農指數與辛普森指數相比于發酵前降低了,表明發酵后豬糞的物種多樣性下降但是群落分布多樣性卻有微量的增長。發酵后的豐富度指數和均勻度指數明顯低于發酵前,這說明發酵后的豬糞中物種豐富度顯著降低。發酵前細菌可操作分類單元為151個,發酵后細菌可操作分類單元為126種,兩種狀態下都存在的為85種,表明發酵前后的細菌類別存在較大差異。

表1 群落多樣性指數
注:*表示差異顯著(<0.05)
2.3 細菌群落結構變化
2.3.1 在門水平的細菌群落結構 高通量測序結果表明(表2),發酵前豬糞細菌群落在門水平上的主要類群為變形菌門、擬桿菌門、厚壁菌門、放線菌門,相對豐度分別為59.48 %、23.97 %、13.79 %、2.55 %。變形菌門是其優勢菌門。發酵后厚壁菌門是優勢菌門,并且占有絕對優勢,相對豐度達到99.01 %。

表2 發酵前后細菌在門水平的相對豐度
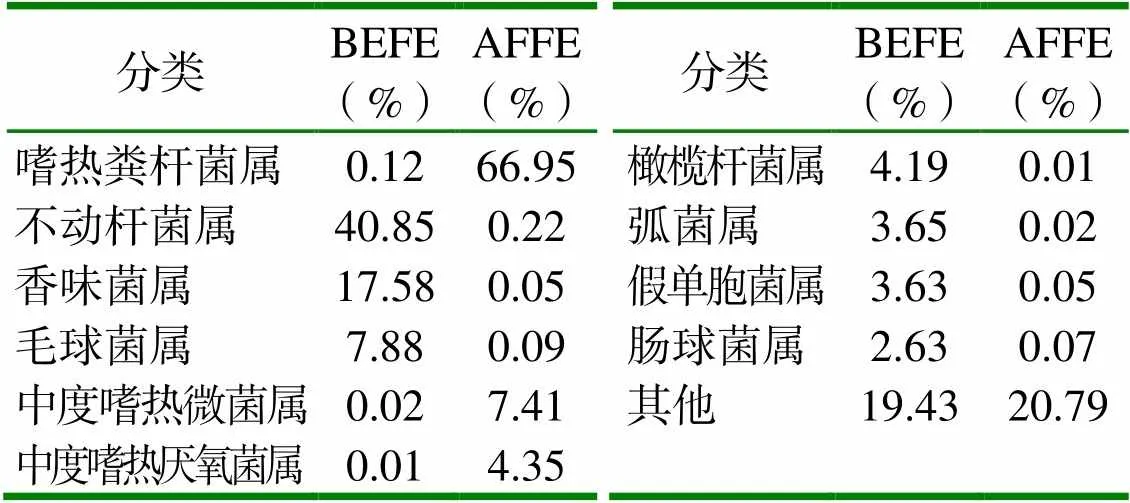
表3 發酵前后細菌在屬水平的相對豐度
2.3.2 在屬水平的細菌群落結構 由表3可見,發酵前在屬水平上相對豐度排名前7的菌屬為不動桿菌屬40.85 %、香味菌屬17.58 %、毛球菌屬7.88 %、橄欖桿菌屬4.19 %、弧菌屬3.65 %、假單胞菌屬3.63 %、腸球菌屬2.63 %。發酵后這7個屬的相對豐度值都顯著降低,尤其是優勢菌屬不動桿菌屬在發酵后相對豐度僅為0.66 %,遠低于發酵前。嗜熱糞桿菌屬、中度嗜熱微菌屬和中度嗜熱厭氧菌屬成為發酵后的優勢菌屬,占比分別達到66.95 %、7.41 % 和4.35 %。
2.3.3 細菌群落各分類單元占比差異 對發酵前后豬糞細菌群落各分類單元的分布差異進行了分析,發酵前細菌在綱、目、科、屬中的分布廣泛,發酵后則主要集中于厚壁菌門梭菌綱。發酵前豬糞中的細菌主要分布在變形菌門、擬桿菌門和厚壁菌門,發酵后則是厚壁菌門占據絕對優勢。對于厚壁菌門而言,發酵前僅有芽孢桿菌綱乳桿菌目的肉桿菌科、氣球菌科和腸球菌科。發酵后的豬糞細菌群落中有芽孢桿菌綱乳桿菌目的肉桿菌科、腸球菌科、乳酸細菌科和芽孢桿菌目,以及梭菌綱的梭菌目和鹽厭氧菌目。
3 討論
(1)采用高通量測序技術研究了短時高溫好氧固態發酵對豬糞細菌多樣性的影響。樣品的稀釋曲線末端趨于平坦說明樣本的測序數據量是足夠的。發酵后豬糞中細菌的多樣性下降,其原因在于短時高溫好氧發酵的溫度高于50 ℃ 甚至達到80~100 ℃,在此階段大多數微生物因為耐熱性較差而失活[10],嗜熱細菌生存下來成為優勢菌群[8]。(2)通過種群結構分析,豬糞發酵前后細菌群落變化顯著,發酵前厚壁菌門、變形菌門、放線菌門和擬桿菌門是堆肥微生物區系中占主導地位的門類,發酵后厚壁菌門成為了豐度最高的優勢菌門且占比超過99 %,該結果與王旭輝等[11]報道的牛糞堆肥過程中微生物的變化是一致的。動物糞便是人畜共患病原體的主要來源,其中的變形菌門是細菌中最大的門,含有大量的病原性菌種。發酵前變形菌門是豬糞細菌群落的優勢菌門,符合畜禽腸道微生物菌落的一般規律。大多數病原菌在50 ℃ 以上24 h內就會被滅活,因此豬糞中的病原菌經過高溫發酵后絕大部分被殺死,原來占優勢的變形菌門在發酵后僅占細菌總數0.66 %。變形菌門中很多菌種是抗生素抗性基因的攜帶者,變形菌門豐度降低和抗生素抗性基因的消除具有一定的相關性[12-13]。發酵后厚壁菌門成為豬糞中的絕對優勢菌群,其原因是多方面的。首先,厚壁菌門細胞壁的肽聚糖含量約在50 % ~ 80 %之間,細胞壁較厚具有較強的耐熱性;其次,發酵菌劑大多為厚壁菌門菌種,其本身就是優勢菌群;最后,厚壁菌門能利用現成可發酵的碳水化合物并參與纖維素外圍側鏈的初始定植[14],同時分泌多種果膠酶來完成降解纖維素等難消化的碳水化合物的目的,發酵過程中加入的輔料是含有大量木質素和纖維素為主要成分的花生殼,對厚壁菌門具有促生作用。此外,豬糞中氮源含量高,而厚壁菌門具有能夠利用氮源和促進氨基酸運輸代謝的能力[15],這也是厚壁菌門成為優勢菌群的主要原因之一。(3)從屬水平分析可知,發酵前不動桿菌屬、香味菌屬、毛球菌屬、橄欖桿菌屬、弧菌屬、假單胞菌屬、腸球菌屬7個相對豐度較高的菌屬在發酵后都顯著降低,嗜熱糞桿菌屬、中度嗜熱微菌屬和中度嗜熱厭氧菌屬成為發酵后的優勢菌屬。已有報道表明畜禽糞便中磺酰胺類抗生素抗性基因的相對豐度較高[16],而不動桿菌屬和假單胞菌屬被認為是主要載體[17],這兩個菌屬在發酵后豐度降低有利于抗生素抗性基因的消減,即有利于畜禽糞便的無害化。嗜熱糞桿菌屬、中度嗜熱微菌屬和中度嗜熱厭氧菌屬在纖維素和有機物的降解中起主導作用[18-21],都屬于嗜熱菌,這可能是這三類菌高溫發酵后在豬糞的微生物菌落中成為優勢菌種的主要原因。(4)本研究對采用短時高溫好氧固態發酵前后的豬糞樣本進行了高通量測序,通過可操作分類單元分析、α多樣性分析和物種組成分析發現:發酵后豬糞細菌群落物種多樣性下降,變形菌門、擬桿菌門相對豐度降低,厚壁菌門相對豐度增加成為優勢菌門,抗生素抗性基因攜帶者不動桿菌屬和假單胞菌屬相對豐度降低,耐高溫的有機質降解菌嗜熱糞桿菌屬、中度嗜熱微菌屬和中度嗜熱厭氧菌屬成為優勢菌屬。發酵前后豬糞細菌群落結構的變化主要與發酵溫度、輔料和發酵菌劑特性有關,短時高溫好氧固態發酵能夠有利于豬糞無害化處理。
[1]金香琴, 段麗杰, 馬繼力, 等. 不同微生物菌劑對畜禽糞便資源化堆肥效果的影響[J]. 科學技術與工程, 2015, 15(7): 280-283.
[2] Niu Q, Hojo T, Qiao W, et al. Characterization of methanogenesis, acidogenesis and hydrolysis in thermophilic methane fermentation of chicken manure[J]. Chemical Engineering Journal, 2014, 244: 587-596.
[3] Erickson M C, Liao J, Ma L, et al. Inactivation of Salmonella spp. in cow manure composts formulated to different initial C:N ratios[J]. Bioresource Technology, 2009, 100(23): 5898-5903.
[4] Lin H, Zhang J, Chen H, et al. Effect of temperature on sulfonamide antibiotics degradation, and on antibiotic resistance determinants and hosts in animal manures[J]. Science of The Total Environment, 2017, 607-608: 725-732.
[5] Huang G F, Wong J W C, Wu Q T, et al. Effect of C/N on composting of pig manure with sawdust[J]. Waste Management, 2004, 24(8): 805-813.
[6] Huang G, Wang X, Han L. Rapid estimation of nutrients in chicken manure during plant-field composting using physicochemical properties[J]. Bioresource Technology, 2011, 102(2): 1455-1461.
[7] Kato K, Miura N. Effect of matured compost as a bulking and inoculating agent on the microbial community and maturity of cattle manure compost[J]. Bioresource Technology, 2008, 99(9): 3372-3380.
[8] Mao H, Lv Z, Sun H, et al. Improvement of biochar and bacterial powder addition on gaseous emission and bacterial community in pig manure compost[J]. Bioresource Technology, 2018, 258: 195-202.
[9] 秦楠, 栗東芳, 楊瑞馥. 高通量測序技術及其在微生物學研究中的應用[J]. 微生物學報, 2011, 51(4): 445-457.
[10] Reuveni R, Raviv M, Krasnovsky A, et al. Compost induces protection against Fusariumoxysporum in sweet basil[J]. Crop Protection, 2002, 21(7): 583-587.
[11] 王旭輝, 徐鑫, 寶哲, 等. 高通量測序分析玉米秸稈與牛糞聯合發酵階段微生物多樣性變化[J]. 食品與發酵工業, 2019, 45(3): 47-55.
[12] Cui E, Wu Y, Zuo Y, et al. Effect of different biochars on antibiotic resistance genes and bacterial community during chicken manure composting[J]. Bioresource Technology, 2016, 203: 11-17.
[13] Zhang J, Lin H, Ma J, et al. Compost-bulking agents reduce the reservoir of antibiotics and antibiotic resistance genes in manures by modifying bacterial microbiota[J]. Science of The Total Environment, 2019, 649: 396-404.
[14] Pitta D W, Parmar N, Patel A K, et al. Bacterial diversity dynamics associated with different diets and different primer pairs in the rumen of kankrej cattle[J]. PLOS ONE, 2014, 9(11): e111710.
[15] Zhang L, Li L, Pan X, et al. Enhanced growth and activities of the dominant functional microbiota of chicken manure composts in the presence of maize straw[J]. Frontiers in Microbiology, 2018, 9:1131.
[16] Urra J, Alkorta I, Lanzén A, et al. The application of fresh and composted horse and chicken manure affects soil quality, microbial composition and antibiotic resistance[J]. Applied Soil Ecology, 2019, 135: 73-84.
[17] Yang C W, Hsiao W C, Chang B V. Biodegradation of sulfonamide antibiotics in sludge[J]. Chemosphere, 2016, 150: 559-565.
[18] Awasthi M K, Chen H, Wang Q, et al. Succession of bacteria diversity in the poultry manure composted mixed with clay: Studies upon its dynamics and associations with physicochemical and gaseous parameters[J]. Bioresource Technology, 2018, 267: 618-625.
[19] Sekiguchi Y, Imachi H, Susilorukmi A, et al. Tepidanaerobactersyntrophicus gen. nov., sp. nov., an anaerobic, moderately thermophilic, syntrophic alcohol- and lactate-degrading bacterium isolated from thermophilic digested sludges[J]. 2006, 56(7): 1621-1629.
[20] Slobodkin A I, Tourova T P, Kostrikina N A, et al. Tepidimicrobium ferriphilum gen. nov., sp. nov., a novel moderately thermophilic, Fe(III)-reducing bacterium of the order Clostridiales[J]. 2006, 56(2): 369-372.
[21] Yokoyama H, Wagner I D, Wiegel J.Caldicoprobacter oshimai gen. nov., sp. nov., an anaerobic, xylanolytic, extremely thermophilic bacterium isolated from sheep faeces, and proposal of Caldicoprobacteraceae fam. nov[J]. 2010, 60(1): 67-71.
山東省現代農業產業體系(SDAIT-13-011-10);山東省重大科技創新工程(2017GGH5129);山東省農業重大應用技術創新項目;煙臺市重點研發計劃(2021YT06000636)
(2021–02–08)
S852.6
A
1007-1733(2021)05-0001-04

