一株貉源犬細小病毒CPV-CL01株的分離鑒定
許玲涵,葛平萍,王金亮,王殿永,張洪學,李金波,李富金*
一株貉源犬細小病毒CPV-CL01株的分離鑒定
許玲涵1,葛平萍2,王金亮3,王殿永1,張洪學2,李金波2,李富金2*
(1.河北省昌黎縣動物疫病預防控制中心,河北 昌黎 066600;2.齊魯動物保健品有限公司技術服務部,山東 濟南;3.山東省臨沂市畜牧發展促進中心,山東 臨沂)
為了探究河北某貉養殖場引起貉腸炎的病原,以便采取針對性防控措施,解決當前貉腸炎發病率高、死亡率高的問題。本研究對采集的病料進行了常規處理,離心取上清液,采用血凝試驗、細胞接種、傳代培養、分離毒PCR鑒定、序列分析、動物回歸等方法進行試驗研究,結果表明,貉腸炎病料上清液有血凝性,血凝值為l:128,接種貓腎細胞(F81細胞),盲傳3代,F81細胞出現典型的細胞病變,經鑒定分離的病毒為細小病毒,基因比對為犬細小病毒(CPV-CL01株)。貉回歸試驗可復制出病毒性腸炎典型臨床病癥及病變,是一強毒株。
貉;細小病毒;分離;鑒定
貉細小病毒性腸炎是由細小病毒引起貉的一種急性、烈性、高度接觸性病毒性傳染病,以病貉嘔吐、劇烈腹瀉、高發病率和死亡率為主要特征,是危害貉業養殖與發展的重要傳染病之一。貉細小病毒性腸炎常由犬細小病毒、水貂細小病毒或者狐貍細小病毒引起,最常見為犬細小病毒[1-3]。最初的犬細小病毒為CPV-2,隨著VP2蛋白上的關鍵氨基酸位點不斷發生變化,新的突變株CPV-2a,CPV-2b,CPV-2c逐步出現,代替了原來的CPV-2型,宿主范圍也在不斷擴大[4]。近幾年,吉林、黑龍江等地均有貉細小病毒分離的報道,分型大部分屬于犬細小病毒CPV-2型[5-8]。筆者從送檢的疑似貉病毒性腸炎的貉小腸內容物中分離出一株細小病毒,經鑒定分離株屬于犬細小病毒CPV-2型,命名為CPV-CL01株,現將結果報告如下。
1 材料和方法
1.1 材料
1.1.1 病料 河北省秦皇島市昌黎縣某貉養殖場送檢的疑似貉病毒性腸炎的病貉,糞便經抗原快速檢測試紙(韓國金諾)檢測為陽性,采集該貉小腸及內容物,置-15℃ 以下保存備用。
1.1.2 培養細胞 貓腎傳代細胞F81,由齊魯動物保健品有限公司研究所自備。
1.1.3 PCR引物 根據GenBank公布的犬細小病毒序列,針對細小病毒VP2基因設計一對引物,具體序列如下:P1:5’-ATGAGTGATGGAG CAGTTCAACCAGACGGTGGTCAAC-3’P2:5’-TTAATATAATTTTCTAGGTGCTAGTTGAGATTTTTCA-3’,由齊魯動物保健品有限公司研究所自備。
1.1.4 試驗動物 購自德州某養貉場60日齡左右健康仔貉,血凝抑制抗體效價(HI)≤1:4。
1.2 方法
1.2.1 病料處理 取病貉的小腸及內容物剪碎,加生理鹽水制成l:10的乳劑,混勻研磨,12 000 r/min離心20 min,取上清,經0.45 μm微孔濾膜過濾,再經0.22 μm微孔濾膜過濾后,置于-15℃ 以下凍存備用。
1.2.2 血凝(HA)效價測定 采用微量血凝試驗,用1 % 豬紅細胞懸液測定病料上清液、細胞培養物的血凝特性,以50 % 以上紅細胞出現凝集判定為陽性。
1.2.3 病毒分離 將F81細胞按照常規方法消化,按照1/10體積同步接種待分離樣品,37 ℃培養24 h后,更換成維持液于37 ℃繼續培養,并逐日觀察細胞病變;如無細胞病變,細胞培養4~5 d收獲,并連續傳代培養,至第4代仍無病變可認定為陰性。出現細胞病變培養物于-20℃,凍融3次后冷凍保存備用。
1.2.4 聚合酶鏈式反應(PCR) 用DNA提取試劑盒提取病毒液DNA模板,進行PCR鑒定,擴增程序為:95 ℃ 5 min;95 ℃ 5 min,55 ℃ 45秒,72 ℃ 2 min,共30個循環;72 ℃ 10 min。將PCR產物連同引物送往上海生物工程有限公司進行測序。
1.2.5 貉回歸試驗 選擇HI抗體≤l:4的健康貉6只,分為兩組,第一組4只,經食道灌服分離病毒,15 ml/只,另2只經食道灌服正常細胞培養物,作為對照,分別隔離觀察飼養10 d,每天觀察臨床癥狀,并于攻毒第3天開始收集攻毒貉糞便,試驗第10天撲殺全部貉進行病理剖檢。
2 結果
2.1 紅細胞血凝試驗結果
用0.5 % 豬紅細胞測定病料上清液的血凝特性,結果發生凝集反應,HA滴度為l:128。
2.2 病毒分離結果
采用同步接毒方法將處理的病料上清液接種F81細胞,盲傳至第3代,F81細胞出現拉網、破碎的典型細小病毒感染細胞病變(圖1-A),收獲病毒液,-15℃以下保存備用。
2.3 分離毒PCR鑒定結果及序列比對
分離毒株用PCR方法進行鑒定,結果1 700 bp處出現目的條帶(圖2),將PCR產物送上海生工進行序列測定,將測序結果與NCBI上的貉細小病毒(RDPV)、貓細小病毒(FPV)、犬細小病毒(CPV)、水貂腸炎病毒(MEV)毒株序列使用MegAign軟件進行比對,結果分離毒株與貉細小病毒及犬細小病毒處于同一分支,核苷酸同源性為99.3 % ~ 99.4 %(圖3、圖4),通過對分離毒株與貉細小病毒及犬細小病毒氨基酸位點分析,除了101位和297位氨基酸位點與CPV-2有差異,其它氨基酸位點與CPV-2一致(表1),因此,分離毒株可以確定為CPV-2型,將分離毒株命名為CPV-CL01株。
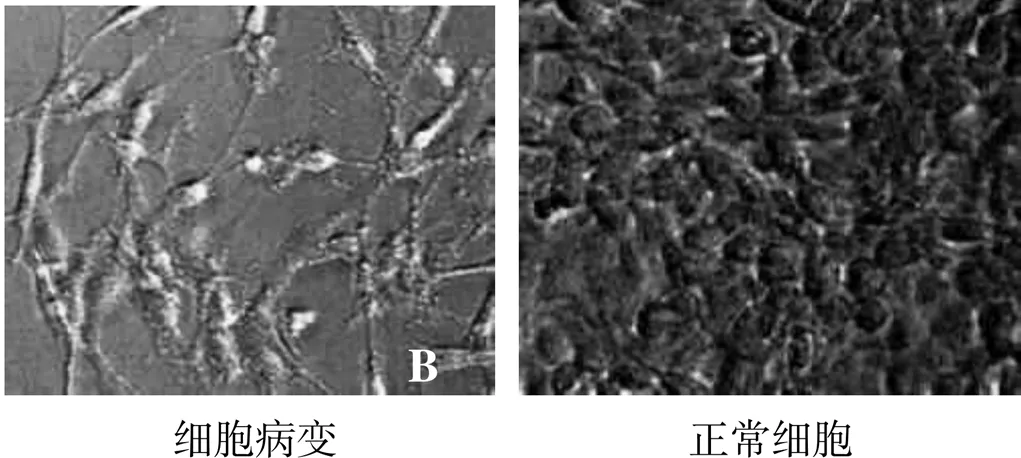
圖1 病毒接種F81細胞病變情況
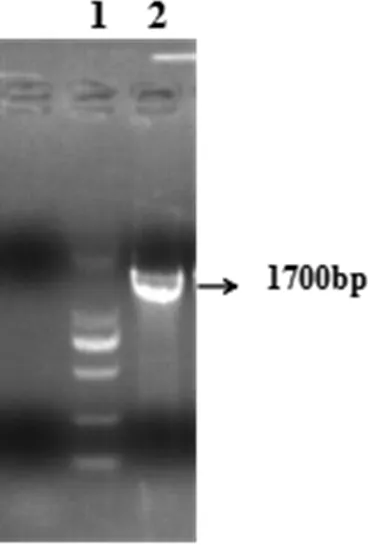
圖2 分離病毒液PCR鑒定結果
1:DL2000marker;2:分離病毒液
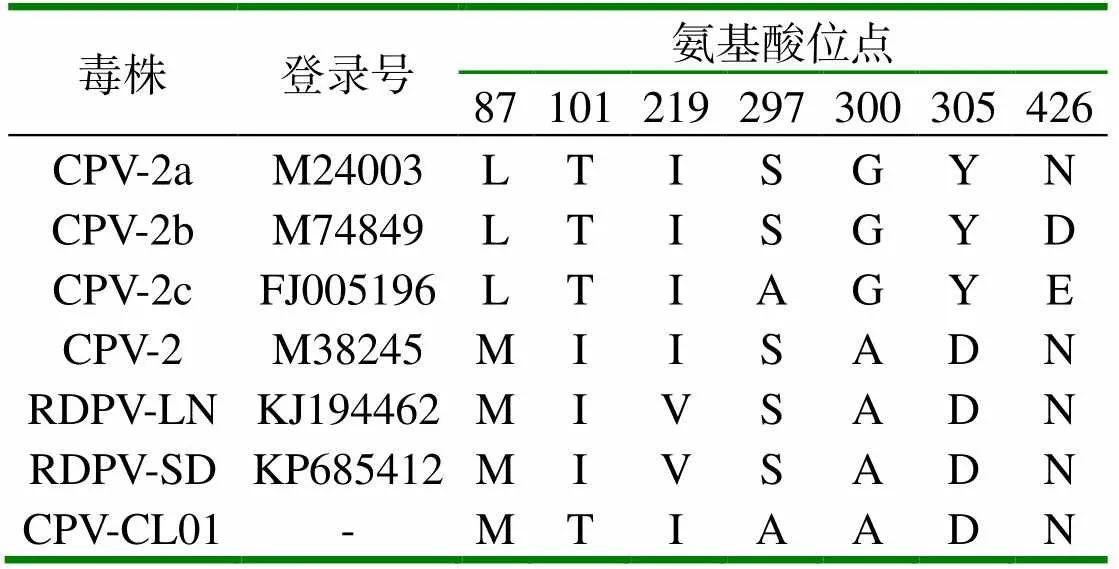
表1 分離毒株關鍵氨基酸位點分析

圖3 分離株基因進化樹分析(框內為分離毒株)
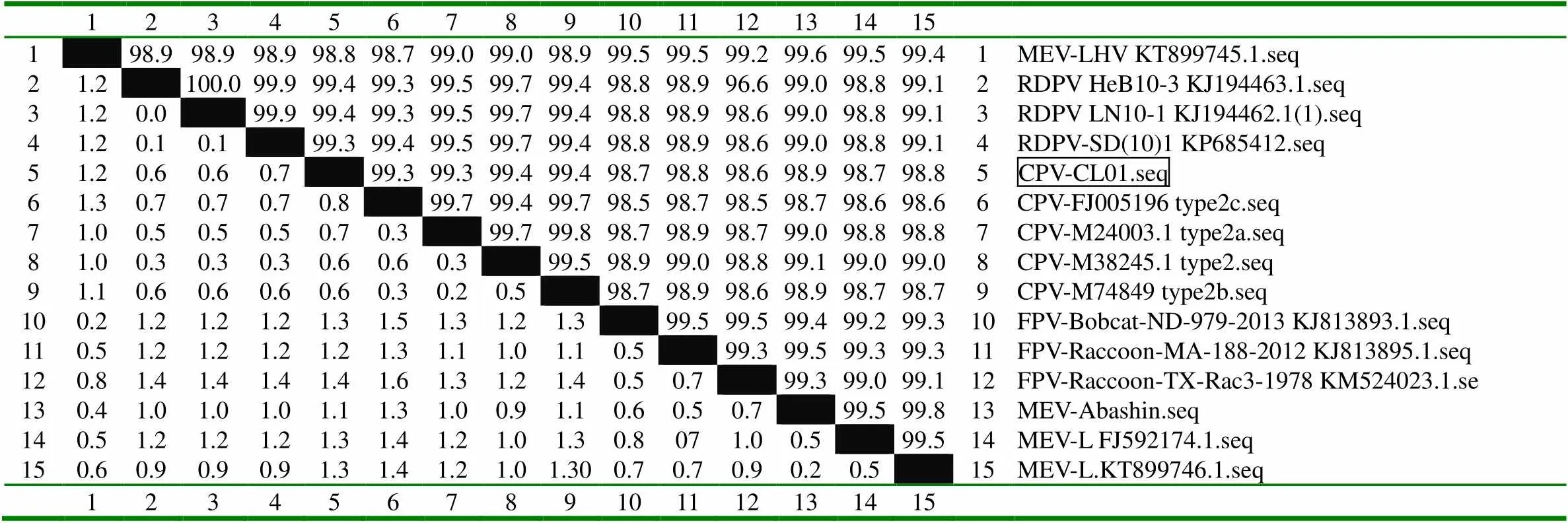
123456789101112131415 1 98.998.998.998.898.799.099.098.999.599.599.299.699.599.41MEV-LHV KT899745.1.seq 21.2 100.099.999.499.399.599.799.498.898.996.699.098.899.12RDPV HeB10-3 KJ194463.1.seq 31.20.0 99.999.499.399.599.799.498.898.998.699.098.899.13RDPV LN10-1 KJ194462.1(1).seq 41.20.10.1 99.399.499.599.799.498.898.998.699.098.899.14RDPV-SD(10)1 KP685412.seq 51.20.60.60.7 99.399.399.499.498.798.898.698.998.798.85CPV-CL01.seq 61.30.70.70.70.8 99.799.499.798.598.798.598.798.698.66CPV-FJ005196 type2c.seq 71.00.50.50.50.70.3 99.799.898.798.998.799.098.898.87CPV-M24003.1 type2a.seq 81.00.30.30.30.60.60.3 99.598.999.098.899.199.099.08CPV-M38245.1 type2.seq 91.10.60.60.60.60.30.20.5 98.798.998.698.998.798.79CPV-M74849 type2b.seq 100.21.21.21.21.31.51.31.21.3 99.599.599.499.299.310FPV-Bobcat-ND-979-2013 KJ813893.1.seq 110.51.21.21.21.21.31.11.01.10.5 99.399.599.399.311FPV-Raccoon-MA-188-2012 KJ813895.1.seq 120.81.41.41.41.41.61.31.21.40.50.7 99.399.099.112FPV-Raccoon-TX-Rac3-1978 KM524023.1.se 130.41.01.01.01.11.31.00.91.10.60.50.7 99.599.813MEV-Abashin.seq 140.51.21.21.21.31.41.21.01.30.8071.00.5 99.514MEV-L FJ592174.1.seq 150.60.90.90.91.31.41.21.01.300.70.70.90.20.5 15MEV-L.KT899746.1.seq 123456789101112131415
2.4 貉回歸試驗結果
接種的4只貉經3~5 d潛伏期后,均出現厭食、嘔吐,初期排稀便,之后出現混有脫落腸黏膜的稀便和血便,體溫升高40 ℃左右。剖檢見貉尸體脫水、消瘦,胃、腸道充血,腸黏膜條狀出血,腸系膜淋巴結水腫。攻毒5日后測定試驗貉糞便,其HA滴度均在1:512以上。
3 討論
(1)從疑似病毒性腸炎貉的腸內容物中用F81細胞分離出一株細小病毒,分離毒可以很好凝集1 % 豬紅細胞,PCR鑒定及序列分析表明分離的病毒為犬細小病毒。動物回歸試驗可以看出,分離的病毒為強毒株,可導致無母源抗體健康幼貉感染并出現典型腸炎癥狀及病理變化。(2)通過對分離毒株進行核苷酸序列分析,發現分離株與犬細小病毒核苷酸同源性為為99.3 % ~99.4 %,為了進一步確定分離的細小病毒分型,對分離毒株氨基酸位點進行分析,除了101位和297位與CPV-2C一致,其它氨基酸位點均與CPV-2一致,因此確定該分離株為犬細小病毒CPV-2型,但不排除以后會向CPV-2C型變異。(3)引起貉病毒性腸炎的細小病毒比較多,病原致病性也不同,水貂細小病毒及狐貍細小病毒對貉致病性不強,危害不嚴重,近幾年發生的貉細小病毒性腸炎對幼貉致病性比較強,發病率及致死率均比較高,與以往不同,因此有人懷疑出現了變異毒株,經實驗室驗證,是犬細小病毒感染了貉,引起區域流行。(4)由于缺乏特效的治療方法,目前對于貉細小病毒性腸炎的免疫預防主要靠免疫水貂細小病毒性腸炎滅活疫苗,臨床上采取45 d左右早免疫及間隔14~21 d進行二次加強免疫的方案,可起到很好免疫保護作用。(5)分離毒為流行強毒株,可為當前貉病毒性腸炎的臨床防控提供素材,還可用于貉病毒性腸炎疫苗研發及現有疫苗應用效果的評價。
[1] 劉吉山, 姚春陽, 李富金. 毛皮動物疾病防治實用技術[M]. 北京: 中國科學技術出版社, 2017(6): 80-86.
[2] 李文利. 貉高效養殖關鍵技術[M]. 北京: 中國農業出版社, 2018(12): 140-142.
[3] 寧宜寶. 獸用疫苗學[M]. 2版. 北京: 中國農業出版社, 2019(10): 444-447.
[4] 趙建軍, 閆喜軍, 吳威. 犬細小病毒: 從起源到進化[J]. 微生物學報, 2011,51(7): 869-875.
[5] 齊宇, 蔣依倩, 扈榮良, 等. 貉細小病毒SD1607株的分離鑒定及VP2基因序列分析[J]. 中獸醫雜志, 2018, 54(1): 25-30.
[6] 康洪濤, 趙建軍, 柴秀麗, 等. 貉細小病毒LNl0-1株分離鑒定及其免疫原性研究[J]. 畜牧獸醫學報, 2012, 43(6): 956-964.
[7] 同喜軍, 張蕾, 柴秀麗. 我國狐、貉體內發現2型犬細小病毒[J]. 特產研究, 2010, 32(1): 79.
[8] 丁尚紅, 趙桂炎, 趙旭, 等. 貉細小病毒研究概述[J]. 吉林畜牧獸醫, 2018(3): 51-53.
山東省特種經濟動物產業技術體系創新團隊項目(SDAIT-21-17)
(2021–01–22)
S852.65+9.2
A
1007-1733(2021)05-0008-03

