啤酒花及其活性成分黃腐酚抗糖皮質激素性骨質疏松的作用研究
夏天爽,丁盧穎,張嘉寶,李曉瑾,王果平,辛海量 (1. 海軍軍醫大學:a. 藥學院生藥學教研室, b. 長海醫院藥材科,上海 00433; . 新疆維吾爾自治區中藥民族研究所,新疆 烏魯木齊 83000)
糖皮質激素(glucocorticoid, GC)是一種在臨床上廣泛應用于治療類風濕性關節炎、胃腸道疾病及自身免疫疾病的藥物[1]。然而,研究顯示,有超過50%的患者在長期接受GC 的治療過程中會發生骨質疏松癥[2]。目前,糖皮質激素誘導的骨質疏松(glucocorticoid-induced osteoporosis, GIOP)已成為病理性骨丟失的第三大常見病癥,僅次于老年性骨質疏松癥和絕經后骨質疏松癥。與此同時,GIOP由于其高致殘率和高發病率給社會和家庭生活造成了極大的負擔,因此,如何預防和治療GIOP 成為醫學上關注的熱點。
啤酒花(Humulus lupulusL.)為桑科葎草屬多年生草質蔓生藤本植物,其雌性帶花果穗不僅是釀造啤酒的添加原料,也是全球廣泛應用的藥物品種,并在歐洲廣泛用于緩解更年期潮熱及絕經后骨質疏松癥[3]。黃腐酚(xanthohumol, XN)為啤酒花中的代表性成分,具有抗氧化、抗腫瘤、抗菌等活性[4]。課題組前期研究發現,啤酒花提取物及黃腐酚可顯著改善去卵巢小鼠的骨丟失,防治絕經后骨質疏松癥。此外,兩者還可顯著調節成骨細胞與破骨細胞的活性,維持骨穩態[5-6]。然而,目前對于啤酒花及黃腐酚抗GIOP 的作用機制尚不明確。故筆者擬以地塞米松(DEX)誘導的骨質疏松小鼠及其損傷的成骨細胞為模型,采用Micro-CT 及體外活性檢測等方法,對啤酒花及黃腐酚抗GIOP 的作用進行探究。
1 材料與方法
1.1 藥材及試劑
啤酒花(PJH-01),產地新疆,購自河北安國中藥材市場,經海軍軍醫大學藥學院生藥學教研室辛海量副教授鑒定,密封存放于干燥陰涼處。稱取啤酒花藥材粉末70 g,加入料液比為1∶15 的75%乙醇,回流提取3 次,減壓濃縮干燥成浸膏,HPLC測定得浸膏中黃腐酚含量為0.55%[5]。使用前配制成相應濃度的提取液。
其他試劑及購買廠家:黃腐酚(純度≥98%,上海歷鼎);地塞米松(大連美侖);阿侖膦酸鈉(上海國藥);I 型膠原C 端肽(CTX-I)及骨鈣素(BGP)Elisa 試劑盒(南京建成);堿性磷酸酶(ALP)及抗酒石酸酸性磷酸酶(TRAP)試劑盒(南京建成);胎牛血清(Gibco,美國);α-MEM 培養基等細胞培養試劑(天津灝洋);骨形成蛋白2(BMP-2)及成骨特異性轉錄因子(Runx-2)抗體(Abcam,英國);Micro-CT(eXplore Locus SP,GE,美國)。
1.2 實驗動物
1.2.1 整體動物模型
3 月齡ICR 小鼠,體重(20 ± 2)g,購自上海斯萊克實驗動物有限公司[實驗動物質量合格證號:2013001831722;實驗動物使用許可證號:SYXK(滬)2017-0004]。小鼠飼養于海軍軍醫大學藥學院實驗動物中心清潔級動物房,室溫(24 ± 0.5)℃,每日12 h 光照/12 h 黑暗,自由飲食飲水,適應1 周后開始動物實驗。
1.2.2 成骨細胞
取自新生24 h Wistar 大鼠(上海斯萊克實驗動物有限公司)。所有動物實驗均符合實驗動物倫理學要求。
1.3 動物實驗方案及樣品收集
將56 只大鼠按體重以隨機區組設計分為7 組(n=8):空白對照組(CON),DEX 模型組(MOD,2.5 mg/kg),阿侖膦酸鈉陽性對照組(ALN, 1 mg/kg),啤酒花提取物低劑量組(HLE-L, 1 g/kg),啤酒花提取物高劑量組(HLE-H, 3 g/kg),黃腐酚低劑量組(XN-L, 30 mg/kg),黃腐酚高劑量組(XN-H, 90 mg/kg)。除空白組外,所有組別小鼠腹腔注射DEX 注射液,空白對照組小鼠注射同體積的生理鹽水,每周3 次;與此同時,予相應藥物灌胃,空白對照組和模型組小鼠灌胃相同體積生理鹽水。每周灌胃給藥6 次,連續給藥12 周。每周稱量體重,按體重0.1 ml/10 g 調整給藥體積。末次給藥后,小鼠禁食、不禁水過夜,摘除眼球取血,靜置離心取血清,儲存于-80 ℃冰箱中用于生化指標檢測,剝離小鼠后肢右側股骨用于Mirco-CT 測定。
1.4 Micro-CT 檢測
取組織固定液中的小鼠右側股骨,剔除其表面附著的結締組織,用高分辨率Micro-CT 對股骨遠端進行掃描。計算骨密度(BMD)、骨表面積/骨體積(BS/BV)、相對骨體積(BV/TV)、骨小梁數目(Tb.N.)及骨小梁分離度(Tb.Sp.)。
1.5 血清生化指標檢測
按照試劑盒說明書步驟,對小鼠血清中ALP、TRAP 及CTX-I 水平進行檢測。
1.6 原代成骨細胞分離培養
采用二次消化法從新生大鼠顱蓋骨分離得到原代成骨細胞[7],用含10%胎牛血清的α-MEM 培養液進行培養,取3~4 代成骨細胞進行增殖、分化以及Western blot 分析。
1.7 成骨細胞增殖及堿性磷酸酶檢測
取3~4 代成骨細胞計算其數目,配制成細胞濃度為1×104個/ml 細胞懸液接種于96 孔板。24 h后分別更換為含藥培養液(DEX: 10 μmol/L;HLE:100、20 μg/ml;XN: 5、1 μmol/L),除空白組外均給予DEX 損傷。給藥48 h 后采用MTT 法檢測成骨細胞的增殖情況。
取3~4 代成骨細胞計算其數目,配制成細胞濃度為5×104個/ml 細胞懸液接種于24 孔板。24 h后分別更換為含藥培養液(給藥濃度同上)。培養過程中每3 d 更換1 次含藥培養液。第8 天裂解細胞,收集細胞裂解液,于4 ℃、13 800×g離心5 min。用對硝基苯磷酸二鈉法測定細胞 ALP 活性[8]。
1.8 成骨細胞骨形成相關蛋白檢測
將3~4 代的成骨細胞裂解,提取細胞總蛋白,根據BCA 試劑盒進行蛋白定量。采用ELISA 試劑盒對成骨細胞BGP 含量進行檢測,采用Western blot 技術[9]對BMP-2 及Runx-2 水平進行檢測。
1.9 統計學分析
2 結果
2.1 啤酒花及黃腐酚顯著改善DEX 小鼠骨組織形態并減緩骨丟失
模型組小鼠股骨的骨組織形態與空白組相比,出現明顯空洞,見圖1;藥物治療后,HLE 及XN 顯著改善DEX 小鼠的骨組織形態及骨微結構,防止骨質空洞。
模型組小鼠BMD、BS/TV、BV/TV 及Tb.N.水平較空白組顯著降低,Tb.Sp.水平顯著升高(圖2)。藥物治療后,HLE 及XN 顯著逆轉了DEX 小鼠BMD 及骨小梁參數的異常,防治骨質疏松。
2.2 啤酒花及黃腐酚顯著改善DEX 小鼠血清骨生化指標異常
小鼠注射DEX 后,其血清ALP 水平顯著降低,TRAP 及CTX-I 水平顯著升高。藥物治療后,HLE 及XN 可顯著提高小鼠血清ALP 水平,并降低TRAP 及CTX-I 的高表達,調節骨代謝,且藥物高劑量組治療效果更佳(圖3)。
2.3 啤酒花及黃腐酚顯著提高DEX 損傷成骨細胞的活性并促進骨形成
如圖4A-B 所示,DEX 損傷成骨細胞后,其增殖能力及ALP 活性顯著降低。藥物治療后,HLE 及XN 可顯著促進DEX 損傷成骨細胞的增殖,提高ALP 活性,促進成骨細胞的分化。
在骨形成相關蛋白的表達方面,HLE 及XN 可顯著促進DEX 損傷成骨細胞中BGP 及BMP-2 的表達,XN 還可顯著促進成骨細胞Runx-2 的表達(圖4C-E),促進成骨細胞骨形成。
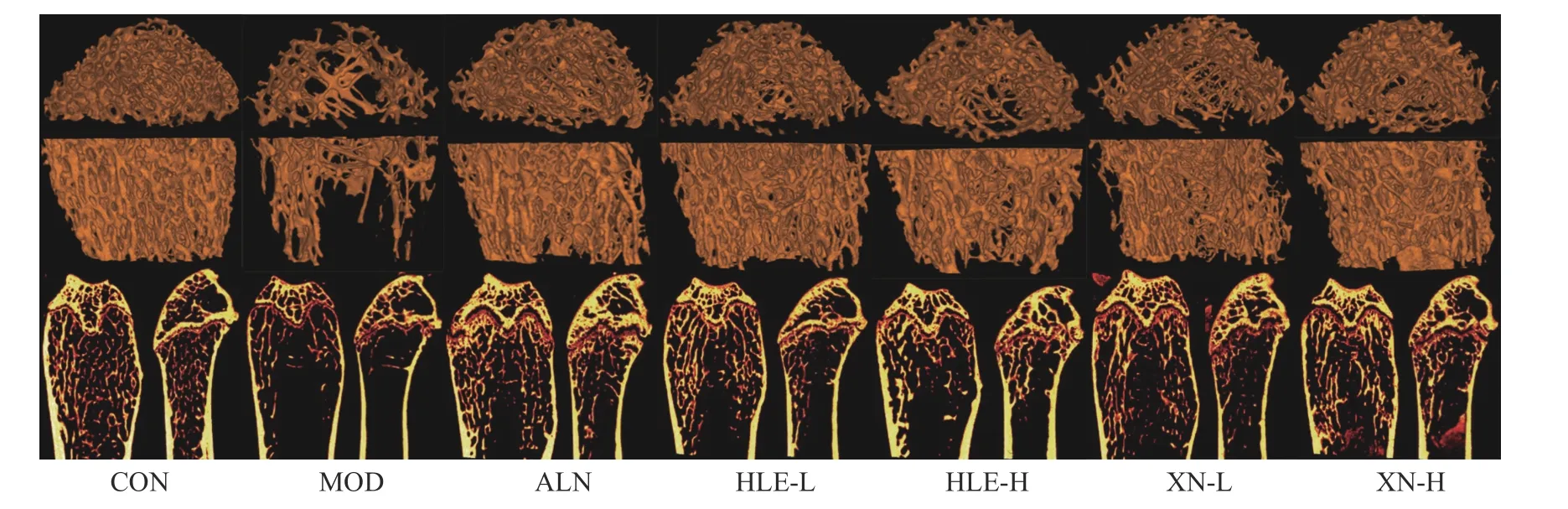
圖1 小鼠股骨Micro-CT 掃描圖
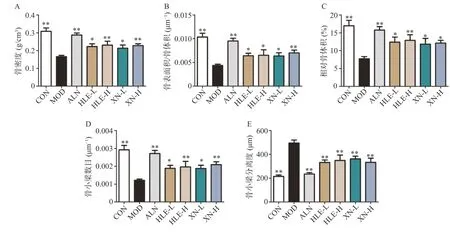
圖2 小鼠股骨骨密度(A)及骨小梁參數(B-E)(n =8,±s)
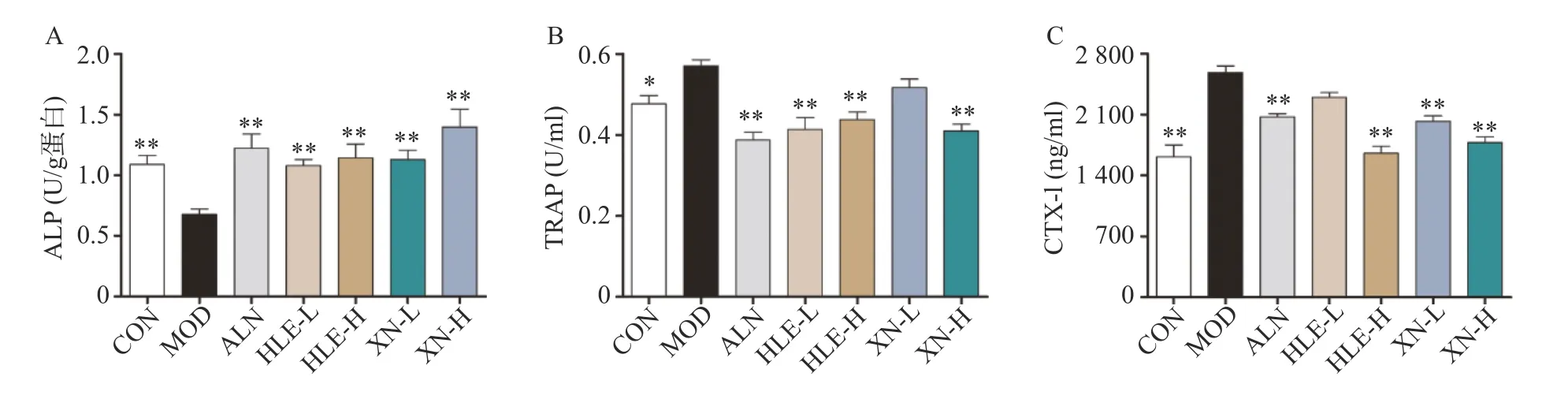
圖3 小鼠血清生化指標(n =8,±s)

圖4 成骨細胞的增殖(A)、分化(B)水平及骨形成相關蛋白(C-E)的表達(n =4,±s)
3 討論
DEX 作為臨床上常用的一種合成糖皮質激素,在抗炎抗免疫反應方面均具有良好的療效。與其他糖皮質激素類似,長期使用DEX 會引起嚴重的不良反應,尤其是對骨骼的影響,可大大增加骨質疏松及生理性骨折的發病風險[10]。本研究中,小鼠注射DEX 后,其股骨的骨微結構顯著破壞,骨質明顯空洞,骨密度及骨小梁參數顯著降低,且血清骨生化指標異常,提示小鼠處于典型的骨質疏松狀態。藥物治療后,啤酒花提取物及黃腐酚均可顯著改善GIOP 小鼠的骨微結構破壞,增強骨密度,改善骨小梁參數,防治骨質疏松。ALP 和TRAP 分別為評價骨形成與骨吸收的常用指標,而CTX-I 為成熟膠原降解的標志物,其活性水平與骨密度呈顯著的負相關[11]。本研究中,啤酒花提取物及黃腐酚可顯著提高ALP 含量,抑制TRAP 及CTX-I 的高表達,表明兩者可通過調節骨代謝的平衡防治骨丟失。
在GIOP 細胞層面的發病機制中,GC 對成骨細胞的影響占主導地位[12]。在成骨細胞活性檢測中,MTT 值及ALP 活性分別代表成骨細胞的增殖及分化水平。其中,ALP 合成于骨基質成熟階段,利于骨基質礦化[13]。本研究中,DEX 損傷成骨細胞后,其MTT 值及ALP 活性均顯著下降,表示糖皮質激素抑制了成骨細胞的增殖及分化。藥物治療后,啤酒花提取物及黃腐酚可顯著提高損傷成骨細胞的MTT 值及ALP 活性,有效促進了細胞的增殖與分化,提高成骨細胞活性。BGP、BMP-2 及Runx-2 均為典型的骨形成相關蛋白,其中BGP 是由非增殖期的成骨細胞特異合成并分泌的非膠原蛋白[14],BMP-2 是參與成骨細胞分化階段的主要蛋白[15],而Runx-2 是早期成骨細胞分化的調節因子,三者在骨骼形態發生階段均起著關鍵作用[16]。本研究發現,啤酒花提取物及黃腐酚可顯著促進DEX 損傷成骨細胞中BGP、BMP-2 及Runx-2 的表達,進一步證實了其可通過促進成骨細胞的骨形成對抗GIOP。以上研究為深入探討啤酒花及其活性成分黃腐酚抗骨質疏松的作用機制以及相關藥物的研發奠定了基礎。

