番茄SlSIP1L12基因負調控種子萌發(fā)的研究
崔寶祿,陳國平
(1. 黔南民族師范學院,貴州 都勻 558000;2. 重慶大學,重慶 沙坪壩 400044)
0 引言
【研究意義】Trihelix轉錄因子屬植物特有,其SIP1亞家族基因調控植物生長發(fā)育的研究還不成熟。番茄作為雙子葉模式植物和重要的蔬菜作物,其SIP1亞家族基因的研究更是被邊緣化。因此,研究SIP1亞家族基因的功能與調控模式,對提高該家族基因的認識、增強作物改良的力度具有重要意義。【前人研究進展】農桿菌Ti質粒特定區(qū)域含有生長素或細胞分裂素的編碼基因,其中tml位點(6b基因)參與了植物器官腫瘤的形成。部分植物Trihelix轉錄因子可與6b編碼的蛋白質互作,被稱為Nicotiana tabacum 6b-interacting protein 1(NtSIP1),其編碼基因主要在根、莖、成熟葉和植物頂端區(qū)均有表達;NtSIP1包含2個保守域,核定位信號區(qū)和DNA結合區(qū);NtSIP1可促進6b蛋白與下游基因啟動子的結合,從而實現植物細胞的增殖;NtSIP1 對6b蛋白進入細胞核有促進作用,并通過轉基因試驗證實,NtSIP1與植物細胞增殖、細胞分裂等功能有關[1]。擬南芥中,與6b互作的蛋白Arabidopsis 6binteracting protein 1-like 1(ASIL1)屬于Trihelix轉錄因子,突變體asil1子葉性狀發(fā)生改變:幼苗積累白蛋白、脂肪酸等代謝物質,重要的是ASIL1可識別GT-box[2]。蛋白質結構分析表明:ASIL1的N末端和中心結構域變化較大,氨基酸序列中含有核定位信號和甘氨酸/脯氨酸富集區(qū)[2]。以上分析表明,Trihelix轉錄因家SIP1亞家族蛋白可與6b蛋白互作,其功能研究多見于植物種子。許多植物的基因組中均發(fā)現了SIP1亞家族的基因信息。禾本科植物谷子(Setaria italia)中含有10個基因[3];苦蕎麥(Fagopyrum tataricum)中有9個假定的SIP1基因[4];而十字花科大白菜(Brassica Rapa)中,發(fā)現19個假定的SIP1基因[5]。除此之外,yu等[6]研究證實,茄科植物番茄基因組中含有12個假定的SIP1亞家族基因,11個基因含有0~1個內含子,Solyc09g008850含有6個內含子,編碼256~532個氨基酸;在非生物脅迫和激素誘導下,利用轉錄組測序技術,初步分析了Solyc12g010890和Solyc07g055100基因響應外源因素的情況。【本研究切入點】雖然多種植物的SIP1亞家族基因被發(fā)現,但其生物功能的研究還不盡人意,有待進一步深入。番茄作為重要的模式植物,具有基因組小、基因組測序完整、遺傳轉化效率高且穩(wěn)定等諸多優(yōu)點,但番茄中SIP1亞家族基因的功能尚不明晰。【擬解決的關鍵問題】本研究以番茄自交品種AC++為研究對象,利用RNAi干擾技術抑制了番茄體內SLSIP1L12基因的表達,鑒定了番茄中SLSIP1L12基因的生物功能,為豐富Trihelix轉錄家族SIP1亞家族基因的遺傳信息提供了參考,更為茄科植物的新品種選育提供理論基礎。
1 材料與方法
1.1 試驗材料
本研究采用番茄野生品種AC++(Solanum lycopersicom Mill. cv. Ailsa Craig,引自重慶大學,屬于高度自交品種,遺傳性狀穩(wěn)定、適應性強),種植在黔南民族師范學院溫室大棚中,光照16 h(27 ℃)和黑暗8 h(19 ℃)。待植株開花結果后,分別選取成熟植株的根、莖、葉、花,果實分為未成熟果實(Immature green,IMG)、成熟果實(Mature green,MG)、破色果實(Breaker, B)、破色后4 d(B+4)、破色后7 d(B+7),見圖1所示。所有材料液氮速凍后,存放于?80 ℃冰箱。
1.2 番茄SlSIP1蛋白的生物信息學分析
將擬南芥、番茄等已知物種報道的基因序列在茄科基因組數據庫SGN中搜索番茄所有SlSIP1蛋白的氨基酸序列。將檢索的氨基酸序列進行多重序列比對,根據比對的結果確定該基因編碼的氨基酸序列可能的保守結構域。利用氨基酸序列進行生物進化分析,預測該基因的生物功能。cDNA和基因組的比對采用網站(http://multalin.toulouse.inra.fr/multalin/multalin.html)完成;保守區(qū)預測采用網站(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)完成;多重序列比對采用軟件ClustalX 和DNAMAN,進化樹分析采用軟件MEGA10。
1.3 基因克隆
利用RNAiso Plus提取試劑提取番茄材料RNA,利用M-MLV反轉錄酶對RNA進行反轉錄,獲得組織材料的cDNA作為基因克隆模板。搜索NCBI和SGN數據庫,設計引物cSlSIP1L12-F和cSlSIP1L12-R,擴增出編碼序列,連接到pMD19-T載體上測序。
1.4 植物激素和非生物脅迫處理
番茄AC++種子播種于營養(yǎng)缽中,生長35 d后用于外源激素的處理和非生物脅迫[7]。
生長35 d的番茄幼苗,分別接受噴水(一次性噴水,直到所有葉片滴水為止)、脫水(在水中清洗幼苗根系,直至土壤清洗干凈。放于室溫后,開始取樣,取處理的幼苗中部葉片)、機械損傷(取幼苗中部葉片,用剪刀剪碎葉片至長寬約為1 cm)處理0、1、2、4、8、12、24、36 h后,將處理材料放入液氮速凍后,存放于?80 ℃冰箱[8]。
生長35 d的番茄幼苗,分別采用噴水(對照,CK)、50 μmol·L?1IAA、50 μmol·L?1GA3、50 μmol·L?1茉莉酸 甲 酯(MeJA)、100 μmol·L?1ABA、100 μmol·L?1ACC噴淋1次,直到所有葉片開始滴水為止,分別于0、1、2、4、8、12、24 h后,取幼苗中部葉片放入液氮速凍后,存放于?80 ℃冰箱[9]。
1.5 RT-PCR分析
所有材料采用Trizol試劑提取總RNA,定量PCR采 用SYBR Premix Ex Taq II kit(Promega)體系:5.0 μL 2×SYBR Premix酶、0.5 μL引物、1.0 μL cDNA、3.5 μL去離子水。表達模式分析和轉基因沉默效率鑒定采用基因SlCAC為內參,處理采用基因SlEF1a為內參[10],具體引物見表1。

表 1 引物設計Table 1 Primers applied
1.6 SlSIP1L12基因沉默株系的建立
以cDNA為模板,以SlSIP1L12-F和SlSIP1L12-R為引物,以Primer Star mix酶高保真擴增后,連接到pMD19-T載體上測序,序列比對分析后得到片段大小為455 bp的基因特異序列。采用雙酶切方式以正、反向的方式連接到中間載體pHANNIBAL,再連接到終載體pBI19上。然后,通過將質粒轉移至農桿菌LBA4404中,侵染番茄子葉,誘導愈傷組織,獲得轉基因幼苗,誘導生根,利用卡那霉素編碼基因NPTII設計引物,鑒定轉基因陽性植株。以 qSlSIP1L12為引物,利用qRT-PCR檢測轉基因株系的沉默效率。
1.7 種子發(fā)芽試驗
50粒均勻的轉基因和AC++種子播種在含有2層濕潤濾紙的培養(yǎng)皿中(蒸餾水或加入了消毒劑硫柳汞),黑暗條件下,放入(15±1) ℃的培養(yǎng)箱中培養(yǎng),以胚根突出種皮2 mm作為萌發(fā)的標準,檢測種子 的發(fā)芽率,試驗重復3~5次[11]。
1.8 種子體內ABA總含量檢測
ABA含量的測定采用ABA的ELISA試劑盒(上海生工)[12],試驗方法是:0.1 g發(fā)芽種子(轉基因和AC++種子在發(fā)芽7 d后),用濾紙吸水后,用液氮研磨,80%的甲醇抽提,1 000 r·min?1離心20 min,取上清液,用孔徑為0.45 μm的濾膜清除雜質后,按照ELISA說明書進行操作,在波長450 nm下檢測結果,并利用標準曲線鑒定ABA含量。
2 結果與分析
2.1 SlSIP1L12基因生物信息分析
以番茄AC++的cDNA為模板,擴增SlSIP1L12基因(基因ID:Solyc12g043090)的編碼序列。經測序證實,總長為1 125個堿基,編碼374個氨基酸,比報道的番茄品種1 706少3個堿基/1個氨基酸[6],缺少的氨基酸是N末端第61位的谷氨酸,這可能與所用番茄的品種有關。進一步分析表明,該氨基酸序列的保守區(qū)位為135~222和302~358區(qū)段,保守區(qū)可形成Trihelix結構域、第四螺旋和一個保守中央結構域(圖2);核定位單元信號為193~203和212~221區(qū)段。圖3進化分析表明,番茄SlSIP1L12與SlSIP1L5位于同一分枝,但SlSIP1L12與所有檢測蛋白序列的一致性均低于47.2%(表2),說明,番茄內部SIP1亞家族進化較明顯。
2.2 SlSIP1L12基因表達模式分析
為進一步預測基因的生物學功能,利用RTPCR檢測了SlSIP1L12基因在番茄品種AC++不同組織中的表達水平。結果表明,基因SlSIP1L12在莖、成熟葉中表達量最高,在花、果實等生殖器官和組織中次之,在根、幼葉中表達量最低(圖4)。
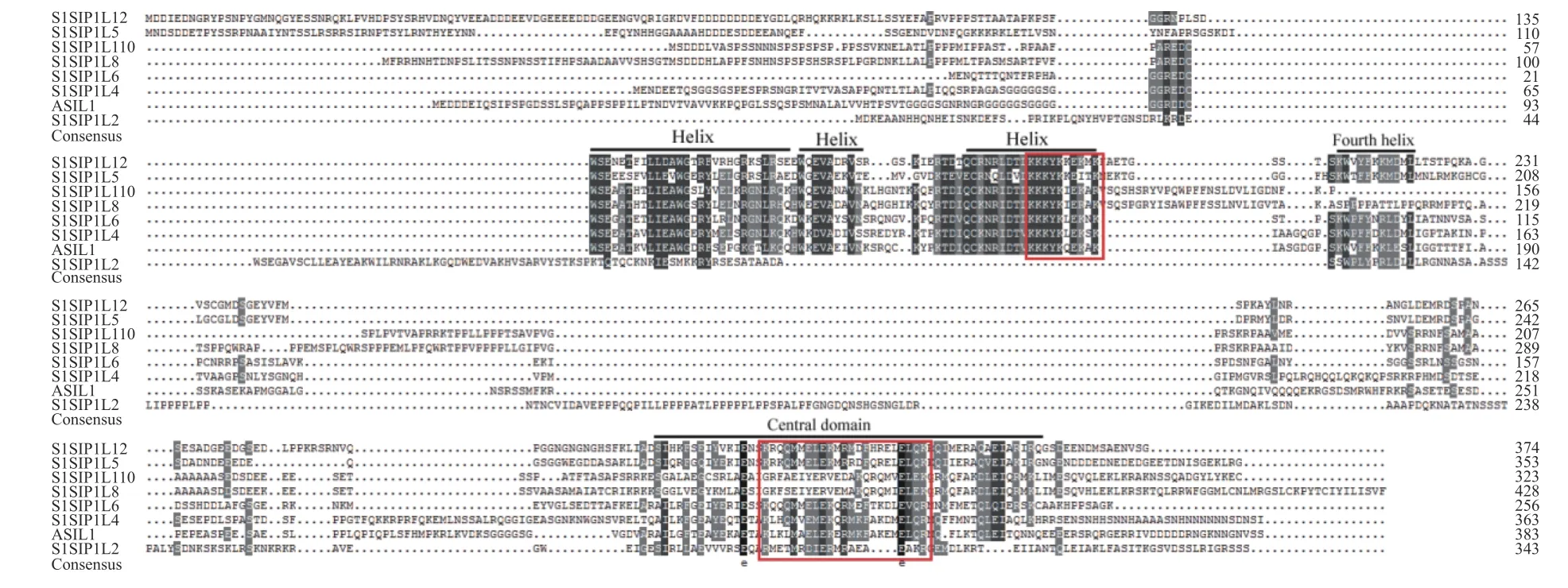
圖 2 SIP1亞家族蛋白結構Fig. 2 The structure of SIP1 proteins
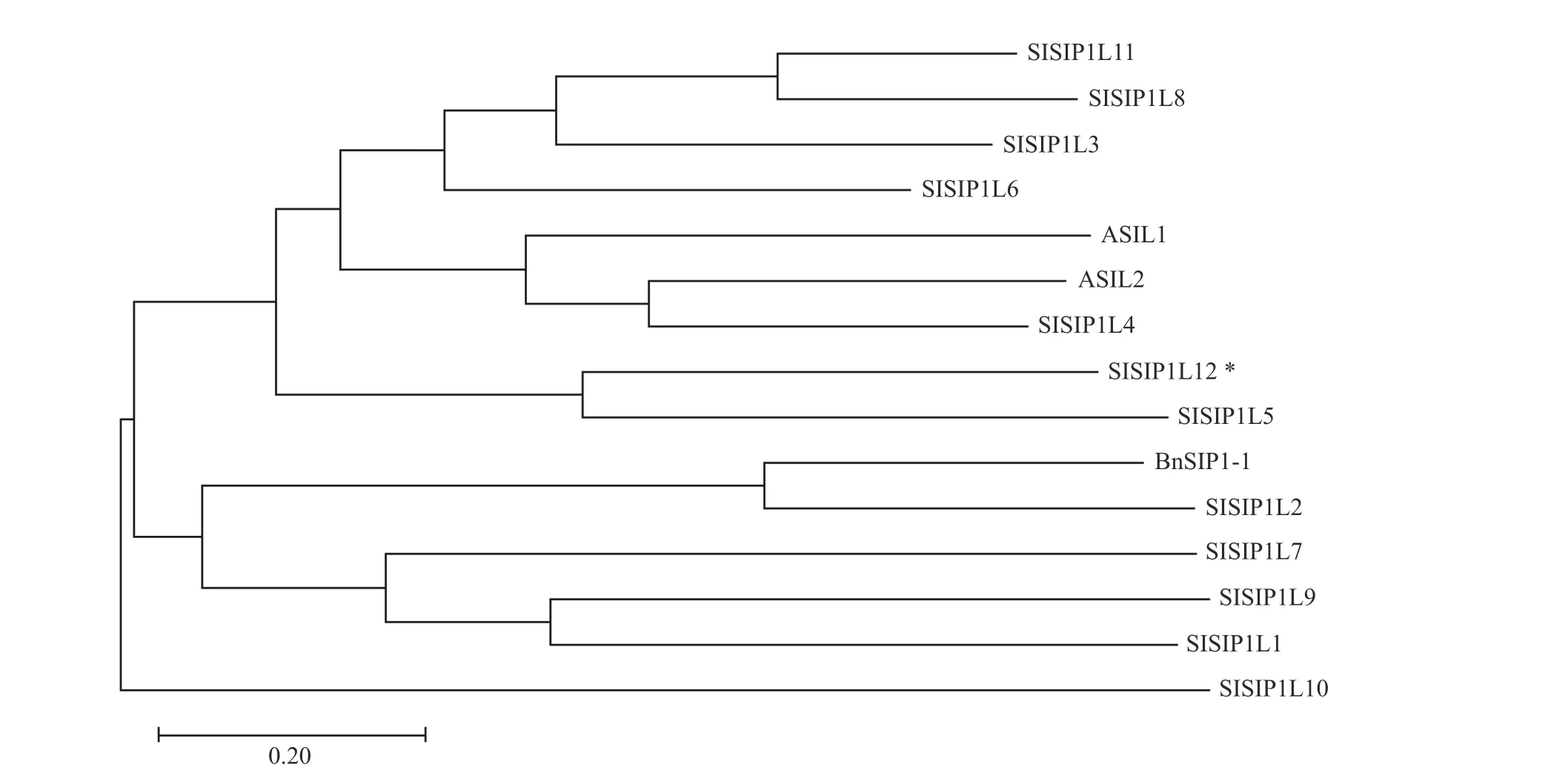
圖 3 生物進化分析SIP1亞家族蛋白質Fig. 3 Phylogenetic analysis of SIP1 proteins
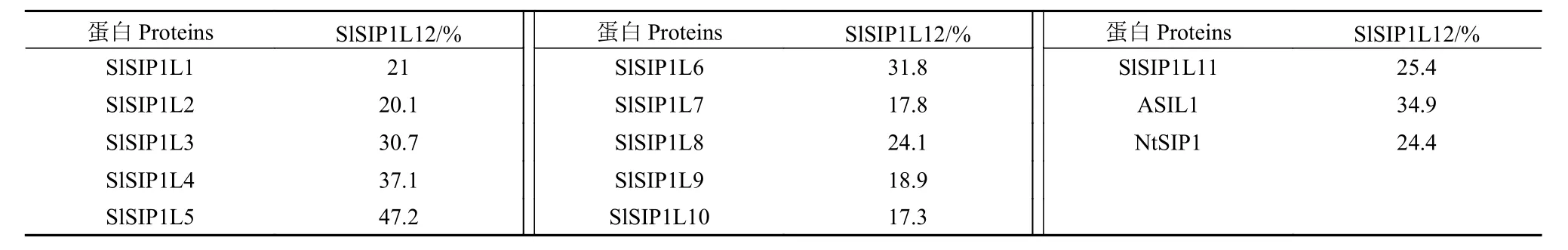
表 2 氨基酸序列一致性分析Table 2 The similarity of SIP1 proteins
2.3 SlSIP1L12對外源植物激素和非生物脅迫的響應
圖5-A表明,IAA、GA3、MeJA和ACC(乙烯合成的前體)等4種激素處理24 h后,SlSIP1L12基因表達水平并未發(fā)生顯著變化,而接受ABA處理時,SlSIP1L12基因的表達水平出現明顯變化:2 h后SlSIP1L12表達水平逐步提高,8 h后達到最高,為初始表達量的4.6倍。初步預測,SlSIP1L12是ABA下游的響應基因。圖5-B顯示,在接受機械損傷誘導時,SlSIP1L12的表達水平相比對照較穩(wěn)定;而脫水脅迫時,SlSIP1L12的表達受到顯著誘導,處理2 h后,SlSIP1L12基因的表達水平開始提高,36 h后,它的表達量最高,是初始水平的8.9倍。綜上所述,SlSIP1L12基因的功能可能與ABA的響應有關。
2.4 轉基因株系的鑒定
經轉基因鑒定,獲得6個沉默株系(圖6),沉默效率為64%~83%,而沉默效率最高的株系RNAi-13未結出果實。因此選擇沉默效率相對較高的2個株系RNAi-4和RNAi-5作為進一步研究對象。
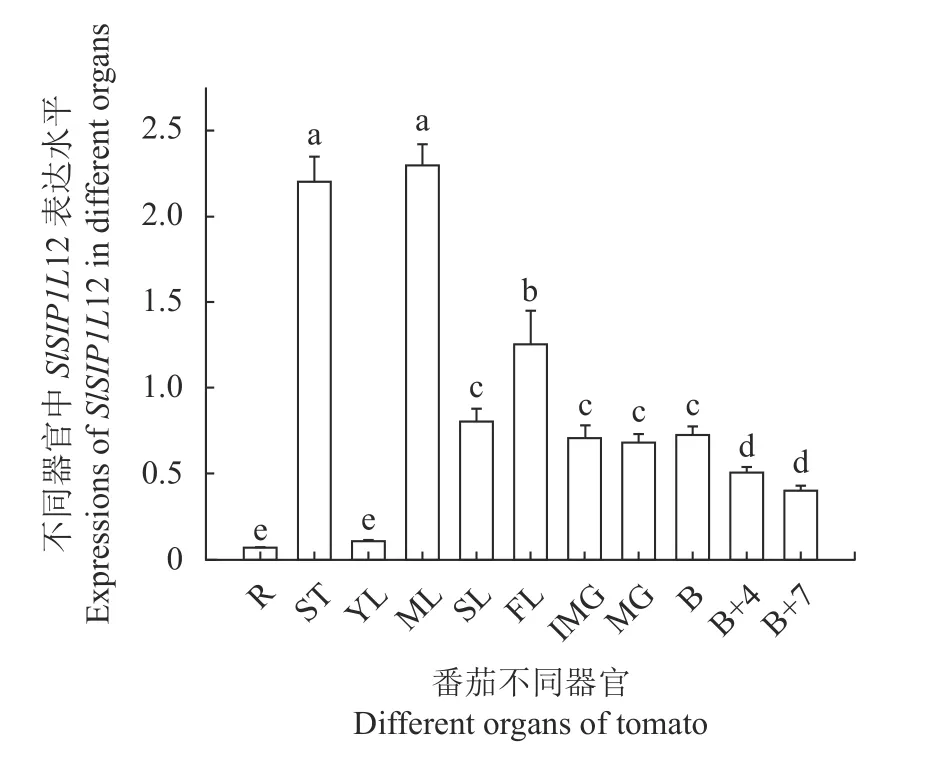
圖 4 AC++不同組織中SlSIP1L12的表達模式Fig. 4 Expressions of SlSIP1L12 in different tissues of AC++
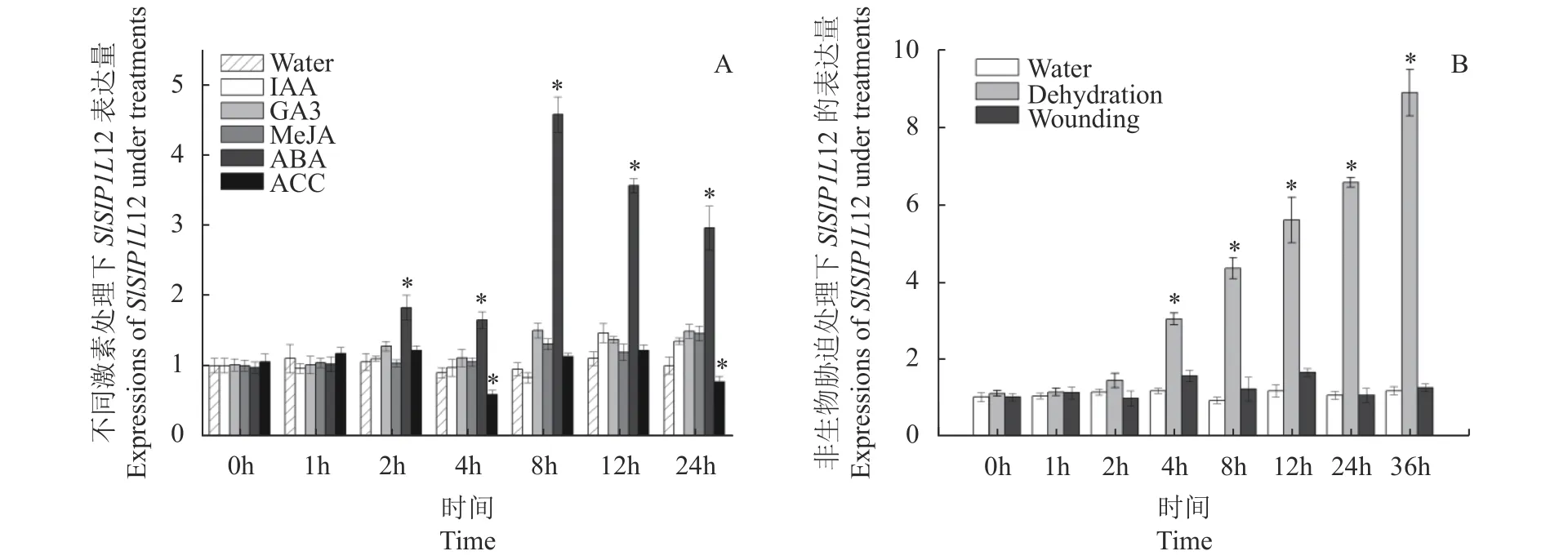
圖 5 不同處理下SlSIP1L12基因的表達模式分析Fig. 5 Expressions of SlSIP1L12 under treatments by different stimuli
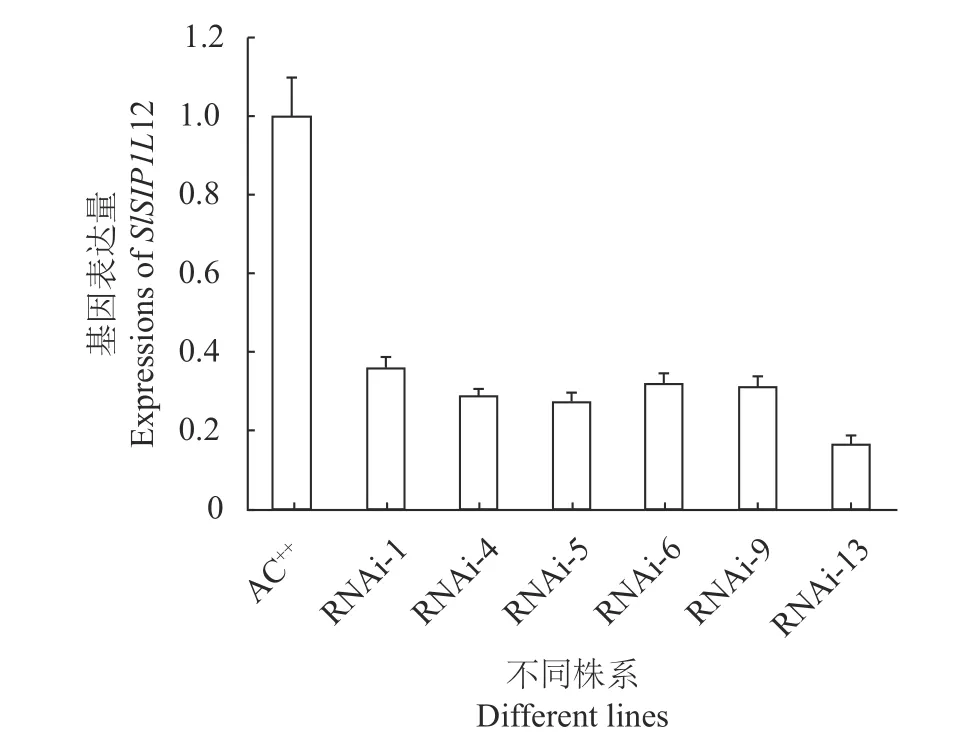
圖 6 轉基因不同株系中SlSIP1L12的表達水平Fig. 6 Expressions of SlSIP1L12 in RNAi-SlSIP1L12 lines
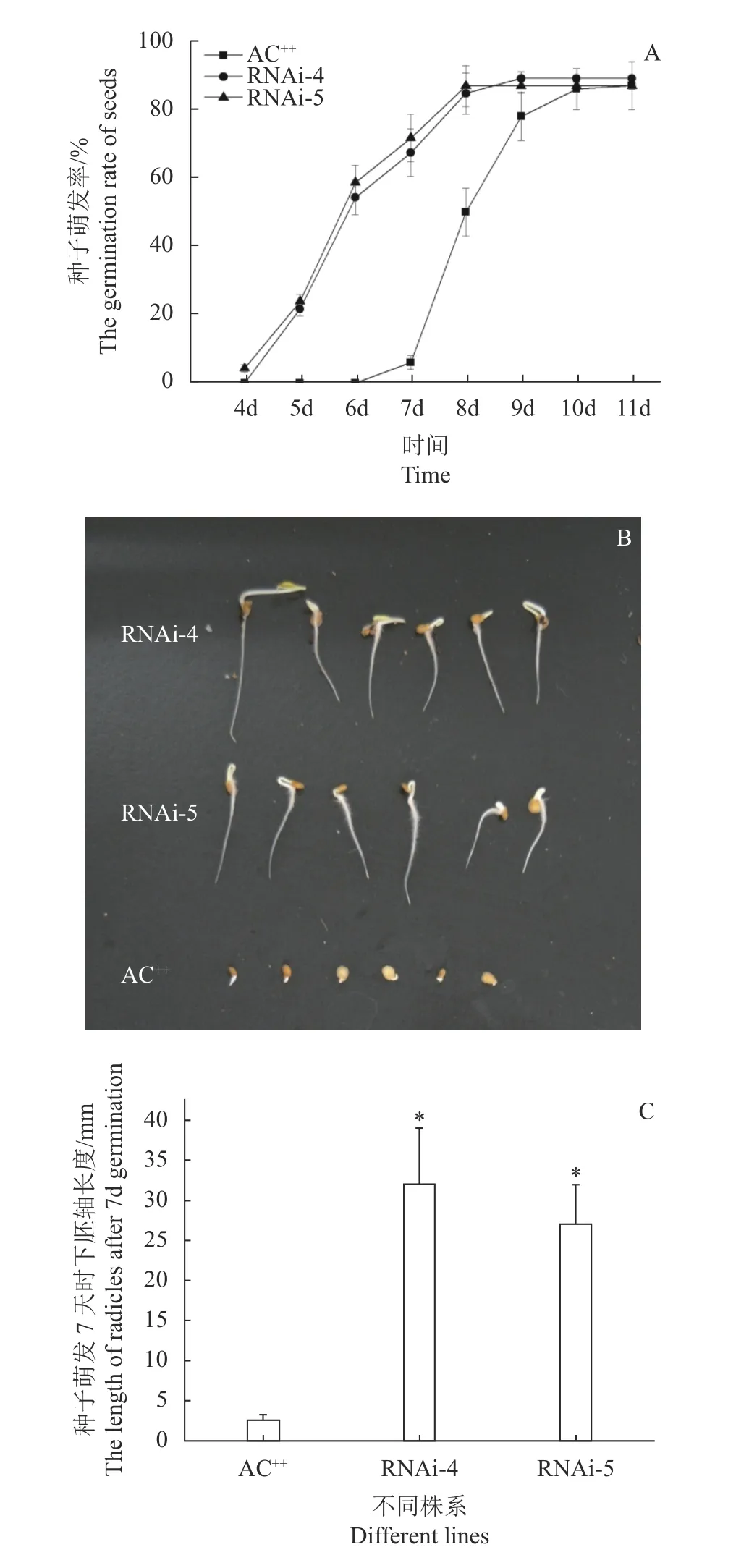
圖 7 轉基因植株和AC++種子的發(fā)芽試驗 Fig. 7 Seed germination of transgenic and control plants
2.5 種子發(fā)芽情況的鑒定
本研究證實SlSIP1L12基因的表達受ABA誘導,而ABA對種子萌發(fā)有顯著的抑制作用,推測抑制SlSIP1L12表達可提高種子萌發(fā)速度。轉基因及對照番茄種子培養(yǎng)4 d后,RNAi-4和RNAi-5株系種子開始萌發(fā),5~7 d時,轉基因株系種子的胚根進入迅速萌發(fā)期,9 d后發(fā)芽率趨于穩(wěn)定。而番茄AC++種子7 d后才開始萌發(fā),7~9 d為快速萌發(fā)期,10 d后發(fā)芽率趨于穩(wěn)定(圖7-A)。在種子萌發(fā)7 d時,轉基因株系的胚根長度是對照的10~15倍(圖7-B、7-C)。以上試驗結果表明,轉基因株系的種子萌發(fā)速度比對照快2 d左右。
2.6 轉基因植株發(fā)芽速度快的機理研究
為進一步分析轉基因植株種子萌發(fā)速度快的原因,本研究檢測了依賴于ABA信號途徑的AREB基因和不依賴于ABA的DREB基因的表達水平[13]。圖8-A證實,2個基因表達均受到了抑制,說明SlSIP1L12基因的沉默抑制了植株體內ABA響應。進一步分析種子萌發(fā)7 d后ABA的含量,發(fā)現轉基因種子體內ABA的含量顯著降低(圖8-B)。因此,進一步證實了SlSIP1L12基因調控種子萌發(fā)的機理與ABA響應有關。
3 討論與結論
Trihelix轉錄因子SIP1亞家族含有保守的Trihelix結構域(前2個螺旋結構的N端是保守的色氨酸,第三個螺旋的保守色氨酸被異亮氨酸取代)、第四螺旋和α-螺旋中心結構域[14]。SIP1蛋白保守區(qū)比對結果顯示,SlSIP1L12屬于SIP1亞家族(圖2),但序列一致性分析證實,SIP1亞家族蛋白間的氨基酸一致性較低,說明了SIP1蛋白間保守區(qū)的序列一致性較強,但保守區(qū)以外的序列分化較明顯。沉默株系植株的表型分析說明,該基因與NtSIP1的功能相似[1]。而SlSIP1L12是否為6b的互作因子待進一步證實。
植物激素ABA誘導或抑制了許多下游基因的表達變化,而下游基因轉錄水平的改變對ABA響應及其相關生理作用有一定的干擾或促進作用,進而改變植物的生長或適應能力[15?16]。本研究在進行激素和非生物脅迫處理時,發(fā)現SlSIP1L12響應ABA和脫水脅迫的誘導(圖5)。因此推測,SlSIP1L12是ABA下游的響應基因,沉默SlSIP1L12的表達可能抑制植物對ABA響應。轉基因試驗證實,沉默株系的種子萌發(fā)速度比對照快2 d左右;發(fā)芽7 d后,轉基因株系胚根的長度是對照的10倍左右(圖7)。通常種子的萌發(fā)分為三個階段:吸水期、代謝期和萌發(fā)期。后兩個發(fā)育階段必然會受到激素的調控作用[17-18]。DREB為不依賴于ABA的脅迫誘導基因,AREB為依賴于ABA的脅迫誘導基因[19]。而試驗結果表明,AREB和DREB的表達水平均受到顯著抑制,說明抑制SlSIP1L12的表達除了降低ABA響應外,還改變了非ABA響應,其調控作用有待深入探索(圖8)。此外,相同條件下,轉基因株系的種子萌發(fā)速度快于AC++的原因可能與ABA的響應受到抑制有關。進一步試驗證實,發(fā)芽期間ABA的含量顯著低于對照(圖8),說明SlSIP1L12正調控了ABA的合成,但SlSIP1L12基因參與ABA信號途徑的機制,還有待進一步試驗驗證。
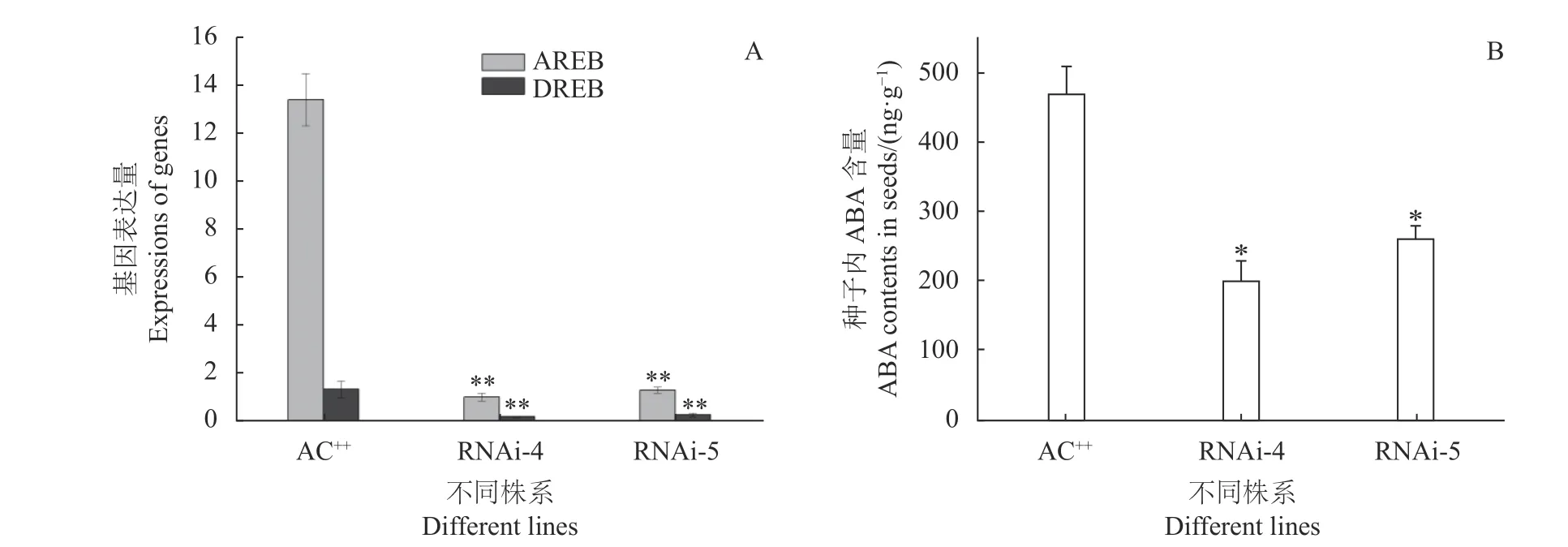
圖 8 沉默株系內下游基因與相關激素的檢測Fig. 8 Expressions of downstream genes in transgenic and control plants
種子萌發(fā)與否與內源激素ABA和GA的平衡密切相關,ABA促進種子營養(yǎng)物質的合成與脫水耐性,而GA促進營養(yǎng)成分的分解[20]。本研究中,SlSIP1L12基因的表達受到ABA和脫水脅迫的雙重誘導,而不響應GA3的誘導(圖5),因此推測,SlSIP1L12的基因功能與ABA途徑關系較密切。然而,GA與ABA存在許多交互作用,且乙烯、油菜素內酯、含氮化合物等激素也經常貫穿其中,并影響二者的作用[20],因此,轉基因植株體內ABA響應基因表達或種子體內ABA含量的變化只是初步的驗證,ABA與GA激素的互作機制將在后續(xù)的研究中深入分析。
本研究克隆到Trihelix轉錄因子SIP1亞家族基因SlSIP1L12全長為1 125 bp。該基因主要在地上部分表達,可受ABA與脫水脅迫誘導。利用RNAi技術獲得的轉基因植株 葉片中,ABA響應基因的表達顯著受到抑制;轉基因植株種子的發(fā)芽速度快于對照,且發(fā)芽7 d時,轉基因種子體內ABA含量明顯小于對照。

