瀘州市COVID-19肝損傷特征及治療效果分析
劉 菲,吳 剛,孫長峰,黃富禮,陳遠芳
(西南醫科大學附屬醫院感染病科/結核科/感染與免疫實驗室,四川瀘州 646000)
新型冠狀病毒肺炎(COVID-19)是由嚴重急性呼吸綜合征冠狀病毒2(SARS-CoV-2)感染引起的一種新發呼吸道傳染病[1]。根據臨床實踐及文獻報道,COVID-19可導致患者出現不同程度的肝功能異常[2-3],且病死率隨著丙氨酸氨基轉移酶(ALT)水平升高而增加[4]。因此,明確COVID-19相關肝損傷的發病機制,了解不同程度肝損傷患者臨床特點及保肝藥物的治療效果,對于制訂適宜治療方案具有重要意義。截至2020年3月,瀘州市傳染病定點醫院共收治24例COVID-19確診患者,20例出現了不同程度的肝功能相關指標異常。本文根據肝功能損傷的不同程度來描述COVID-19患者的臨床特征,分析COVID-19患者合并肝功能異常的可能原因,并總結加用異甘草酸鎂注射液治療后患者肝功能相關指標的變化,以為COVID-19肝損傷的機制研究及治療提供一定的臨床依據。
1 資料與方法
1.1 一般資料
納入2020年1-3月瀘州市COVID-19定點醫院收治的確診COVID-19患者24例,診斷標準及臨床分型參考《新型冠狀病毒感染的肺炎診療方案(試行第七版)》[5]。本研究通過醫院醫學倫理委員會審核批準。根據肝功能相關指標升高的程度將出現肝功能異常的20例COVID-19患者分為肝功能異常輕度、中度、重度組。
1.2 方法
收集24例確診為COVID-19患者的基本資料及肝功能相關指標:ALT,天門冬氨酸氨基轉移酶(AST),堿性磷酸酶(ALP),γ-谷氨酰轉肽酶(GGT),清蛋白(ALB),總膽紅素(TBIL)。上述指標中任一項升高大于正常值上限(ULN)即診斷為COVID-19相關肝功能異常。并根據上述相關指標升高的不同程度將合并肝功能異常的COVID-19患者分為輕度、中度、重度組:輕度組為ALT或AST<2×ULN,且TBIL<1.5×ULN;中度組為2×ULN≤ALT或AST <3×ULN,和(或)1.5×ULN ≤TBIL<2×ULN;重度組為ALT或AST≥3×ULN,和(或)TBIL≥2×ULN。參考值范圍根據本院檢驗科標準:ALT 7~40 U/L、AST 13~35 U/L、ALP 35~125 μmol/L、GGT 7~50 μmol/L、ALB 40~55 g/L、TBIL 5.1~28 μmol/L。所有確診COVID-19的治療方法均參考《新型冠狀病毒感染的肺炎診療方案(試行第七版)》[5]。病程中出現ALT或AST≥2×ULN,或TBIL ≥ 1.5×ULN,3 d后復查上述指標仍無明顯下降,且排除心、腎衰竭患者,加用異甘草酸鎂注射液(150 mg,靜脈滴注,1次/天)。分析COVID-19患者一般特征和出現不同程度肝功能異常的臨床特征,以及部分患者加用異甘草酸鎂注射液后肝功能生化指標的變化。
1.3 統計學處理
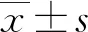
2 結 果
2.1 患者一般臨床特征
瀘州市定點醫院共收治COVID-19確診患者24例,均有COVID-19確診患者接觸史,年齡5~68歲,男13例(54.17%),女11例(45.83%)。臨床癥狀主要為畏寒、發熱、咳嗽、咳痰、氣促、咽痛、流涕,少數伴有惡心、嘔吐、食欲缺乏等消化道癥狀。重癥肺炎4例,其余患者均為普通型肺炎。全部患者好轉或治愈出院。合并糖尿病、陳舊性肺結核、高血壓和(或)慢性乙型病毒性肝炎(CHB)等基礎疾病患者7例,其中3例CHB患者均為HBeAg陰性患者,乙型肝炎病毒(HBV)DNA<103拷貝/mL,全程未進行抗病毒治療。24例COVID-19患者病程中出現肝功能相關指標異常的共有20例(83.33%),多數患者肝功能相關指標呈輕微異常,可隨病情好轉自行恢復至正常范圍,其中10例(41.67%)患者肝功能損傷較明顯,滿足保肝治療的標準。在滿足保肝治療的10例患者中,1例重型肺炎患者因治療過程病情加重,ALT短時間內從正常升高至大于3×ULN,予以機械通氣、糾正呼吸衰竭,3 d后復查ALT恢復正常,考慮缺氧性肝炎,未加用任何特異性保肝藥物;1例普通型肺炎患者因口服洛匹那韋/利脫那韋(200 mg,2次/天)后出現惡心、食欲缺乏等明顯消化道癥狀,TBIL上升至60.58 μmol/L,考慮藥物性肝損傷可能,停用抗病毒藥物,加用谷胱甘肽注射液(1.2 g,靜脈滴注,1次/天),3 d后復查TBIL降至正常;其余8例因3 d后復查肝功能無明顯好轉,加用異甘草酸鎂注射液保肝治療。
2.2 不同程度肝功能異常患者的臨床特征
肝功能異常輕度、中度、重度組患者間的性別、年齡及預后比較,差異均無統計學意義(P>0.05)。合并糖尿病患者更易出現重度肝功能異常(P<0.05),而是否合并高血壓、CHB及肺結核與肝損傷程度無明顯相關性。重度組中重癥肺炎占60.00%,明顯高于輕、中度組,且與輕度組比較差異有統計學意義(P<0.05)。在肝功能生物化學的表現上,中、重度組患者的ALT、AST、GGT異常率高于輕度組(P<0.05),但3組患者TBIL、ALP升高水平比較差異無統計學意義(P>0.05),輕度組更多表現為TBIL稍微升高,重度組則多為ALT、AST同時升高,并伴ALB下降。且重度組的住院時間更長,見表1。
2.3 異甘草酸鎂注射液治療前后肝功能比較
8例患者加用異甘草酸鎂注射液(150 mg 靜脈滴注,每天 1次)保肝治療,療程為5~14 d。8例患者治療后,ALT、AST、GGT水平均明顯下降(P<0.05);TBIL水平治療后稍有改善,但治療前后比較差異無統計學意義(P>0.05),見表2。

表1 不同程度肝損傷特征分析

表2 患者治療前后肝功能相關指標比較
3 討 論
SARS-CoV-2與SARS-CoV及中東呼吸綜合征(MERS) 冠狀病毒感染的病理特征類似,均通過血管緊張素轉換酶2(ACE2)受體感染人體細胞[6],ACE2 屬于ACE家族的二肽基羧基二肽酶,廣泛表達于動脈、靜脈的內皮細胞,平滑肌細胞及膽管上皮細胞。HAMMING等[7]研究發現,ACE2蛋白在肺泡上皮及小腸上皮組織表達最為豐富。因此,SARS-CoV-2主要造成肺損傷,大多患者有咳嗽、咳痰、呼吸困難等典型的呼吸系統癥狀,8.0%~12.9%的患者會有腹瀉表現[6],糞便中也可檢測到SARS-CoV-2 RNA,同時也會累及肝、心、腎等器官。根據現有的臨床數據,COVID-19患者病程中的肝功能異常率為14.0%~55.0%[4],首例COVID-19患者肝臟活檢結果顯示,肝細胞呈中度微血管脂肪變性、灶性壞死伴中性粒細胞浸潤,肝血竇充血,匯管區見淋巴細胞和單核細胞浸潤,微血栓形成,膽囊高度充盈[8]。但其潛在機制尚未明確,目前認為病毒直接作用、全身炎性反應、缺血缺氧再灌注損傷、藥物作用均是可能原因[9]。此外,COVID-19患者CD4 T細胞中高度促炎性趨化因子受體(CCR)4、CCR6、輔助性T細胞17(Th17)水平升高,以及CD8 T細胞中高水平的細胞毒性顆粒,提示T細胞處于過度激活狀態[8],這說明免疫損傷也可能是造成肝功能異常不可忽略的因素[10]。臨床資料顯示,COVID-19相關的肝損傷主要表現為ALT和(或)AST的輕度升高,而反映膽管損傷的ALP及GGT無明顯異常[11-12],因此,關于病毒通過ACE2陽性的膽管上皮細胞直接損傷肝臟的機制尚存在一定的爭議。但本研究中,患者出現TBIL和GGT的異常率較高,因此,本研究更傾向于SARS-CoV-2可直接損傷肝臟膽管上皮細胞,但毒性作用輕微。此外,也可能與SARS-CoV-2感染的非特異性炎癥相關。
ALT、AST是肝細胞損傷的主要標志物[13],本研究通過對肝功能異常程度進行分層分析發現,輕度組的患者ALT、AST、GGT異常率不高,且可以隨著COVID-19的好轉而自行恢復,而中、重度組的患者更多表現為ALT、AST、GGT等多項肝生物化學指標異常,這提示后者可能存在真正的肝損傷,需要密切監測肝功能相關指標變化,及時予以保肝治療。COVID-19重癥患者與肝損傷關系密切[10,14-15]。一項大樣本隊列研究,通過分析1 099例中國COVID-19確診病例發現,病程中ALT、AST升高大于ULN的總發生率分別為21.32%、22.20%,而重癥患者ALT、AST升高的發生率上升至28.15%、39.43%[11]。本研究從肝生物化學異常程度的角度分析,發現隨著肝功能異常程度的增加,重癥肺炎的比例也在上升。目前認為重度肝功能異常多是繼發于重癥肺炎所致,因此,對于這部分患者,治療上應重點關注原發疾病的處理,在糾正缺氧、抑制炎癥風暴、調節免疫的基礎上,合理加用保肝藥物。
異甘草酸鎂注射液是臨床常用的甘草酸制劑,主要成分18α異構體草酸,是一種肝細胞保護劑,具有抗炎、保護肝細胞膜、調節免疫的作用[16]。對于以肝細胞損傷為主的COVID-19相關肝損傷,異甘草酸鎂注射液理論上具有良好的效果。本研究中8例肝損傷明顯的患者均以ALT、AST、GGT升高為主,加用異甘草酸鎂注射液保肝治療后,ALT、AST、GGT均有明顯改善,提示該藥物對COVID-19肝損傷有較好的效果。因此,對無禁忌證的COVID-19患者,病程中出現以ALT、AST、GGT升高為主要表現的中、重度肝功能異常,可加用異甘草酸鎂注射液保肝治療。
綜上所述,COVID-19合并肝損傷發生率較高,病因是多方面的,因此,應根據患者的一般情況及出現肝功能異常的程度,個體化地給予干預。根據本研究的結果推斷,異甘草酸鎂注射液對于中、重度COVID-19相關的肝功能異常有較好的降酶效果。但本研究樣本量較小,且為單中心研究,存在一定的局限性,還需要進一步研究證實。

