麥長管蚜miRNA實時熒光定量PCR內參基因的篩選
楊超霞, 閆 藝, 張方梅, 朱 勛, 張云慧,*, 李祥瑞,*
(1. 中國農業科學院植物保護研究所, 植物病蟲害生物學國家重點實驗室, 北京 100193; 2. 信陽農林學院, 河南信陽 464000)
微小RNA(microRNA, miRNA)是真核細胞中的一類長度約18~24 nt的非編碼單鏈小RNA分子,在轉錄后水平上通過抑制靶基因的翻譯或降解靶基因發揮重要的調控作用(Florisetal., 2016; Kraussetal., 2018)。研究表明,miRNA在昆蟲中廣泛存在,且高度保守,參與昆蟲生長發育、變態、生殖以及細胞增殖、細胞凋亡等幾乎所有的生物學過程(Rahimpouretal., 2019; Yeetal., 2019; Song and Zhou, 2020)。隨著miRNA的深入研究,對特定條件下miRNA表達量的分析已成為闡述miRNA功能的一個重要手段(Wangetal., 2017)。
實時定量PCR(qRT-PCR)是目前研究miRNA基因表達的一種標準技術(Lüetal., 2018; Youetal., 2018; Shuklaetal., 2019; Yanetal., 2019)。但是在實際應用中,RNA質量、cDNA的濃度、轉錄、聚合酶擴增效率等的變異會產生系統性的誤差,導致得出錯誤甚至相反的結論(Bustin, 2010)。為了減少樣品間的誤差,通常需要適宜的內參基因對miRNA的定量表達結果進行校正,以便獲得可靠的實驗結果(Zhangetal., 2015; Wangetal., 2017)。
在qRT-PCR中穩定表達的內參基因在不同物種或同一物種的不同組織、不同發育階段和不同環境脅迫條件下也可能存在表達水平的變化(Shakeeletal., 2017; Tanetal., 2017; Lüetal., 2018),即同一個內參基因可以適用于多個實驗條件,但沒有一個內參基因可以適用于所有的實驗條件。核內小RNA U6 [snRNA(U6)]和核糖體RNA 5S rRNA常被選作昆蟲miRNA表達分析內參基因,這兩個基因在昆蟲各組織和細胞中廣泛表達,且在多種昆蟲miRNA的表達水平研究中已有諸多報道,如麥長管蚜Sitobionavenae(Lietal., 2016)、小菜蛾Plutellaxylostella(Shakeeletal., 2018)、斜紋夜蛾Prodenialitura(岑永杰等, 2019)和白背飛虱Sogatellafurcifera(Changetal., 2018)等。但是大量實驗結果表明,U6或5S rRNA在用作內參基因時,由于實驗條件不同,在一些特定的條件下的表達并不穩定(Wangetal., 2017; Yangetal., 2017; Zhangetal., 2019)。因此,許多特定條件下穩定表達的miRNA被篩選出來作為內參基因,但相關研究多集中在植物、線蟲和人類疾病中(Luoetal., 2018; Ragnietal., 2019; Verstraetenetal., 2019)。迄今為止,只有幾種關于昆蟲miRNA表達分析內參基因篩選的報道,如梨小食心蟲Grapholitamolesta(Wangetal., 2017)、棉鈴蟲Helicoverpaarmigera(Yangetal., 2017)、小菜蛾(封冰等, 2014; Zhangetal., 2019)、大黃蜂Bombuslantschouensis(Dongetal., 2019)等。因此,篩選和評價不同實驗材料及不同實驗條件下穩定表達的miRNA表達分析內參基因,對獲得準確的實驗結果尤為重要。
麥長管蚜隸屬同翅目(Homoptera)蚜總科(Aphidoidea),是小麥生產上重要的世界性害蟲(Daietal., 2014; Huangetal., 2015)。隨著研究的不斷深入,在基因水平上研究麥長管蚜的寄主選擇(Huangetal., 2015)、抗藥性(Weietal., 2019)和翅型分化(Lietal., 2016)等重要生物學特征時,首先需要對相關基因的表達進行分析,但目前尚無關于麥長管蚜miRNA表達分析內參基因穩定性表達篩選的報道,因此亟需篩選穩定表達的內參基因或miRNA作為參照。本研究基于Illumina轉錄組測序鑒定出的麥長管蚜的9個miRNA (miR-10-3p, miR-993, miR-276, miR-275, miR-252a, miR-1, miR-375, pc-15和pc-73)和1個常用內參基因U6作為候選內參基因,以麥長管蚜有翅蚜和無翅蚜不同發育階段、不同組織以及不同藥劑處理無翅蚜的樣本為材料,利用qRT-PCR技術對這些候選內參基因進行表達量分析,結合GeNorm, BestKeeper, ΔCt法, NormFinder和RefFinder 5種方法對各候選內參基因表達的穩定性進行了評估,為不同實驗條件下選擇合適的麥長管蚜miRNA表達分析內參基因提供參考依據,也為其他昆蟲篩選miRNA表達分析內參基因提供方法借鑒。
1 材料與方法
1.1 試蟲飼養及樣本收集
麥長管蚜成蟲于2012年4月采自農業部廊坊作物有害生物科學觀測實驗站的小麥田中(39°30′42″N, 116°36′7″E),帶回實驗室在養蟲籠中連續擴繁多代。從養蟲籠內挑出無翅成蚜(實驗中的有翅蚜和無翅蚜都來自于最初的無翅蚜母本),單頭飼養,連續飼養3代,將第3代成蚜的初產若蚜作為實驗用蟲(在室內以中麥175飼喂麥長管蚜)。飼養條件:溫度20±1℃、相對濕度50%~70%、光周期16L∶8D。
發育階段樣本:根據蛻皮次數分別收集麥長管蚜有翅蚜和無翅蚜1-4齡若蚜和成蟲樣本,每齡期3個重復,每個重復根據齡期蟲體大小收集樣本約30 mg。
組織樣本:利用微解剖剪分別切下麥長管蚜有翅蚜和無翅蚜的頭(45個/重復)、胸(30個/重復)和腹(20個/重復)3種組織部位,每組織3個重復。
藥劑處理樣本:根據實驗室前期實驗結果,獲得了95.1%吡蟲啉原藥、97.8%噻蟲啉原藥、95%阿維菌素原藥和40%氧樂果乳油4種藥劑對麥長管蚜無翅成蚜的LC50值(Gongetal., 2020),將上述各藥劑用吐溫水稀釋至LC50,采用浸葉法處理麥長管蚜無翅蚜,24 h后收集存活的無翅蚜。每處理重復3次,每重復收集10頭試蟲。
將以上所有收集的樣品均置于液氮浮浴的1.5 mL離心管中速凍,-80℃下保存提取RNA備用。
1.2 供試藥劑及試劑
供試藥劑:吡蟲啉原藥(95.1%)、噻蟲啉原藥(97.8%)、阿維菌素原藥(95%),由中國農業科學院植物保護研究所農藥實驗室提供;氧樂果乳油(40%)由河北新興化工有限公司生產。
供試試劑:總RNA提取試劑TRIzol Reagent(Ambion, 美國)、RNA反轉錄試劑盒miScriptII RT Kit(Qiagen, 德國)、miRNA熒光定量試劑盒TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)(TaKaRa, 日本)。
1.3 總RNA提取及cDNA合成
按照TRIzol法提取1.1節中各個樣本總RNA,結合ND-2000分光光度計(Thermo Scientific, 美國)和1%瓊脂糖凝膠電泳檢測總RNA的質量和濃度。按照miRNA反轉錄試劑盒miScript II RT Kit說明書構建反轉錄體系,合成cDNA第1鏈。
1.4 候選內參基因的篩選和引物設計
根據本實驗前期麥長管蚜miRNA Illumina測序結果,篩選出在麥長管蚜兩翅型不同發育階段表達量較高且表達穩定的9個miRNA(miR-10-3p, miR-993, miR-276, miR-275, miR-252a, miR-1, miR-375, pc-15和pc-73)和1個常用的內參基因U6作為候選內參基因(表1),并利用Primer Premier 5設計qRT-PCR引物(表1),引物由生工生物工程(上海)股份有限公司合成。
1.5 候選內參基因相對表達量檢測
利用qRT-PCR測定10個候選內參基因在1.1節中收集的麥長管蚜有翅蚜不同發育時期、無翅蚜不同發育時期、有翅蚜和無翅蚜不同組織和4種化學藥劑處理無翅蚜樣本中的相對表達量。參考miRNA熒光定量試劑盒說明書,構建熒光定量反應體系(25 μL): 2×TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)12.5 μL, 正反向引物(10 μmol/L)各1 μL, cDNA模板2 μL, 雙蒸水8.5 μL。反應條件: 95℃預變性30 s; 95℃變性5 s, 60℃退火30 s, 70℃延伸34 s,共40個循環。最后在60~95℃之間探測產物的溶解曲線以檢測引物的質量。每樣本重復測定3次。利用BIO-RAD CFX-connectTMReal-Time System軟件(Bio-Rad, 美國)對設置反應條件和結果輸出。
1.6 候選內參基因穩定性分析
利用GeNorm(Vandesompeleetal., 2002), ΔCt法(Silveretal., 2006), NormFinder(Andersenetal., 2004)和BestKeeper(Pfaffietal., 2004)對10個候選內參基因在1.1節中收集的麥長管蚜有翅蚜不同發育時期、無翅蚜不同發育時期、有翅蚜和無翅蚜不同組織和4種化學藥劑處理無翅蚜樣本中的表達穩定性進行評估,具體方式參照其使用說明。最后,通過RefFinder在線網站(https:∥www.heartcure.com.au/reffinder/)對所有候選內參基因進行綜合比較與穩定性評估(Xieetal., 2012)。
GeNorm計算不同處理中各內參基因表達穩定性(M值),M值越小代表選擇的內參基因穩定性越好。同時,可利用GeNorm計算得到配對變異值V,當Vn/(n+1)<0.15時,則表示該條件下最佳內參基因的數目為n個;NormFinder計算不同樣本組內和組間的變化來評估內參基因表達穩定值(SV),該值越小表示內參基因越穩定;ΔCt法是對各內參基因的ΔCt值的標準偏差進行兩兩比較,對基因表達的穩定性進行排序;BestKeeper是以每個基因之間產生配對的標準差(SD)、變異系數(CV)及相關系數(R)等來評估內參基因的穩定性。
2 結果
2.1 引物擴增效率和特異性評價
qRT-PCR結果顯示,各候選內參基因的溶解曲線均為單峰,表明引物具有特異性,且各內參基因的擴增效率均在90%~102%之間,相關系數R2值均高于0.986,表明各候選內參基因引物設計合理,具有良好的擴增效率和特異性,符合熒光定量分析的要求,適用于相應的定量測定(表1)。
2.2 候選內參基因表達水平
基因的表達豐度是內參基因的首要篩選條件。在麥長管蚜兩翅型不同發育階段、不同組織及不同藥劑處理的樣品中,10個候選內參基因的Ct值均在15~30個循環之間(圖1),表明10個內參基因在不同實驗條件下均具有較高的表達量,符合內參基因篩選的條件。
基于Ct值的變化,表明各候選內參基因表達量在不同的條件下都有一定的變化。在有翅蚜不同發育階段和無翅蚜不同發育階段miR-276和miR-1的表達水平均相對較高,其次是miR-10-3p和U6。Ct值變化大小也是內參基因重要篩選條件,變化越小,表明內參基因越穩定(李曉等, 2018)。pc-15和pc-73表達量變化較大,其他基因變化相對較小(圖1: A, B)。在有翅蚜和無翅蚜不同組織中,miR-10-3p, miR-276和miR-1的表達水平相對較高,其次是U6和pc-15,Ct值變異均不大(圖1: C)。在不同藥劑處理無翅蚜中,miR-10-3p和miR-276的表達水平相對較高,其次是miR-1和U6,Ct值變異均不大(圖1: D)。
2.3 候選內參基因在不同發育階段有翅蚜中的表達穩定性
GeNorm分析結果(表2)表明,miR-993, miR-252a, miR-375和miR-276表達較穩定;NormFinder和ΔCt分析表明,miR-276, miR-993和miR-252a表達較穩定;BestKeeper分析結果表明,U6, miR-276和miR-1表達較穩定。RefFinder綜合分析表達穩定性排序為miR-252a, miR-276, miR-993,U6, miR-375, miR-1, miR-10-3p, miR-275, pc-15和pc-73。5種分析方法均表明pc-15和pc-73為最不穩定的內參基因。
GeNorm分析顯示在不同發育階段有翅蚜中,V2/3的配對變異值為0.06,低于0.15(圖2),表明需要2個內參基因。綜合分析,在不同發育階段有翅蚜中,2個穩定表達的內參基因優化組合是miR-252a和miR-276。
2.4 候選內參基因在不同發育階段無翅蚜中的表達穩定性
GeNorm和ΔCt分析結果(表3)表明,miR-993, miR-276和miR-252a為較穩定的內參基因;NormFinder分析結果表明,miR-252a, miR-375和miR-993為較穩定的內參基因;BestKeeper分析結果表明,U6, miR-276和miR-252a為較穩定的內參基因。RefFinder分析結果表明,表達穩定性排序為miR-993, miR-276, miR-252a, miR-10-3p,U6, miR-375, miR-1, miR-275, pc-15和pc-73。5種分析方法均表明pc-15和pc-73為最不穩定的內參基因。
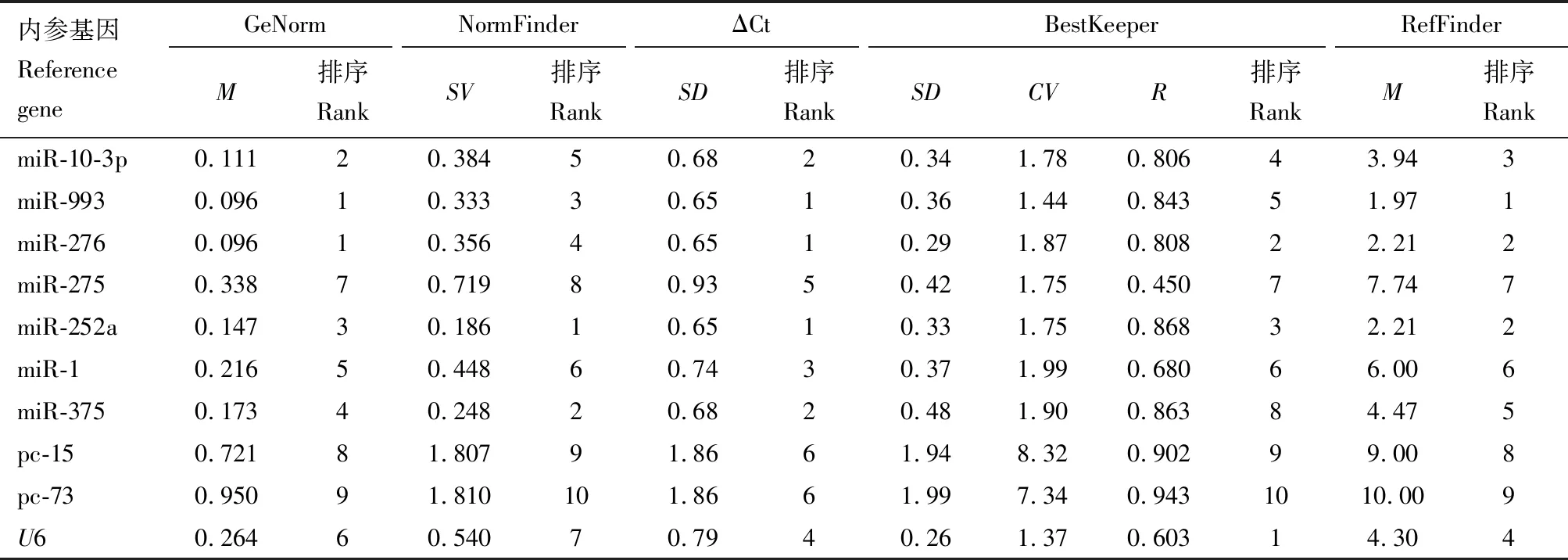
表3 麥長管蚜不同發育階段無翅蚜中miRNA表達分析內參基因表達穩定性分析Table 3 Analysis of expression stability of candidate reference genes for expression analysisof miRNAs in wingless aphids of Sitobion avenae at different developmental stages
GeNorm分析結果顯示在不同發育階段無翅蚜中,V2/3的配對變異值為0.04,低于0.15(圖2),表明需要2個內參基因。綜合分析,在不同發育階段無翅蚜中,2個穩定表達的內參基因優化組合是miR-993和miR-276。
2.5 候選內參基因在有翅蚜和無翅蚜不同組織中的表達穩定性
GeNorm分析結果表明,miR-993和miR-252a為較穩定的內參基因;NormFinder和ΔCt分析結果表明,miR-275和miR-10-3p為較穩定的內參基因;BestKeeper分析結果表明,U6和pc-15為較穩定的內參基因。RefFinder分析結果表明,表達穩定性排序為miR-275, miR-10-3p, miR-252a, miR-375, miR-993, pc-73, miR-276, pc-15, miR-1和U6。除了BestKeeper以外,其他表達穩定性分析均表明U6為最不穩定的內參基因(表4)。
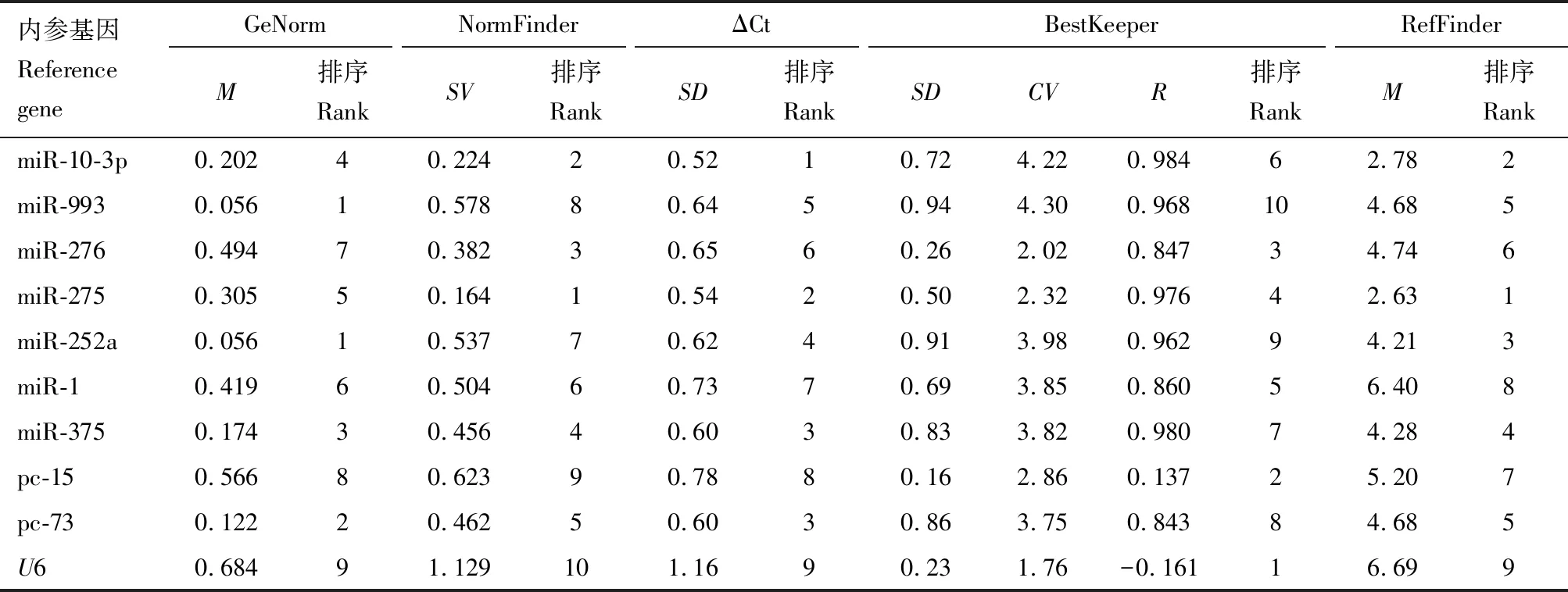
表4 麥長管蚜有翅蚜和無翅蚜不同組織中miRNA表達分析內參基因表達穩定性分析Table 4 Analysis of expression stability of candidate reference genes for expression analysisof miRNAs in different tissues of winged and wingless aphids of Sitobion avenae
GeNorm分析結果表明,V2/3的配對變異值為0.06,低于0.15(圖2),表明需要2個內參基因。綜合分析,在不同組織中2個穩定表達的內參基因優化組合是miR-275和miR-10-3p。
2.6 候選內參基因在4種藥劑處理無翅蚜中的表達穩定性
GeNorm, NormFinder和ΔCt分析結果表明,miR-10-3p和miR-993為較穩定的內參基因,且最不穩定的為pc-15;BestKeeper分析結果表明,miR-1和pc-73為較穩定的內參基因,最不穩定的為U6。RefFinder分析結果表明,表達穩定性排序為miR-993, miR-10-3p, miR-1, miR-275, miR-375, pc-73, miR-276, miR-252a, pc-15和U6(表5)。
GeNorm分析顯示,V2/3的配對變異值為0.06,低于0.15(圖2),表明需要2個內參基因。綜合分析,在不同藥劑處理無翅蚜中,2個穩定表達的內參基因優化組合是miR-993和miR-10-3p。

圖2 麥長管蚜不同條件下最適miRNA表達分析內參基因數目Fig. 2 Optimal number of reference genes for expression analysis of miRNAs in Sitobion avenaeanalyzed under different conditions
3 討論
候選內參基因的穩定性評價常采用多個方法依據相關參數進行綜合分析,并根據候選內參基因的穩定性高低進行排序。本研究首先使用4個方法(GeNorm, NormFinder, ΔCt和BestKeeper)進行獨立排序,在不同的實驗條件下最穩定的內參基因是miR-252a, miR-275和miR-993,但這3個基因的穩定性排序并不完全一致,在其他昆蟲內參基因篩選中也存在類似情況(Wangetal., 2017; Yangetal., 2017; Dongetal., 2019; Zhangetal., 2019),這可能與4種方法的計算方法及評價指標不同有關(Vandesompeleetal., 2002; Andersenetal., 2004; Pfaffietal., 2004; Silveretal., 2006)。BestKeeper是根據每個基因之間產生配對的相關系數、標準差和變異系數共同判斷,從而對候選內參基因穩定性進行排名,而其他方法計算原理類似,是對每一個獨立的內參基因進行分析,所以BestKeeper的分析結果與其他方法的研究結果排序差異較大(Pfaffletal., 2004; Tengetal., 2012),與本研究結果也相符。如在麥長管蚜不同藥劑處理下,GeNorm, NormFinder, ΔCt和RefFinder分析均顯示miR-10-3p和miR-993為最穩定的基因,而BestKeeper分析顯示miR-1和pc-73為最穩定的內參基因(表5)。在棉鈴蟲miRNA表達分析內參基因篩選中也發現BestKeeper與其他方法分析的內參基因的穩定性排序差異較大(Yangetal., 2017)。
一直以來,U6和5S rRNA作為miRNA表達分析傳統的內參基因,常被用來評估miRNA目的基因的表達(Lin and Lai, 2013; Hanetal., 2014; Gharbietal., 2015),但已有越來越多的研究證實篩選出的新的miRNA表達分析內參基因比傳統的內參基因更穩定(Turneretal., 2013; 封冰等, 2014; Dongetal., 2019; Zhangetal., 2019)。本研究也發現,麥長管蚜不同實驗條件下,除BestKeeper以外,其他幾種分析方法均顯示傳統U6的穩定性比較差。以上結果表明,傳統的內參基因并不適合作為miRNA定量表達的通用內參基因,不同實驗材料在不同條件下選用的內參基因均不相同。我們應根據具體實驗材料和處理條件篩選合適的內參基因,才能獲得更準確的定量結果。
很多研究證實,使用2個或2個以上的內參基因利用其幾何平均值校正目的基因的表達結果,有利于降低實驗數據的誤差(Shakeeletal., 2017; 楊苓等, 2017; 賈冰等, 2019)。利用GeNorm軟件計算配對變異值V,確定最優內參基因數目。 當Vn/n+1值小于0.15時,說明內參基因的最佳數目為n。通過GeNorm分析顯示,麥長管蚜在4種不同條件下V2/3的值均小于0.15,說明在4種不同條件下最佳內參基因的數目均為2(圖2)。因此,在做麥長管蚜miRNA基因定量表達的研究中,最好使用2個內參基因進行校正。再進一步通過在線程序RefFinder對候選內參基因的表達穩定性進行綜合排名,最終確定內參基因的最優選擇,從而避免單個軟件分析的片面性(Xieetal., 2012)。通過綜合分析顯示,麥長管蚜在不同條件下使用的內參基因組合不同,如不同發育階段有翅蚜中最優內參基因組合是miR-252a和miR-276(表2; 圖2),不同發育階段無翅蚜中最優內參基因組合是miR-993和miR-276(表3; 圖2),有翅蚜和無翅蚜不同組織中最優內參基因組合是miR-275和miR-10-3p(表4; 圖2),不同藥劑處理下的最優內參組合是miR-993和miR-10-3p(表5; 圖2)。此外,不同昆蟲在不同條件下選用的內參基因組合及數目均不盡相同,即使在相同實驗條件下需要的內參基因也存在較大差異(Wangetal., 2017; Yangetal., 2017; Dongetal., 2019)。因此,在做miRNA定量表達分析中,需要在不同昆蟲特定條件下篩選特有的內參基因,才能保證實驗結果的準確性。
總之,絕對穩定的miRNA表達分析內參基因并不存在。miRNA的表達穩定性隨物種而異,同時也會受實驗處理方法和條件的影響。本研究篩選出了適合麥長管蚜不同發育階段、不同組織和不同藥劑處理下穩定表達的miRNA表達分析內參基因及最優組合,為后期應用qRT-PCR技術開展其miRNA基因的表達及功能分析中內參基因的選擇提供了依據,也可為其他昆蟲內參基因篩選提供一定參考。

