豌豆蚜翅分化相關(guān)miRNA及其預(yù)測靶基因?qū)ν懫ぜに氐膽?yīng)答及miR-92a-1-p5靶基因的驗證
馬田田, 楊宗霖, 常美玲, 霍春月, 闞云超, 李丹丹
(南陽師范學院, 河南省伏牛山昆蟲生物學重點實驗室, 河南南陽 473061)
蚜蟲是農(nóng)林植物常見害蟲類群之一,在世界各地廣泛分布(Blackman and Eastop, 2000)。蚜蟲具復(fù)雜生活周期,在春季和夏季以卵胎生方式孤雌生殖,秋季隨著光周期變化和溫度下降,群體中出現(xiàn)兩性生殖個體,其交配產(chǎn)卵后以卵形式越冬,至第二年春季孵化,繼續(xù)營孤雌生殖(Margaritopoulos and Tsitsipis, 2002; Braendleetal., 2006)。孤雌蚜在發(fā)育過程中具翅多型性,包括非遺傳多型性和遺傳多型性(Roff, 1986)。翅多型性是蚜蟲適應(yīng)環(huán)境變化的結(jié)果,在某個發(fā)育階段環(huán)境中出現(xiàn)的敏感因素可造成翅原基的形成。如增加蚜蟲密度或降低營養(yǎng)供應(yīng),會造成孤雌生殖后代出現(xiàn)更多的有翅個體(Lees, 1967; Muller, 2001; Ishikawaetal., 2012)。其他環(huán)境因素,如種間競爭及激素也會對蚜蟲的翅型分化產(chǎn)生影響(Ishikawaetal., 2013),由回避捕食者效應(yīng)觸發(fā)的觸覺刺激增加也會誘導(dǎo)更多有翅后代的產(chǎn)生(Kunert and Weisser, 2005)。而共生取食者螞蟻(取食蚜蟲蜜露)增加則會抑制有翅個體的產(chǎn)生(Kleinjan and Mittler, 1975; Pringleetal., 2014)。最近研究表明,Wnt2,Fng,Uba1,Hh,Foxo,Dpp,Brk,Ap,Dll,Hth,Tsh,Nub,Scr,Antp,Ubx,Asc,Srf和F1等基因在禾谷縊管蚜Rhopalosiphumpadi的翅多態(tài)性分化中發(fā)揮重要調(diào)控作用(Zhang RJetal., 2019)。同時,研究表明miRNA在蚜蟲的翅二型性分化中也發(fā)揮重要作用,通過RNA-Seq在麥長管蚜Sitobionavenae中鑒定出345個miRNA,其中16個miRNA在有翅孤雌個體中的表達顯著上調(diào),而12個miRNA在無翅孤雌個體中積累更多;差異表達的miRNA靶基因可歸結(jié)在124種代謝通路上,包括Wnt, Notch, Hedgehog和TGF-beta信號途徑等(Lietal., 2016)。同時,Vellichirammal等(2017)發(fā)現(xiàn)在母代注射蛻皮激素或其類似物會導(dǎo)致后代有翅比例下降,表明蛻皮激素在蚜蟲翅型分化中也發(fā)揮重要作用。但是蛻皮激素是否影響miRNA表達,是否通過miRNA參與蚜蟲翅型分化目前還不清楚。
因此,為進一步探索蛻皮激素及miRNA在豌豆蚜Acyrthosiphonpisum翅型分化中是否存在互作,我們選擇在前期工作中發(fā)現(xiàn)的5個參與孤雌生殖豌豆蚜翅型分化的關(guān)鍵miRNA,使用蛻皮激素類似物20-羥基蛻皮酮(20E)處理其若蟲,研究蛻皮激素對miRNA及其靶基因表達的影響。同時通過熒光素酶活性實驗及個體RNA干涉實驗,對miRNA及靶基因的互作情況進行深入探索,為從蛻皮激素與miRNA互作角度探索孤雌蚜翅型分化的分子機制,為蚜蟲綜合防治提供理論依據(jù)。
1 材料與方法
1.1 試蟲
所用豌豆蚜由中國科學院動物研究所崔峰研究員惠贈。孤雌生殖豌豆蚜培養(yǎng)方式參照楊宗霖等(2019)的方法:將蠶豆種子置于25℃浸泡12 h;將東北黑土與蛭石以1∶2(v/v)混合后播種,在溫度28℃,相對濕度60%,光周期14L∶10D,光照強度15 000 lx條件下培養(yǎng)。待蠶豆展開兩片真葉時移入塑料杯(直徑8 cm,高14 cm)中,用毛筆挑取豌豆蚜1齡若蚜5頭置于恒溫氣候培養(yǎng)箱(溫度20℃,相對濕度60%,光周期16L∶8D,光照強度15 000 lx)中培養(yǎng),低密度連續(xù)篩選兩代至后代均為孤雌無翅蚜后用于實驗。
1.2 蛻皮激素處理
將25頭孤雌生殖豌豆蚜2齡若蟲分別浸入0.1 mol/L 20E和4.5%的乙醇(20E溶劑,用作陰性對照)中10 min和30 min,然后轉(zhuǎn)移至種植有蠶豆苗的塑料杯(直徑8 cm,高度為14 cm)中培養(yǎng)48 h(對照與處理從發(fā)育階段上無顯著差異),收集蚜蟲整蟲在液氮中迅速冷凍,并在-80℃下保存,TRIzol法提取總RNA。
1.3 qPCR檢測miRNA及靶基因的表達譜
選擇在前期工作中發(fā)現(xiàn)的5個參與孤雌生殖豌豆蚜翅型分化的關(guān)鍵miRNA(Let-7, miR-92a, miR-92b, miR-92a-1-p5和miR-277),使用miRanda (Enrightetal., 2003)和RNAhybrid (Rehmsmeieretal., 2004)軟件預(yù)測這些miRNA的靶基因分別為abrupt,wingless,Foxo,flightin和Uba1(楊宗霖等, 2019)。miRNA及靶基因表達譜檢測同楊宗霖等(2019)方法:分別取1.2節(jié)提取的各樣品總RNA 2 μg,使用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa)和All-in-OneTMmiRNA qRT-PCR Detection Kit(GeneCopoeia)合成cDNA第1鏈。內(nèi)參基因為actin。靶基因PCR反應(yīng)體系(10 μL): cDNA 0.5 μL, 上下游引物終濃度為0.5 μmol/L, FastStart Universal SYBR Green Mix (Roche) 5 μL。PCR反應(yīng)條件: 95℃變性30 s, 55℃退火30 s, 72℃延伸30 s, 40個循環(huán)。miRNA PCR反應(yīng)體系(10 μL): 5倍稀釋的cDNA 1 μL, miRNA上游特異引物終濃度0.5 μmol/L, 下游引物為試劑盒通用引物Universal Adaptor PCR Primer終濃度0.5 μmol/L, 2×All in one qPCR Mix 5 μL。PCR反應(yīng)條件: 95℃變性10 s, 55℃退火20 s, 72℃延伸30 s, 40個循環(huán)。內(nèi)參基因為U6。所用引物見表1。qPCR實驗設(shè)置生物學重復(fù)3次,每樣品技術(shù)重復(fù)3次。
1.4 miR-92a-1-p5靶基因flightin的體外驗證
1.4.1靶基因熒光素酶報告基因載體構(gòu)建:以楊宗霖等(2019)有翅豌豆蚜4齡若蟲RNA為模板,使用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa)合成cDNA第1鏈,使用表1引物擴增flightin基因CDS 593 bp序列。 PCR反應(yīng)體系(20 μL): cDNA 1 μL, 上下游引物終濃度為0.5 μmol/L,Premix Ex TaqTMHot Start Version (TaKaRa) 10 μL。PCR反應(yīng)條件: 95℃變性30 s; 55℃退火30 s, 72℃延伸1 min, 30個循環(huán)。使用瓊脂糖凝膠DNA回收試劑盒(Axygen)回收目的條帶, 連接pMD19-T Simple載體(TaKaRa)。轉(zhuǎn)化后,菌液PCR檢測連接效果,送菌液至蘇州泓迅生物科技股份有限公司測序。測序正確的菌液提質(zhì)粒,用XhoⅠ和XbaⅠ雙酶切后連接在pmirGLO雙熒光素酶報告基因載體(Promega)上。經(jīng)轉(zhuǎn)化、菌液PCR檢測、測序等步驟確定載體是否構(gòu)建成功。測序正確的菌液重新?lián)u菌,用去內(nèi)毒素質(zhì)粒提取試劑盒(Omega)提取質(zhì)粒。
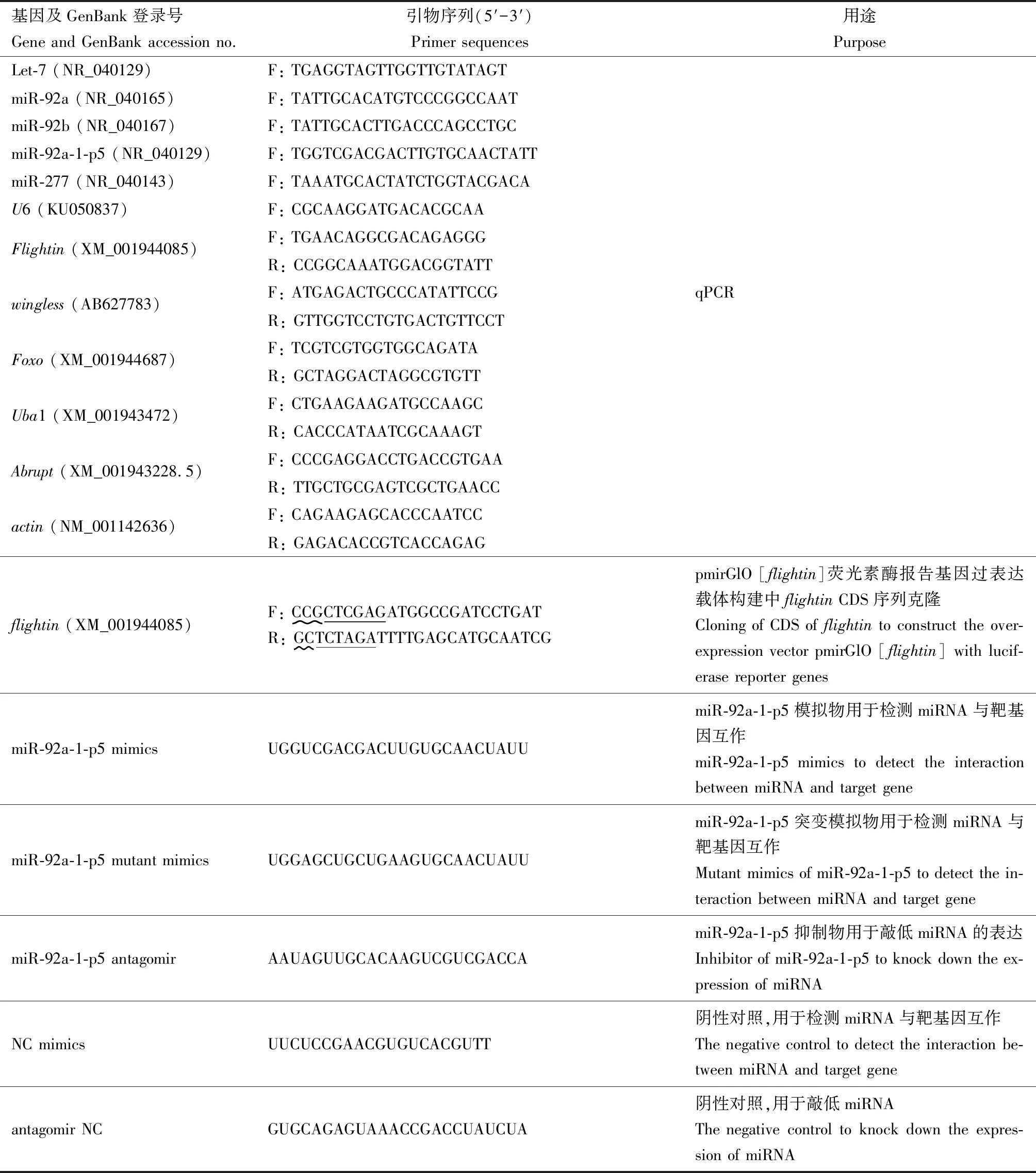
表1 引物信息Table 1 Primers used in this study
1.4.2miRNA mimics合成:依據(jù)miR-92a-1-p5成熟miRNA序列,由上海吉瑪制藥技術(shù)有限公司合成miR-92a-1-p5模擬物(miR-92a-1-p5 mimics)、陰性對照(NC mimics)和miR-92a-1-p5突變模擬物(miR-92a-1-p5 mutant mimics)(引物序列見表1)。
1.4.3細胞轉(zhuǎn)染及熒光素酶活性測定:HEK293T細胞(楊宗霖等, 2019)在含有10%胎牛血清(Gibco)的DMEM培養(yǎng)基(Biological Industry)中25 cm2培養(yǎng)瓶傳代培養(yǎng),溫度37℃,CO2濃度5%。按每孔2×105個細胞鋪24孔板,使用X-tremeGENE siRNA Transfection Reagent(Roche)轉(zhuǎn)染miRNA mimics和靶基因熒光素酶報告基因載體。miRNA mimics轉(zhuǎn)染濃度為100 nm/孔,質(zhì)粒轉(zhuǎn)染濃度為100 ng/孔。實驗設(shè)置3組:共轉(zhuǎn)染pmirGLO[flightin]與NC mimics;共轉(zhuǎn)染pmirGLO[flightin]與miR-92a-1-p5 mimics;共轉(zhuǎn)染pmirGLO[flightin]與miR-92a-1-p5 mutant mimics。每組設(shè)樣品重復(fù)3個,實驗重復(fù)3次。轉(zhuǎn)染48 h后,用細胞裂解液裂解細胞,取20 μL細胞裂解液,按照雙熒光素酶報告基因檢測試劑盒(Promega)步驟,檢測樣品熒光值。靶基因位于Firefly熒光素酶基因下游,因此用獲得的Firefly熒光素酶活性(F)/內(nèi)參Renilla熒光素酶活性(R),獲得每組3個樣品及3個重復(fù)的R/F值,均一化后用Excel軟件進行作圖(楊宗霖等, 2019)。
1.5 miR-92a-1-p5靶基因flightin的體內(nèi)驗證
1.5.1miR-92a-1-p5 antagomir合成:依據(jù)miR-92a-1-p5成熟miRNA序列,由上海吉瑪制藥技術(shù)有限公司合成miR-92a-1-p5 antagomir(引物序列見表1)。
1.5.2納米載體/miR-92a-1-p5 antagomir/變性劑復(fù)合物的制備: Zheng等(2019)和Yan等(2021)開發(fā)的納米載體/變性劑復(fù)合物可以滲透蚜蟲體壁,使編碼基因在蚜蟲個體中實現(xiàn)很好的RNA干涉效果。因此,使用該方法在蚜蟲個體中嘗試miRNA干涉效果。將miR-92a-1-p5的antagomir與納米載體以1∶1體積比混合,加入0.1%體積的變性劑,將混合物在室溫放置15 min,形成納米載體/miR-92a-1-p5 antagomir/變性劑復(fù)合物。使用相同量的antagomir NC(上海吉瑪制藥技術(shù)有限公司設(shè)計合成)作為陰性對照。
1.5.3納米載體/miR-92a-1-p5 antagomir/變性劑復(fù)合物在蚜蟲個體中的使用: 選擇孤雌生殖豌豆蚜4齡若蟲,將50 nL納米載體/miR-92a-1-p5 antagomir/變性劑復(fù)合物通過微量注射器點在蚜蟲背板上,將蚜蟲分開放置,直到液滴完全吸收為止。將蚜蟲轉(zhuǎn)移至種植有蠶豆苗的塑料杯中,1.1節(jié)條件下正常培養(yǎng)48 h,收集整蟲液氮快速冷凍,TRIzol試劑提取RNA,使用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa)合成cDNA第1鏈,qPCR檢測蚜蟲個體中miRNA干涉效果和靶基因表達量變化,反應(yīng)體系及條件同1.3節(jié)。
1.6 數(shù)據(jù)分析
數(shù)據(jù)分析同楊宗霖等(2019)方法。PCR結(jié)果采用2-△△Ct法計算相對表達量高低(Ct為循環(huán)閾值,表示每一個反應(yīng)管內(nèi)的熒光信號到達設(shè)定的閾值時所經(jīng)歷的循環(huán)數(shù),△Ct=目的基因的平均Ct值-內(nèi)參基因的平均Ct值,△△Ct=△Ct樣本1-△Ct樣本2(樣本1為處理樣本,樣本2為對照樣本)。實驗獨立生物學重復(fù)3次,每樣品測定技術(shù)重復(fù)3次,數(shù)據(jù)為3次獨立生物學實驗平均值分析結(jié)果。數(shù)據(jù)采用SPSS Statistics 22.0軟件進行處理,以平均值±標準誤表示,并采用單因素方差分析和t檢驗進行檢測不同處理間的差異顯著性。
2 結(jié)果
2.1 miRNA對20E處理的表達響應(yīng)
qPCR檢測結(jié)果表明,20E處理30 min可極顯著誘導(dǎo)5個miRNA的表達(P<0.01) (圖1)。其中20E處理10 min和30 min后蚜蟲中Let-7和miR-277表達量均極顯著上升(P<0.01) (圖1: A, C)。但處理10 min情況下,miR-92a-1-p5和miR-92b表達量較對照極顯著下降(P<0.01) (圖1: D, E),僅在處理30 min樣品中有極顯著上升(P<0.01) (圖1: D, E),表明不同miRNA響應(yīng)蛻皮激素的時間點也存在差別。
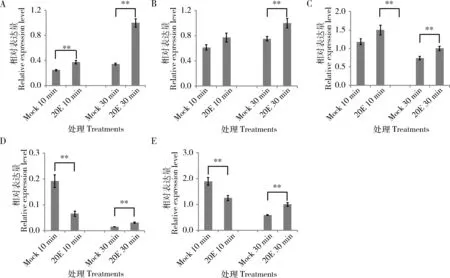
圖1 qPCR檢測5個miRNA在0.1 mol/L 20E處理后的孤雌生殖豌豆蚜2齡若蟲中的表達譜Fig. 1 Expression profiles of five miRNAs in the 2nd instar nymphs of the parthenogeneticAcyrthosiphon pisum after exposed to 0.1 mol/L 20E detected by qPCRA: Let-7; B: miR-92a; C: miR-277; D: miR-92a-1-p5; E: miR-92b. Mock: 陰性對照(4.5%的乙醇)Negative control (4.5% ethyl alcohol); 20E: 20E處理20E treatment. 以U6作內(nèi)參基因。圖中數(shù)據(jù)為平均值±標準誤;柱上雙星號表示處理與對照間差異極顯著(P<0.01, 單因素方差分析, 雙尾配對t檢驗)。U6 was used as the reference gene. Data in the figure are mean±SE. Double asterisk above bars represents statistically extremely significant difference (P<0.01, one-way ANOVA, two-tailed, paired t-test) between the treatment and the control. 下同The same below.
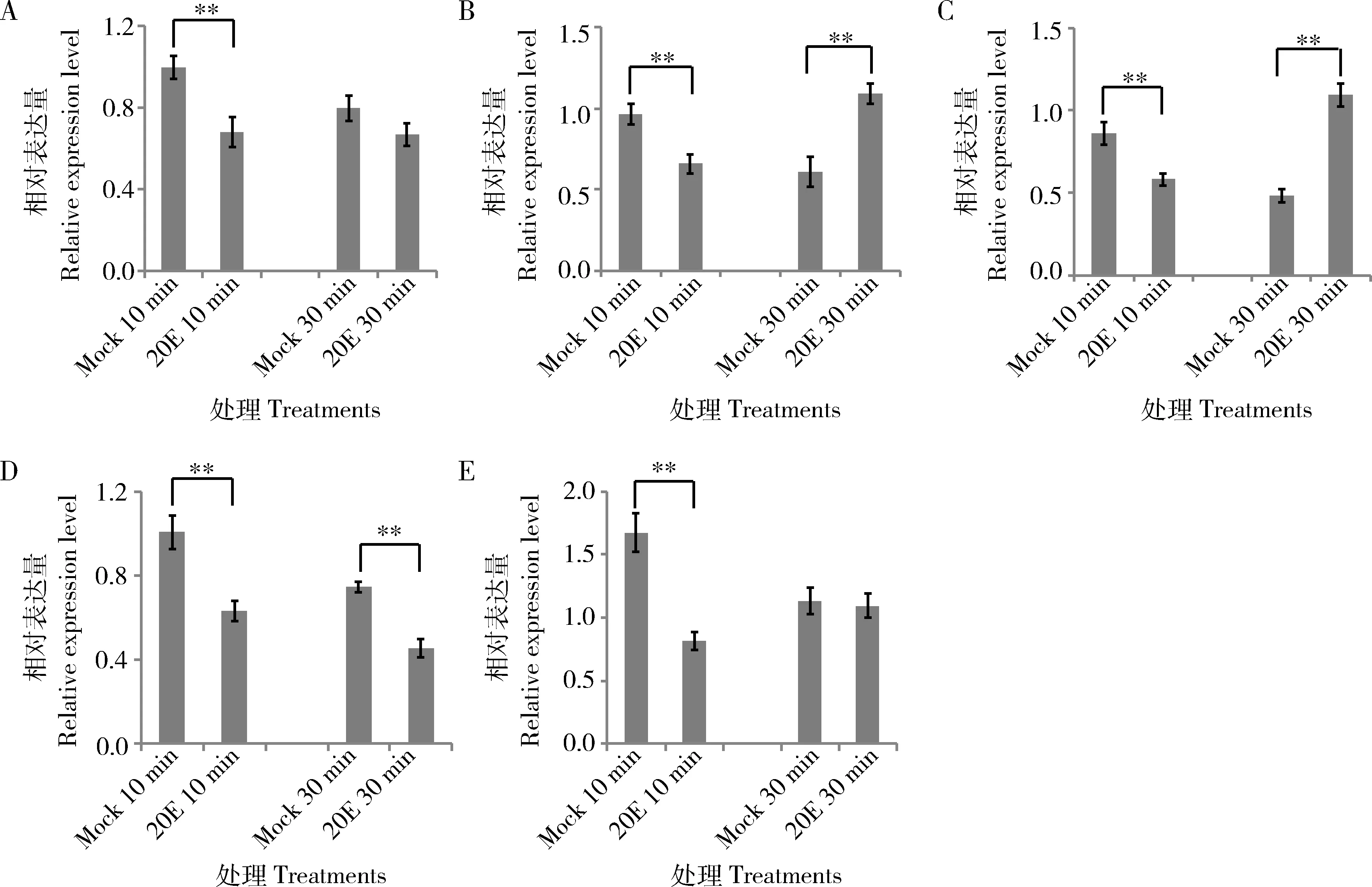
圖2 qPCR檢測miRNA靶基因在0.1 mol/L 20E處理后的孤雌生殖豌豆蚜2齡若蟲中的表達譜Fig. 2 Expression profiles of miRNA target genes in the 2nd instar nymphs of the parthenogeneticAcyrthosiphon pisum after exposed to 0.1 mol/L 20E detected by qPCRA: abrupt; B: wingless; C: Uba1; D: flightin; E: Foxo. 以actin作內(nèi)參基因。actin was used as the reference gene.
2.2 miRNA預(yù)測靶基因?qū)?0E的表達響應(yīng)
qPCR檢測結(jié)果表明,在20E處理后,Let-7的預(yù)測靶基因abrupt在不同處理時間下表達量均降低,與Let-7呈相反的表達模式(圖2: A)。wingless和Uba1在20E處理10 min時表達量極顯著下降(P<0.01),與miR-92a和miR-277表達趨勢(圖1: B, C)相反,而在30 min處理下miRNA與靶基因表達趨勢一致,均被20E極顯著誘導(dǎo)(P<0.01) (圖2: B, C)。miR-92a-1-p5的預(yù)測靶基因flightin在20E處理30 min后表達量極顯著下降(P<0.01),與miRNA表達趨勢相反,而在10 min處理情況下二者均下降(圖2: D)。miR-92b與預(yù)測靶基因Foxo在20E誘導(dǎo)后并不存在表達模式上的明顯相關(guān)性(圖2: E)。表明不同的miRNA與預(yù)測的靶基因在不同的處理時間點并不具有完全相反的表達趨勢。
2.3 miR-92a-1-p5與靶基因flightin互作的體外驗證
蚜蟲翅的發(fā)生關(guān)鍵是飛行肌的產(chǎn)生,為了進一步驗證flightin基因與miR-92a-1-p5是否存在互作,我們利用雙熒光素酶報告基因系統(tǒng)檢測miRNA與預(yù)測的靶基因之間的互作關(guān)系。首先構(gòu)建靶基因flightinCDS區(qū)熒光素酶報告基因載體pmirGlO [flightin],flightinCDS擴增結(jié)果如圖3(A)所示,PCR產(chǎn)物電泳條帶單一,593 bp位置正確。pmirGlO [flightin]雙酶切結(jié)果如圖3(B),能夠酶切出正確的flightinCDS條帶,測序結(jié)果正確。共轉(zhuǎn)染miR-92a-1-p5模擬物和flightinCDS過表達載體pmirGlO [flightin]后,細胞熒光素酶活性比共轉(zhuǎn)染miR-92a-1-p5突變模擬物和pmirGlO [flightin]細胞的下降了32%,與轉(zhuǎn)染對照NC mimics相比下降40%,達極顯著水平(P<0.01) (圖3: C),表明miR-92a-1-p5對flightin基因的轉(zhuǎn)錄存在調(diào)控。
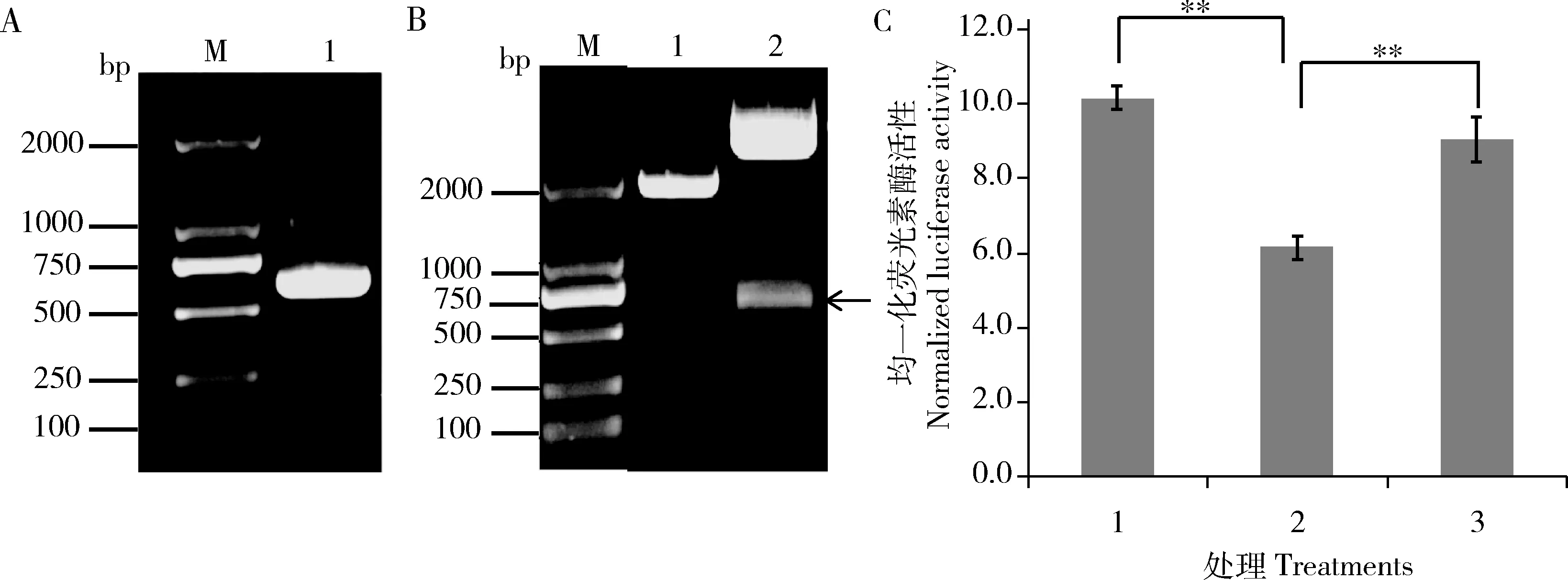
圖3 熒光素酶活性試驗檢測miR-92a-1-p5與靶基因flightin互作Fig. 3 Verification of target gene flightin of miRNA miR-92a-1-p5 by luciferase activity analysisA: flightin CDS擴增結(jié)果Amplification of flightin CDS. M: DL2000 marker; 1: flightin CDS擴增產(chǎn)物Amplification product of flightin CDS. B: 載體pmirGlO [flightin]雙酶切鑒定Double digestion result of the vector pmirGlO[flightin]. 1: pmirGlO雙酶切產(chǎn)物Double digestion product of pmirGlO; 2: pmirGlO [flightin]雙酶切產(chǎn)物Double digestion product of pmirGlO [flightin]. 箭頭示酶切獲得的flightin CDS 593 bp序列。Arrow shows the digested 593 bp sequence of flightin CDS. C: HEK293細胞系中熒光素酶活性試驗檢測miR-92a-1-p5的靶基因flightin (Verification of target gene flightin of miRNA miR-92a-1-p5 by luciferase activity analysis in HEK293 cells). 1: pmirGlO [flightin]+NC mimics; 2: pmirGlO [flightin]+miR-92a-1-p5 mimics; 3: pmirGlO [flightin]+miR-92a-1-p5 mutant mimics.
2.4 miR-92a-1-p5靶基因flightin的體內(nèi)驗證
miR-92a-1-p5 qPCR檢測結(jié)果表明,納米載體/miR-92a-1-p5 antagomir/變性劑復(fù)合物滲透豌豆蚜4齡若蚜后,miR-92a-1-p5的表達水平受到極顯著抑制(P<0.01),表達量下降了83%(圖4: A);而flightin的表達量卻增加了48%(P<0.01) (圖4: B),與miR-92a-1-p5呈現(xiàn)相反的表達模式。結(jié)果進一步證明了miR-92a-1-p5對flightin基因的轉(zhuǎn)錄存在調(diào)控,flightin是miR-92a-1-p5的靶標。
3 討論
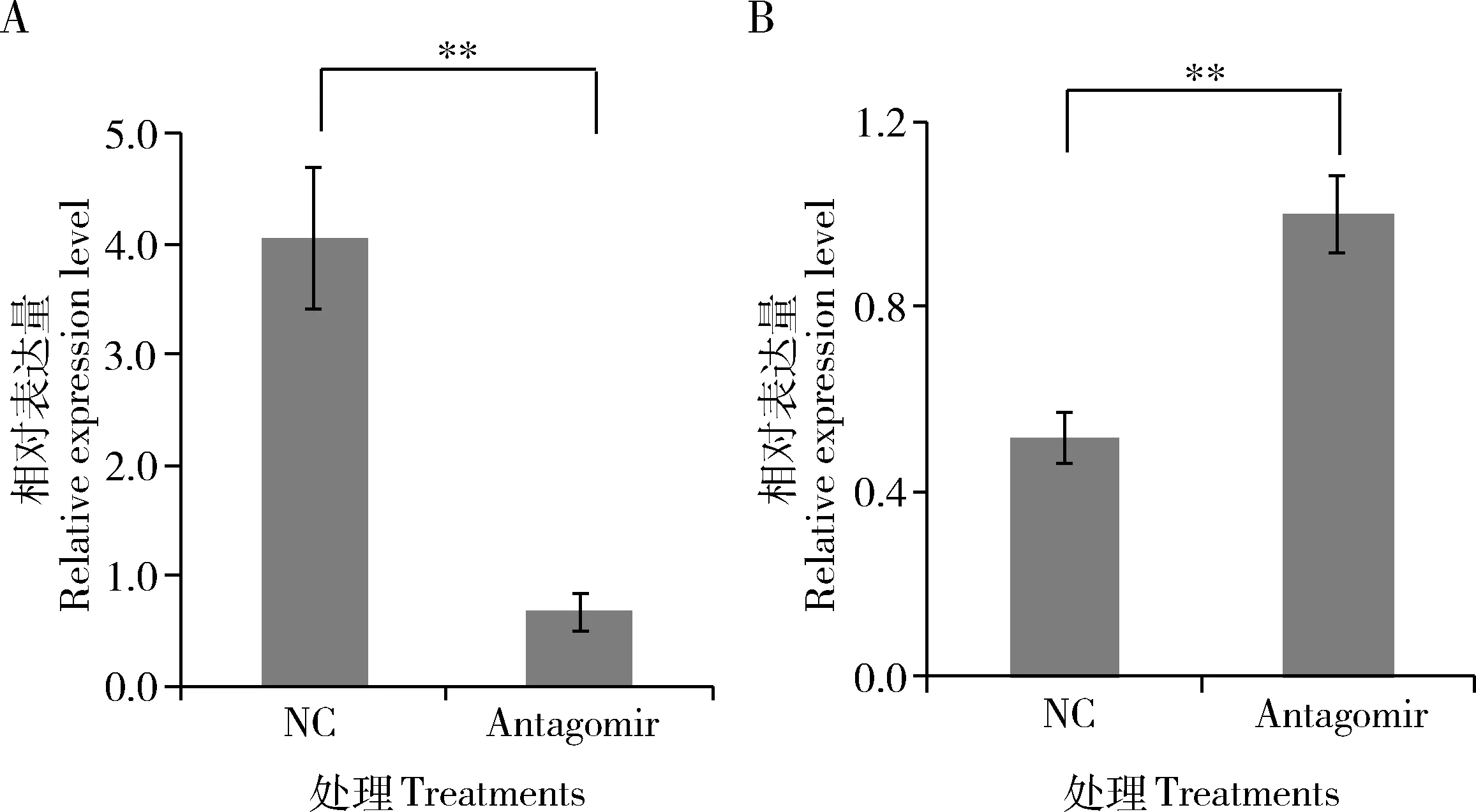
圖4 孤雌生殖豌豆蚜4齡若蟲中敲低miR-92a-1-p5后miR-92a-1-p5 (A)與flightin (B)的表達量變化Fig. 4 Changes in the expression levels of miR-92a-1-p5 (A) and flightin (B) after knocking down miR-92a-1-p5in the 4th instar nymphs of parthenogenetic Acyrthosiphon pisumNC: 陰性對照Negative control (antagomir NC); Antagomir: miR-92a-1-p5抑制物Inhibitor of miR-92a-1-p5.
昆蟲的翅多態(tài)性是理解自然群體中擴散的適應(yīng)性最有吸引力的模型,有翅個體具有完整的翅和飛行肌,可以長距離遷移以適應(yīng)惡劣環(huán)境并尋找新的棲息地,但無翅個體則缺乏翅和飛行肌,并在相對受限的區(qū)域生存(Briceno and Eberhard, 1987; Ogawa and Miura, 2013; Zhang CXetal., 2019)。從環(huán)境因素來講,飼養(yǎng)密度,寄主植物營養(yǎng)狀況,溫度和光周期等環(huán)境因素觸發(fā)了蚜蟲翅型的轉(zhuǎn)換(White, 1946; Kunert and Weisser, 2003; Kunert and Weisser, 2005; Brisson, 2010; Castanedaetal., 2010; Zhangetal., 2015)。從分子水平上,蛻皮激素、胰島素信號通路及miRNA等在蚜蟲翅多型性演化中都發(fā)揮了至關(guān)重要的作用(Guoetal., 2016; Lietal., 2016; Vellichirammaletal., 2017; Zhang CXetal., 2019; Zhang RJetal., 2019)。蛻皮激素是一類具有昆蟲蛻皮活性的天然類固醇,孤雌蚜母代注射蛻皮激素或其類似物會導(dǎo)致其所產(chǎn)有翅后代比例降低(Vellichirammaletal., 2017)。但是蛻皮激素如何在孤雌蚜翅型分化中發(fā)揮作用目前還不清楚。在這里,我們發(fā)現(xiàn)蛻皮激素類似物20E可以誘導(dǎo)Let-7, miR-92a, miR-277, miR-92a-1-p5和miR-92b的表達,可抑制飛行肌基因flightin的表達。同時miR-92a-1-p5可調(diào)控flightin基因的轉(zhuǎn)錄,表明flightin為miR-92a-1-p5的真實靶標。由于蚜蟲對農(nóng)作物的主要損害是由于有翅孤雌蚜的遷徙,因此了解孤雌蚜的翅分化調(diào)控機制將為蚜蟲防治提供新的線索,而miR-92a-1-p5與flightin之間的互作也為孤雌蚜的防治提供了新的農(nóng)藥靶點。
在昆蟲個體中抑制基因表達可采用直接注射或飼喂雙鏈RNA的方法進行,個體直接注射法在黑腹果蠅Drosophilamelanogaster(Kennerdell and Carthew, 1998)、家蠶Bombyxmori(Lietal., 2015; Zhouetal., 2017)和桃蚜Myzuspersicae(Cheng and Li, 2018)等很多物種中都成功實現(xiàn)。但蚜蟲個體小、體壁薄,采用顯微注射法死亡率較高。Cao等(2018)和Pitino等(2011)用飼喂法也在蚜蟲中實現(xiàn)了部分基因的RNA干涉,但操作步驟繁瑣,效率有限。最近Zheng等(2019)和Yan等(2021)用納米載體/變性劑在大豆蚜Aphisglycines中導(dǎo)入dsRNA實現(xiàn)了編碼基因的RNA干涉,干涉效率可達到95%以上,取得了較好的效果,但是該方法未在非編碼基因上進行嘗試。在本研究中我們利用納米載體/變性劑在豌豆孤雌蚜中成功導(dǎo)入了miRNA miR-92a-1-p5抑制物,干涉效率達83%,表明該法不僅適用于編碼基因,對非編碼基因同樣可以實現(xiàn)較好的干涉效果。

