環扎法致大鼠脊髓損傷減壓后TGF-β1表達與凋亡細胞的相關性
聶 虎,周乾坤,牛國旗,楊 民,徐祝軍
(1 蚌埠醫學院第二附屬醫院骨科,蚌埠 233000;2 皖南醫學院弋磯山醫院骨科;*通訊作者,E-mail:151810084@qq.com)
在美國,每年有超過17 000人遭受脊髓損傷(spinal cord injury,SCI),該疾病會導致損傷平面以下的突然運動、感覺及自主神經損傷,如何有效地促進SCI患者神經功能的恢復是當前基礎及臨床研究的熱點[1]。既往觀點認為,神經細胞不可再生,但是現有動物實驗研究表明:在脊髓損傷早期對脊柱創傷行手術固定、脊髓減壓等消除脊柱不穩定和椎管狹窄等因素,再在此基礎上行適當的藥物治療、細胞移植、基因治療、調節信號轉導通路等有希望進一步促進自主神經功能的修復和神經細胞的再生[2-4]。
國外學者回顧性研究發現[5,6],轉化生長因子-β1(transforming growth factor-β1, TGF-β1)在正常脊髓組織中幾乎無明顯表達,但在SCI后表達顯著增高,因其具有免疫抑制和炎癥抑制的作用,可抑制細胞凋亡進展,以減輕神經損傷的范圍,可見脊髓損傷后該因子增加是神經元的一種自我保護反應。
本研究擬建立一種可形成持續靜態壓迫的大鼠脊髓損傷模型,通過不同時間點的脊髓減壓治療,來觀察脊髓損傷的變化以及神經功能恢復進展情況,進一步研究TGF-β1的表達與凋亡細胞陽性細胞數的相關性,為SCI的修復研究提供實驗依據。
1 材料與方法
1.1 實驗動物與分組
70只雄性SD(Sprague-Dauley)大鼠,平均13周齡,體質量169-261 g,平均體質量221.2 g。采用隨機數字表法分組,分為假手術組10只,僅行胸椎(thoracic vertebra,T)10-11椎板切除,暴露脊髓,不進行環扎。手術組每組各15只,大鼠胸10-11椎板切除后,環扎脊髓,用環扎法使硬膜囊截面壓縮至原截面積的70%,建立脊髓損傷模型,完成此次建模手術,術后按照時間設定進行去除環扎線的二次手術分為8 h減壓組、24 h減壓組、72 h減壓組和不減壓組。減壓組分別環扎8,24,72 h后二次手術,去除環扎線減壓;不減壓組環扎后不進行二次手術減壓。假手術組和不減壓組只進行一次手術,在術后1,3,7,14,21 d統計神經功能評分并處死大鼠取出脊髓。8 h減壓組、24 h減壓組和72 h減壓組進行二次手術后后1,3,7,14,21 d統計神經功能評分并處死大鼠,取出脊髓。假手術組各時間段取材2只大鼠,余各手術組各時間段取材3只大鼠,取損傷段脊髓標本切片進行HE染色,免疫組化(IHC)及TUNEL法檢測,觀察脊髓損傷后組織病理學變化,測定脊髓標本損傷段凋亡細胞的計數及TGF-β1的表達變化。
1.2 脊髓損傷模型制備

1.3 大鼠急性脊髓損傷后的護理
大鼠脊髓急性損傷后常導致截癱,除假手術組外均表現為雙下肢癱瘓,小便潴留,大便不能控制,大鼠護理期間注意室溫調節,保持15-20 ℃,注意通風,勤換水、換墊料,保持鼠籠干燥。術后注意預防感染,術后每日定時人工按摩膀胱排尿,每日溫肥皂水清洗雙側下肢及尾巴并保持干燥,防止肢體潰瘍。大鼠取脊髓標本前行雙盲法對每組大鼠進行神經功能評價,評價指標采用BBB評分(Basso,Beattie,Bresnahan locomotor rating scale)和斜板評分聯合使用[8]。
1.4 標本制作及圖像分析
對大鼠評估神經功能評分后,予乙醚吸入麻醉,經胸骨遠端左緣快速開胸進入,小型靜脈留置針準確插入左心室內,生理鹽水灌注后迅速用4%甲醛充分灌注,30 min后暴露損傷脊髓上下段,取環扎處上下段共1.5 cm脊髓組織,置入4%甲醛中72 h,流水沖洗后進行梯度酒精脫水,浸蠟包埋,標簽標記,冠狀位切片,采用HE染色觀察脊髓組織病理變化,免疫組化測定各時間點TGF-β1的表達,TUNEL法檢測凋亡細胞水平。每張切片取光鏡下3個視野400倍進行觀察,采用JEDA 801D形態學圖像分析系統進行圖像統計采集分析。
1.5 統計方法
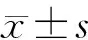
2 結果
2.1 脊髓標本大體組織學變化
標本組織總體可見脊髓組織結構紊亂,部分可見脊髓空洞壞死及陳舊性出血表現。
2.2 HE染色觀察
通過HE染色脊髓標本可發現假手術組脊髓組織、細胞形態保持完好(見圖1A);減壓組可見損傷范圍基本恒定,脊髓組織回縮變細、結構紊亂,出血、髓鞘水腫、斷裂,部分可見脊髓空洞壞死(見圖1B-D)。不減壓組主要表現為空洞性壞死改變以及陳舊性出血表現(見圖1E)。

圖1 各組14 d脊髓取材標本HE染色鏡下表現 (HE,×400)Figure 1 HE staining of spinal cord samples at day 14 in each group (HE,×400)
2.3 TGF-β1的表達
每張切片取400倍光鏡下3個視野進行觀察,以細胞漿和/或核棕黃色著色為陽性細胞。假手術組未見TGF-β1的陽性表達(見圖2);8 h減壓組、24 h減壓組、72 h減壓組及不減壓組1 d取材標本TGF-β1開始表達,3 d時達到高峰,7 d時逐漸下降,至21 d仍有表達(見圖2,表1),且8 h減壓組、24 h減壓組和72 h減壓組TGF-β1在21 d的表達普遍低于不減壓組(見表1)。

圖2 各組3 d取材標本免疫組化鏡下表現 (IHC,×400)Figure 2 Immunohistochemical staining of the samples at day 3 d in each group (IHC,×400)

表1 各組不同時間點脊髓標本TGF-β1陽性細胞數比較
2.4 細胞凋亡的變化
每張切片取400倍光鏡下3個視野進行觀察,凋亡細胞呈棕褐色和棕黃色,胞核固縮顆粒深染不規則,于損傷區域及周圍彌散性分布,假手術組基本無表達,各手術組3 d取材標本凋亡細胞數明顯增多(見圖3)。8 h減壓組、24 h減壓組、72 h減壓組及不減壓組1 d取材標本均有不同程度的表達,3 d達到高峰,后逐漸下降,21 d仍有表達(見表2)。72 h減壓組各時間點凋亡細胞計數均顯著高于8 h減壓組、24 h減壓組,而8 h減壓組、24 h減壓組、72 h減壓組凋亡細胞計數又遠低于不減壓組(見表2)。

圖3 各組3 d取材標本TUNEL染色 (TUNEL,×400)Figure 3 TUNEL staining of spinal cord tissues at day 3 in each group (TUNEL,×400)

表2 各組時間點切片凋亡細胞的計數統計
2.5 TGF-β1的表達與凋亡細胞計數的相關性分析
收集TGF-β1及凋亡細胞計數的統計數據,采用線性相關分析。各減壓組TGF-β1及凋亡細胞計數相關分析顯示:相關系數r=0.915-0.958,雙側Pearson檢驗P=0.010-0.029,在0.05水平(雙側)顯著相關,有統計學意義(見圖4)。可見,TGF-β1計數與凋亡細胞計數呈線性相關。
2.6 各組大鼠術后神經功能BBB評分及斜板評分
假手術組BBB及斜板評分大致接近正常,近似呈水平線。8 h減壓組和24 h減壓組BBB及斜板評分自術后1 d呈逐漸上升趨勢,兩者評分基本相似,無明顯差異;72 h減壓組各時間點BBB及斜板評分均較8 h減壓組、24 h減壓組組低。不減壓組評分最低,且恢復趨勢不明顯,神經功能恢復差(見圖5,6)。各組BBB及斜板評分組間行統計學分析, 8 h減壓組與24 h減壓組組間比較無統計學差異,其余各組兩兩比較均差異有統計學意義(P<0.05)。BBB及斜板評分8 h減壓組、24 h減壓組>72 h減壓組>不減壓組,可見減壓后大鼠功能評分隨著時間的推移,BBB及斜板評分呈逐漸上升的趨勢,且評分優于不減壓組大鼠功能評分。

圖4 各組TGF-β1陽性細胞數及凋亡細胞計數的線性相關圖Figure 4 Linear correlation of TGF-β1 positive cells with apoptotic cell counts in each group

與假手術組比較,aP <0.05;與8 h減壓組比較,bP <0.05;與24 h減壓組相比,cP <0.05;與72 h減壓組相比,dP <0.05圖5 各組不同時間點BBB評分Figure 5 BBB score at different time points in each group

與假手術組比較,aP <0.05;與8 h減壓組比較,bP <0.05;與24 h減壓組相比,cP <0.05;與72 h減壓組相比,dP <0.05圖6 各組不同時間點斜板評分Figure 6 Inclined board score at different time points in each group
3 討論
獲得理想的脊髓損傷動物模型是研究SCI損傷機制、探索神經修復過程、提高醫治效果并將之應用于臨床的首要前提。回顧以往文獻,近20年來國內外先后報道了多種不同方法建立的脊髓損傷模型,造模的方法種類甚多,但各種造模方法各有優缺點。本研究根據實驗的設計需要及臨床SCI的損傷特點,對Richard等[9]報道的用帶狀物環繞犬圓錐并結扎,以制作硬膜囊受壓動物模型的方法進行了改進,使之用于更易護理的嚙齒類動物。環扎法較之以上所述方法具有以下優點:可一次性完成脊髓損傷及靜態持續受壓,術中無需特殊器械及儀器,方法簡便易行,可重復操作性好。另外環扎法建立的脊髓靜態持續壓迫模型,與臨床上脊柱骨折產生壓迫致脊髓損傷的特點具有一定的相關性,符合實驗結合臨床的特點。
脊髓損傷后,不同減壓時間點療效是進行手術時機選擇的重要依據;神經功能的評價是對模型術后功能恢復具有客觀意義的評價標準。本實驗采用兩種評分相結合的方式,避免了單一評價方式的不足,在評價大鼠神經功能水平的同時也間接評價了大鼠后肢肌力的恢復水平,增加了實驗評分的準確性和可靠性[10]。SCI要求積極早期減壓[11,12],但結合實際情況,如就診、轉診時間、復合傷病情等,故8,24,72 h減壓是黃金時間段,實驗中細分這幾個關鍵時間點,對于手術時機把握及獲得最佳的遠期療效,具有重要意義。通過實驗發現,假手術組大鼠術后BBB評分及斜板評分未見明顯異常,總體評分基本接近于正常水平。8 h減壓組、24 h減壓組、72 h減壓組大鼠評分情況較不減壓組差異明顯,8 h減壓組、24 h減壓組、72 h減壓組大鼠不同時間減壓后評分均逐漸提高,神經功能逐步好轉,且8 h減壓組、24 h減壓組各時間點評分較72 h減壓組差異明顯,不減壓組大鼠評分顯示大鼠神經功能恢復緩慢,后肢肌力及運動能力未得到明顯改善。
在本組實驗中,對大鼠脊髓標本進行HE染色、免疫組化及TUNEL法檢測來評價大鼠脊髓標本損傷狀況以及統計TGF-β1和凋亡細胞的表達。在標本檢測中,手術組TGF-β1和凋亡細胞的表達基本表現為先增高后逐步降低的趨勢。其中不減壓組最為明顯,高度表達。回顧國外學者研究文獻[3-5],TGF-β1廣泛存在于人血小板和哺乳動物骨骼中,是一類廣泛存在的多肽類生長因子,具有多種生物學作用,主要參與組織創傷修復、胚胎發育、免疫、炎癥、血管生成和細胞外基質的沉積等密切相關的多功能的細胞因子。近來研究表明[13,14]:TGF-β1與急性脊髓損傷的修復關系密切,在脊髓損傷后表達增加,可能與其具有免疫抑制、炎癥抑制的作用相關,是機體對神經損傷的一種自我保護反應。動物實驗結果也提示,應用轉化生長因子鞘內給藥處理急性大鼠脊髓損傷,可以明顯減輕脊髓損傷的范圍,推斷TGF-β1通過抑制膠質瘢痕形成來為脊髓損傷修復提供良好的環境[15]。Yuan等[16]實驗表明:大鼠脊髓損傷后TGF-β1、核轉錄因子NF-κb等促炎因子增加,通過抗炎作用降低細胞內成分膠質纖維酸性蛋白的表達;抑制反應性膠質增生。另外,轉化生長因子還具有神經元保護作用的功能,能夠促進脊髓運動神經元和多巴胺神經元的存活,可以促血管形成及促進軸突的伸長[17]。Sulaiman等[18]研究也證實,在大鼠脛神經損傷模型中,局部使用TGF-β1對神經元再生有顯著效果,證實TGF-β1能抑制T細胞的增生和小膠質細胞、巨噬細胞的細胞毒性分子和炎癥前因子的釋放,減少炎癥引起的組織損傷,促進神經元的損傷修復。
本實驗研究結果也表明,在動物實驗中,隨著脊髓減壓時間的推遲,72 h減壓組大鼠減壓后神經功能恢復水平如BBB評分及斜板評分較早期減壓組(8 h減壓組和24 h減壓組)有明顯差異,且TGF-β1的表達也較高。而不減壓組大鼠神經功能評分更低,且TGF-β1的表達水平較手術減壓組也較高,基本符合以往文獻報道[13,16],可以證實TGF-β1對脊髓損傷的修復有一定的促進作用。
在本實驗中,隨著脊髓減壓時間的推遲,72 h減壓組大鼠減壓后神經功能恢復水平如BBB評分及斜板評分較早期減壓組(8 h減壓組和24 h減壓組)有明顯差異,且凋亡細胞水平也較早期減壓組高,TGF-β1的表達也相應較高。同時,在不減壓組與減壓組的比較中,可見不減壓組相同時期內凋亡細胞水平和TGF-β1的表達、BBB評分、斜板評分均顯著高于減壓組。
在凋亡細胞計數與TGF-β1表達的計數對比中可見:正常脊髓中不表達凋亡細胞和TGF-β1,發生SCI后,機體啟動了細胞凋亡程序,同時在脊髓損傷后也立即出現了TGF-β1的表達。經數據分析,證實:各組不同時間減壓后,凋亡細胞計數與TGF-β1陽性細胞數存在相關性,且經方差分析后有統計學意義。凋亡細胞計數在減壓術后3 d達高峰,后逐漸下降,并持續表達。TGF-β1在3 d達高峰后逐漸下降,并持續表達。在早期減壓中,凋亡細胞的峰值水平遠低于晚期減壓組及不減壓組,與Park等[19]的報道結果相符合。對比TGF-β1與凋亡細胞的計數可見:隨著TGF-β1表達的增加,凋亡細胞呈進行性下降。故推測,在脊髓損傷凋亡啟動后,脊髓損傷處高度表達的TGF-β1可能對凋亡有阻斷作用,從而限制凋亡的進一步發展,以保護周圍神經元,以此來減輕脊髓損傷的范圍。
綜上,通過實驗研究表明,脊髓損傷大鼠早期(24 h內)有效的脊髓減壓對促進神經功能恢復起著至關重要的作用,神經功能評分(斜板評分及BBB評分)明顯優于72 h減壓組及不減壓組。且對比TGF-β1與凋亡細胞的計數可見:隨著TGF-β1表達的增加,凋亡細胞呈進行性下降,推測TGF-β1可抑制凋亡的進一步發展,并且具有神經元保護功能。國內外已有報道局部干細胞移植可有效促進神經元的再生[20],預計可能在不久的將來,應用3D打印技術,移植膠原蛋白/殼聚糖支架來改善神經損傷后軸突再生將是一個新的研究熱點。

