急性冠脈綜合征中乙酰肝素酶表達及血小板和D-二聚體計數的觀察
其布爾,劉 瓊,包海梅,周麗芹,藺雪峰,韓軒茂
(1.內蒙古科技大學包頭醫學院研究生學院,內蒙古 包頭 014040;2.內蒙古科技大學包頭醫學院第一附屬醫院心內一科)
急性冠狀動脈綜合征(acute coronary syndrome,ACS)包括不穩定型心絞痛(unstable angina,UA),非ST段抬高型心肌梗塞(non-ST-segment elevation myocardial infarction,NSTEMI)以及ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)。AC早期風險分層可以幫助臨床醫生確定早期治療策略。乙酰肝素酶表達(heparanase,HPSE) 是哺乳動物體內唯一一種能夠降解細胞外基質中硫酸乙酰肝素蛋白多糖的β-D-葡萄糖醛酸內切酶[1]。研究發現,HPSE在ACS發病過程中起著重要的作用;血小板在動脈粥樣硬化斑塊和血栓的形成中發揮至關重要的作用;D-二聚體也是凝血狀態和血栓形成形式的生物標志物[2],D-二聚體可能是ACS高危患者的重要危險因素。本研究主要觀察HPSE、血小板、D-二聚體在ACS中的表達,進一步探討其在ACS發病發展中的臨床價值。
1 對象與方法
1.1對象 共選取2016年12月至2018年6月包頭醫學院第一醫附屬醫院心內科住院患者共150例;均行冠狀動脈造影檢查,冠狀動脈主干或一級分支狹窄≥50%或二級分支狹窄≥70%者納入試驗組;有胸痛癥狀的住院期間經冠脈造影提示未見明顯狹窄病變不能診斷CHD者納入對照組。研究對象分為三組,即(1)UA組患者共50例,其中男性38例,女性12例,年齡41~83歲,平均年齡(62.36±9.51)歲。(2)AMI 組患者共50例,其中男性38例,女性12例,年齡41~79 歲,平均年齡(62.59±10.01)歲。(3)對照組 患者共 50 例,其中男性19例,女性31例,年齡37~77歲,平均年齡(58.20±9.15)歲。
1.2方法 研究對象在住院當日空腹狀態下抽取肘靜脈血6 mL,采用實時定量PCR法檢測外周血單核細胞中 HPSE mRNA 的表達水平。常規檢測外周血血小板計數及D-二聚體水平。
2 結果
UA組和AMI組的HPSE表達水平均高于對照組(P<0.05),UA 組與 AMI 組間無明顯統計學差異(P>0.05);大血小板比率、血小板計數、D-二聚體水平在對照組與 UA 組及 AMI 組之間比較分析未見明顯統計學差異(P>0.05)。見表1。
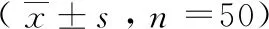
表1 各組間相關指標的比較
3 討論
ACS描述心肌缺血狀態的范圍,UA和AMI發生均由冠狀動脈粥樣硬化斑塊的突然破裂或動脈粥樣硬化性血栓形成引起。動脈粥樣硬化基礎上血栓的形成與炎癥有著密切的關系。在ACS中HPSE促進穩定性斑塊轉變為易損斑塊[3]。HPSE可通過介導硫酸乙酰肝素(heparan sulfate,HS)的酶重塑來影響炎癥反應過程,包括白細胞聚集、滲出和遷移、釋放炎性細胞因子和趨化因子以及激活固有免疫細胞[4]。冠狀動脈粥樣硬化的炎癥斑塊中的上皮及內皮中HPSE有明顯表達,炎癥細胞因子進一步誘導內皮和(或)上皮細胞釋放HPSE[5]。在新生血管內膜中 HPSE 激活巨噬細胞進而促進炎癥的發生,使冠脈內穩定性斑塊轉變為易損斑塊[5]。HPSE 增強組織因子(tissue factor,TF)的活性和含量,增加組織因子途徑抑制物 ( tissue factor pathway inhibitor,TFPI) 的含量。THPSE與細胞表面上的 TFPI 相互作用,使 TFPI 從細胞膜解離,導致細胞表面凝血活性增加[6],因此HPSE 在血液高凝狀態中起到一定的作用,進一步促進血栓的形成。
ACS的發生通常與冠狀動脈中易損斑塊的存在有關,并在由破裂的動脈粥樣斑塊形成的血栓導致冠狀動脈的官腔閉塞。易損斑塊的破裂導致繼發于血小板活化的管腔血栓形成和動脈粥樣硬化病變內血栓形成元素的釋放[7]。血小板的活化導致諸如血栓烷A2和5-羥色胺(5-HT)的分子分泌,從而引起血管收縮[8]。血小板衍生生長因子(PDGF),β-血球蛋白(β-TG)和血小板因子4(PF4),可刺激動脈硬化;白三烯增強炎癥反應;糖蛋白IIb / IIIa受體激活血液系統以促進血小板聚集和血栓形成[8]。
D-二聚體是纖維蛋白的一種降解產物[2],也是凝血狀態和血栓形成形式的生物標志物[2]。研究證明,D-二聚體升高與易損斑塊[9]、ACS遠期死亡率增加相關[10]。D-二聚體與接受PCI的ACS患者的院內死亡率獨立相關[2]。D-二聚體可能是ACS高危患者的重要危險因素。
本實驗結果顯示,與對照組相比,無論UA 組或 AMI 組中,HPSE 表達均升高,差異有統計學意義(P<0.05);AMI 組與 UA 組比較,HPSE 雖升高,但差異未見統計學意義。提示在ACS中HPSE促進穩定性斑塊轉變為易損斑塊,在血液高凝狀態中起到一定的作用,進一步促進血栓的形成。
血小板計數和D-二聚體在對照組、UA組、AMI組之間無統計學差異(P>0.05),本實驗可能存在樣本量少、抽樣誤差等有關。既往研究報道,在ACS患者中,由于疾病進展過程中內皮細胞的損傷和動脈粥樣硬化斑塊的形成,患者血小板聚集和血栓形成增加,就會消耗成熟的血小板[8]。為了補償血小板的損失,血小板生成素刺激巨核細胞并轉化為多倍體巨核細胞,產生更多的未成熟的血小板,增加其體積[11]。此外,研究顯示,與非CAD組相比,ACS患者血小板中TLR2 mRNA表達的升高[12]。血小板TLR mRNA表達的改變是炎癥驅動冠狀動脈粥樣硬化的結果,并且可能代表ACS中的另一種血小板活化途徑[13]。因此,血小板計數可能是ACS患者的獨立預測因子。我們的研究中,血小板計數及血小板體積在對照組、UA組、AMI組之間無統計學差異,提示內皮細胞的損傷和動脈粥樣硬化斑塊破裂處的局部微環境,可能增加了血小板功能導致局部血栓形成。
D-二聚體在評估靜脈血栓栓塞患者中已被用作診斷和預后的生物標志物,但其在ACS中的診斷及治療價值扔欠佳。研究證實,穩定型冠狀動脈疾病,ACS和ST段抬高型心肌梗死(STEMI)患者較高的D-二聚體與遠期死亡率增加之間的相關性[10,14]。D-二聚體是通過破壞和纖溶酶在損傷部位破壞纖維蛋白凝塊而產生的,這代表了活性血栓的形成及其裂解[15]。在ACS病理生理過程中,D-二聚體的產生速度快于其他標記物[15]。另一方面,研究表明,D-二聚體與心血管疾病的發生或復發直接相關,AMI和UA患者的血漿D-二聚體水平高于無缺血事件的患者,而且,AMI患者的血漿D-二聚體高于UA患者[15]。目前,尚未研究進行D-二聚體在ACS、UA、AMI中的比較及診斷的影響。本研究中D-二聚體在對照組、UA組、AMI組之間無明顯差異,推測ACS發病中,凝血功能的紊亂,也主要發生在動脈粥樣硬化斑塊破裂處微環境部位,全身凝血功能亢進尚不明顯。
總之,HPSE已參與ACS發病過程,且主要參與了破裂的動脈粥樣斑塊形成的血栓導致冠狀動脈的官腔閉塞,很可能成為ACS中的新型危險因素。血小板及D-二聚體是否成為ACS診斷新標志物需待進一步探究。

