miR-605對非小細胞肺癌細胞放射敏感性的影響*
周東亞,張海兵,耿曉如,章杭,胡陽陽,周雷*,王小龍,張璇
(1.南京中醫藥大學沭陽附屬醫院 腫瘤科, 江蘇 南京 223600; 2.錦州醫科大學附屬第一醫院 腫瘤科, 遼寧 錦州 121000)
近年,肺癌的發病率和死亡率都升高,并成為了中國乃至世界范圍死亡率最高的惡性腫瘤[1]。非小細胞肺癌(non-small-cell lung cancer,NSCLC)的發病率在肺癌中超過80%[2]。除了外科手術外,放射療法也是肺癌最重要的治療方法之一[3-5],但長時間的放射會使癌癥細胞產生輻射抗性,致使放療效果減弱[6-7]。因此,尋找一定的靶點以提高NSCLC癌細胞的放射敏感性,提高放療效果有重要意義。MicroRNA(miRNA)是長度為19~25個核苷酸的單鏈RNA,可與靶基因信使RNA(mRNA)序列的3′-非翻譯區(3′-untranslated region ,UTR)互補結合,并在轉錄后調節靶基因的表達[8]。證據表明,miRNA在包括NSCLC在內的癌癥中有重要作用[9-10],并且相關研究也指出miRNA可能成為NSCLC治療中的生物標志物[6, 11]。據報道,miR-605對肺腺癌有特異性,能通過抑制肺癌細胞系中的MDM2來增強p53的反式激活,從而抑制肺癌細胞的增殖[12-13],推測micro-605的表達變化是調控小細胞肺癌細胞放射敏感性的上游調控因子,但miR-605與NSCLC細胞放射敏感性的關系還未見報道。本研究以NSCLC細胞A549為對象探索下調miR-605靶向調控腫瘤壞死因子α誘導蛋白3(tumor necrosis factor alpha-induced protein 3,TNFAIP3),以提高非小細胞肺癌細胞放射敏感性的機制。
1 材料與方法
1.1 材料與儀器
人肺腺癌細胞A549(中科院上海生命科學研究所),miR-605minic和miR-605 inhibitor(廣州銳博生物技術有限公司),qTR-PCR試劑盒(美國TaqMan公司),細胞克隆法試劑盒(美國Sigma公司),凋亡試劑盒(美國BD公司),一抗、二抗(美國CST公司),螢光素酶報告基因試劑盒(美國Promega公司),流式細胞儀(美國Beckman Coulter公司),6MV X線直線加速器(德國西門子公司),酶標儀(美國Gibco公司)。
1.2 方法
1.2.1細胞培養及轉染分組 本研究共分為miR-605模擬物組(miR-605 mimic)、miR-605抑制劑組(miR-605 inhibitor)和空白對照組(NULL),轉染miR-605的A549細胞模擬物,購自于上海GenePharma有限公司。將細胞以1×104細胞/孔的密度接種到6孔板中,TNFAIP3 cDNA克隆到表達載體pcDNA3.1(Invitrogen)中構建TNFAIP3的過表達載體,用RNAiMax和Lipofectamine 3000 with Plus Reagent(Thermo Fisher Scientific)瞬時轉染細胞,通過qRT-PCR測定轉染效率。
1.2.2miR-605表達檢測 采用qRT-PCR方法檢測,將miR-605模擬物、miR-605抑制劑、空白對照轉染進A549細胞后miR-605的表達。按照試劑盒的說明進行qPCR定量相應細胞miR-605的含量,并以GAPDH作為內對照,引物序列如下:GAPDH上游序列為CCCATGTTCGTCATGGGTGT,下游序列為CCCATTCCCCAGCTCTCATA;miR-605 上游序列為UAAAUCCCAUGGUGCCUUCUCC,下游序列為AGAAGGCACUAUGAGAUUUAGA。
1.2.3細胞克隆法檢測細胞活力 照射后的細胞經胰蛋白酶消化后進行細胞精確計數,選擇合適的稀釋倍數稀釋后,以每個培養皿約100個細胞的濃度將細胞種植于培養皿中,于二氧化碳培養箱中37 ℃培養7 d。用1%甲基藍對所培養的細胞染色,統計細胞數>50 的克隆數。細胞存活分數(survival fraction,SF)計算公式:SF(%)=(Sx/S0)×100%,Sx為受照細胞克隆形成率,S0為對照細胞克隆形成率。
1.2.4細胞凋亡水平實驗 照射后各處理組接種5 000個細胞/孔接種在96孔板中,在培養箱中培養48 h后,以6 Gy的劑量進行照射。24 h后以1 000 r/min離心2次、每次離心5 min,PBS洗滌,按試劑盒說明進行AV/PI抗體孵育,20 min后分析miR-605模擬物、miR-605抑制劑、NULL組中A549細胞凋亡率。
1.2.5Western Blot實驗 收集相應細胞,蛋白裂解液中裂解30 min,在4 ℃用12 000 r/min離心15 min。使用10%十二烷基硫酸鈉-聚丙烯酰胺凝(SDS-PAGE)電泳分離等量的蛋白質,在4 ℃、300 mA恒流轉膜(PVDF膜),將膜在室溫下、5%脫脂牛奶中封閉1 h,在4 ℃下用TNFAIP3及β-actin一抗過夜孵育并顯像分析。
1.2.6miRNA靶標的分析及熒光素酶報告基因檢測 使用TargetScan算法對MiRNA靶標進行了分析[12]。將各組細胞在培養箱中培養48 h后,使用Lipofectamine 2000轉染試劑將0.5 μg TNFAIP3 3′-UTR報告質粒(pRL-TNFAIP3)轉染進各組經miR-605修飾的細胞中。48 h后,使用雙熒光素酶報告基因檢測試劑盒檢測熒光素酶活性采用Lipofectamine 2000將含有WT或MT TNFAIP3 3′-UTR的報告載體與miR-605 mimic或NULL共轉染到A549細胞中。轉染48 h后,采用雙熒光素酶測定系統(Promega)測量熒光素酶活性。
1.3 統計學分析
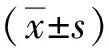
2 結果
2.1 miR-605表達
與空白對照組比較,轉染進miR-605模擬物后,miR-605表達(3.29±0.13)升高;轉染進miR-605抑制劑后,miR-605表達降低,差異有統計學意義(P<0.05),表明轉染體系有效。見圖1。
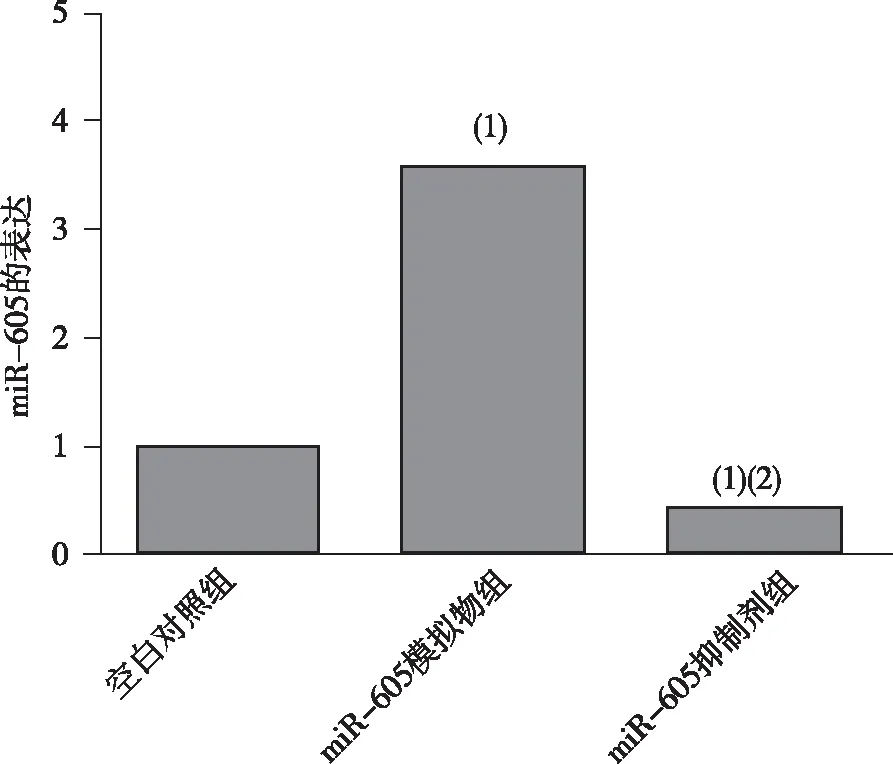
注:(1)與空白對照組比較,P<0.05;(2)與miR-605模擬物組比較,P<0.05。
2.2 細胞活力水平
與空白對照組比較,miR-605模擬物組的細胞活力升高,差異有統計學意義(P<0.05);與miR-605模擬物組比較,miR-605抑制劑組的細胞活力降低差異有統計學意義(P<0.05)。見圖2。
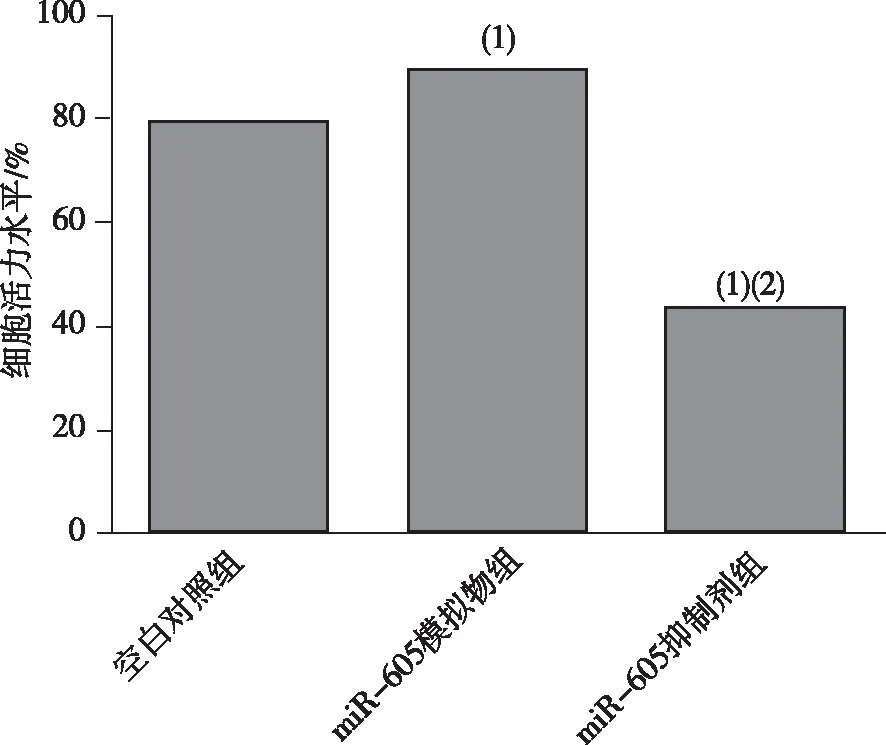
注:(1)與空白對照組比較,P<0.05;(2)與miR-605模擬物組比較,P<0.05。
2.3 細胞凋亡水平
照射后,與空白對照組比較,miR-605模擬物組的細胞凋亡水平降低,差異有統計學意義(P<0.05);與miR-605模擬物組比較,miR-605抑制劑組的細胞凋亡升高,差異有統計學意義(P<0.05)。見圖3。

注:A1為細胞照射前凋亡水平,A2為細胞凋亡水平定量結果,B1為細胞照射后凋亡水平,B2為細胞凋亡水平定量結果;(1)與空白對照組比較,P<0.05;(2)與miR-605模擬物組比較,P<0.05。
2.4 TNFAIP3的蛋白表達
照射后,與空白對照組比較,miR-605模擬物組TNFAIP3的蛋白表達降低差異有統計學意義(P<0.05);與miR-605模擬物組比較,miR-605抑制劑組TNFAIP3的蛋白表達升高,差異有統計學意義(P<0.05)。見圖4。
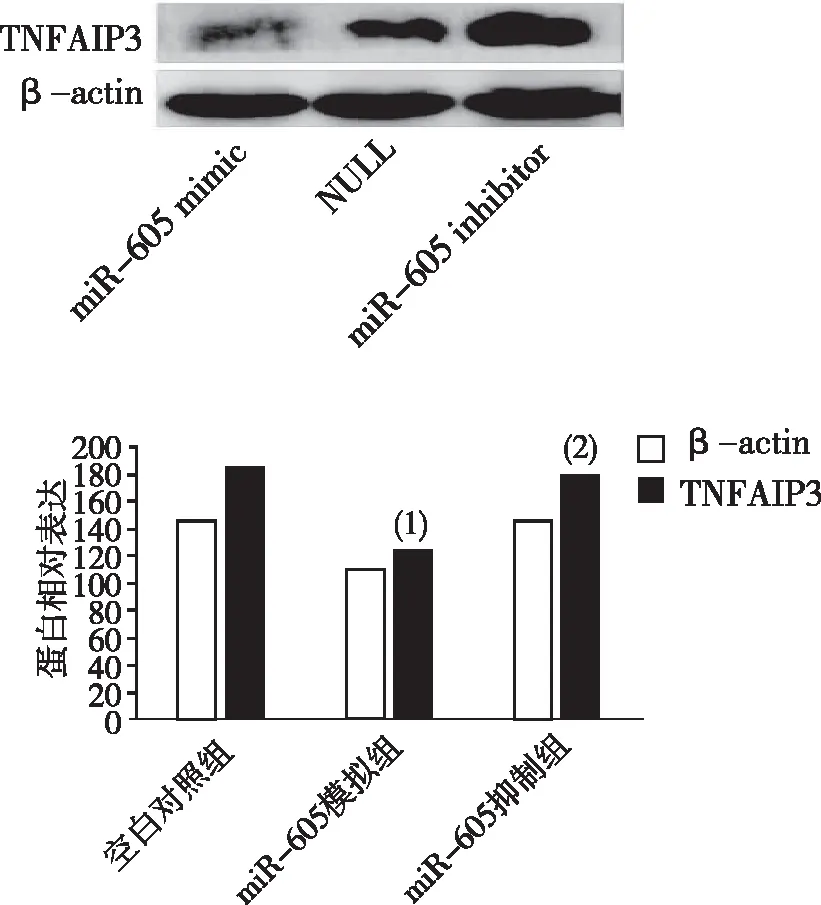
注:(1)與空白對照組比較,P<0.05;(2)與miR-605模擬物組比較,P<0.05。
2.5 靶點和A549細胞TNFAIP3 3′-UTR的相對熒光素酶活性
miR-605模擬物能抑制TNFAIP3 3′-UTR報告基因的熒光素酶活性,差異有統計學意義(P<0.05);miR-605抑制劑能提高TNFAIP3 3′-UTR報告基因的熒光素酶活性,差異有統計學意義(P<0.05)。見圖5。
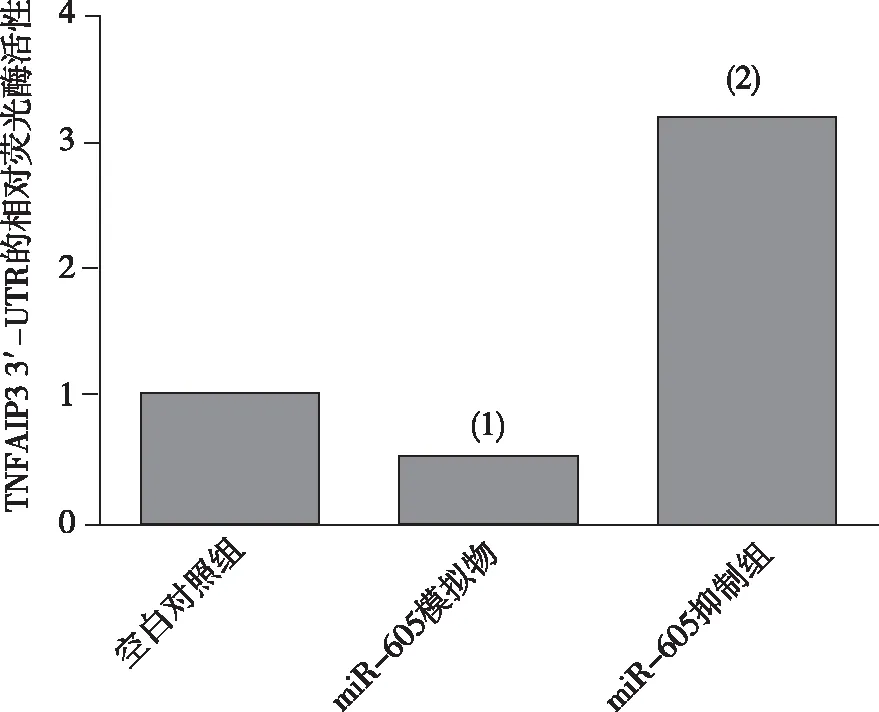
注:(1)與空白對照組比較,P<0.05;(2)與miR-605模擬物組比較,P<0.05。
2.6 TNFAIP3 3′-UTR轉染組細胞活力
照射后(6 Gy),與空白對照組比較,pcDNA′TNFAIP3轉染組的細胞活力水平降低,差異有統計學意義(P<0.05)。見圖6。
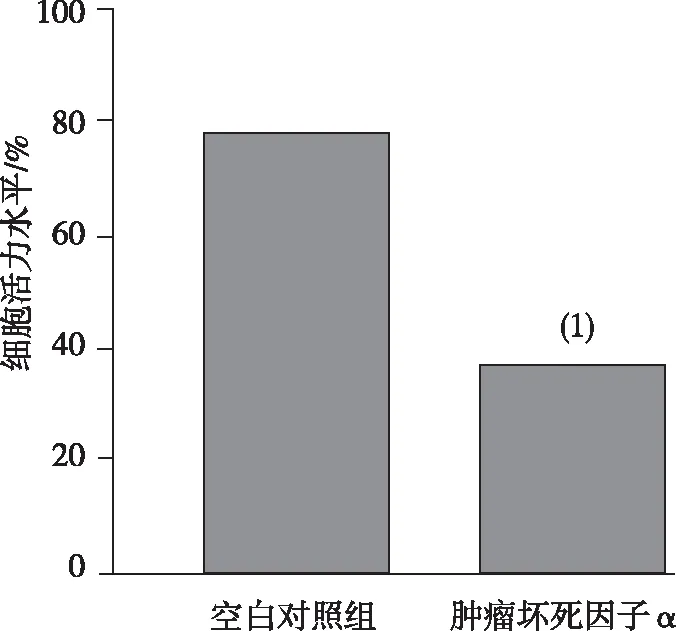
注:(1)與空白對照組比較,P<0.05。
3 討論
在許多癌癥中,miRNA表達存在異常。目前相關研究已指出10個miRNA是NSCLC的潛在標志物,可作為致癌基因或抑癌基因,例如 miRNA-133a能充當NSCLC的抑制因子和獨立的預后生物診斷標志物[14];miRNA-758可通過負調控HMGB抑制NSCLC的增殖,侵襲,遷移和促凋亡[15];也有相關研究指出miRNA同癌細胞的放射敏感性相關[6,16-17]。另外,有研究指出,miR-605通過靶向EN2促進了前列腺癌細胞的增殖和遷移[18];miR-605通過靶向抑制PSMD10/Gankyrin金銀抑制了肝內膽管癌細胞的進程[19];并且還有研究指出miR-605通過直接靶向Forkhead Box P1抑制非小細胞肺癌細胞的增殖[20]。然而,miR-605對NSCLC放射敏感性的影響及相關機制仍不清楚。因此,本研究首先通過細胞克隆法實驗及細胞凋亡實驗檢測了miR-605 對A549細胞放射敏感性的影響,結果說明抑制miR-605在A549細胞中的表達有利于提高該細胞的放射敏感性,而提高miR-605在A549細胞中的表達會有利于產生輻射抗性。TNFAIP3與非酒精性肝炎有關,能通過導肝ASK1的失活改善非酒精性肝炎[21],而這一結果仍未有相關文獻的報道。在免疫學領域,有研究指出TNFAIP3能通過限制MTOR、促進自噬來提高CD4 T細胞的活力[22]。本研究通過Western blot實驗發現了miR-605下調后,靶向上調了A549細胞中的TNFAIP3蛋白來增強其放射敏感性。TNFAIP3基因的高表達水平與非小細胞肺癌發生發展密切相關,并且與肝癌的轉移復發存在相關性,提示TNFAIP3可能成為協助非小細胞肺癌診斷,判斷預后及療效評價的指標[23-25]。筆者分析,miRNA表達抑制可增加經γ射線照射(2.5G)的細胞的死亡,說明miRNA有促進細胞存活及抗凋亡的功能。miRNA可通過不同水平的多種信號通路來調節電離輻射引起的細胞損傷。電離輻射可以激活多種信號通路損傷細胞,如MTOR信號途徑。miR-605的靶基因TNFAIP3對MTOR信號途徑有負調節作用,沉默miR-605,增TNFAIP3的表達,可減少對DNA雙鏈損傷的修復,進而增加放射敏感性。
綜上所述,下調miR-605后,非小細胞肺癌放射敏感性的增強可能是通過靶向上調TNFAIP3實現的,然而由于放射增敏的分子機制十分復雜,其是否通過其他通路產生作用仍不清楚,本研究將對此不斷探索。

