pH 對AZ31 鎂合金表面磷酸鈣轉化膜性能的影響
左宏健,賈素秋*
(長春工業大學,吉林 長春 130000)
生物醫用金屬是目前常用于臨床醫學的材料,如鈷基合金、鈦及鈦合金、不銹鋼等。但由于它們的彈性模量與人骨的彈性模量不匹配,長期固定在人體內易引發炎癥,且需要進行第二次手術取出植入物,增加了治療成本和風險。鎂合金的密度等同于天然骨,生物相容性良好,質量輕,易降解,成本也較低,具有相當優秀的發展潛力。但是鎂合金在人體內極易溶解,腐蝕速率過快,常對其進行表面改性,以便廣泛地應用于骨植入。表面改性不僅幾乎不影響鎂合金的強度,而且通過調整表面的成分和結構可控制其腐蝕速率。目前用于鎂合金的磷酸鹽轉化膜主要有錳系、鋅系、鋇系、鈣系等[1-6]。通過電化學反應在鎂合金表面生成一層非金屬、不導電、難溶的結晶型磷酸鹽轉化膜,可以降低鎂在富含氯離子的人體生理環境中的腐蝕速率,防止鎂合金腐蝕所產生氫氣造成皮下氣泡。鈣系磷酸鹽膜的研究起步相對晚一些,由于其良好的生物相容性,常被用作生物防護涂層[7]。本文研究了pH 對AZ31 鎂合金Ca-P 轉化膜的結構及耐蝕性的影響,并探究了成膜機制。
1 實驗
1.1 基材及其前處理
材料為AZ31 鎂合金,尺寸為20 mm × 10 mm × 4 mm。先用280 號、400 號、600 號、1000 號SiC 砂紙逐級打磨試樣,再分別在去離子水、無水乙醇中超聲清洗30 min,隨即在50 °C 的20 g/L Na2CO3溶液中超聲清洗30 min 以去除表面污染物,然后在過飽和的Ca(OH)2溶液中室溫浸泡24 h,用去離子水清洗 以增加基體表面的形核點。
1.2 轉化膜的制備
轉化液由0.042 mol/L Ca(NO3)2和0.025 mol/L NH4H2PO4配成,鈣磷比為1.68,使用HNO3和NaOH調節其pH 至4.5、5.0、5.5、6.0 和6.5。在室溫下將預處理過的鎂合金分別浸入不同pH 的轉化液中,按pH 由低到高記為A、B、C、D 和E 組,48 h 后取出,用去離子水清洗表面后用冷風吹干。
1.3 表征與性能測試
使用JEM-5500LV 掃描電鏡(SEM)和ZEISS SUPRA 40 場發射掃描電鏡(FESEM)觀察轉化膜的形貌。使用D-MAXILA 型X 射線衍射儀(XRD)和EDAX-Falcon 能譜儀(EDS)確定膜層成分。
采用荷蘭Ivium 電化學工作站測量試樣的極化曲線以及電化學阻抗譜。腐蝕介質為0.9% NaCl 溶液;鉑片電極作為輔助電極,飽和甘汞電極(SCE)作為參比電極,試樣為工作電極(1 cm2,非工作表面用環氧樹脂涂封)。電位掃描速率為5 mV/s,阻抗譜測試頻率范圍100 000 ~ 0.01 Hz,振幅0.014 14 V,測試電位自動確定。
鎂合金作為生物植入材料若需應用于臨床,應測試其在人體內的腐蝕情況。將在pH = 5.5 的轉化液中制得的試樣懸浮于37 °C 的仿生液(配方見表1)中,每隔24 h 更換一次仿生液,168 h 后取出并在空氣中自然干燥,觀察轉化膜的腐蝕情況及溶液的沉淀情況。

表1 人體仿生液的配方 Figure 1 Composition of simulated body fluid (單位:g/L)
2 結果與討論
2.1 轉化膜的形貌
從圖1 可見,所有試樣上均形成了一層致密的轉化膜,膜厚普遍在10 ~ 20 μm 之間,最厚處達30 μm。所有轉化膜都完全覆蓋了基體。膜層形貌與轉化液pH 有很大的關聯性:pH 較低時,膜層主要由片狀結構組成,最長可達幾百微米,較大的晶粒組織導致膜層厚度不均勻;隨著pH 增加,片狀組織逐漸被10 μm左右的球狀結構取代,膜層表面變得更加平滑,厚度也更加均勻。
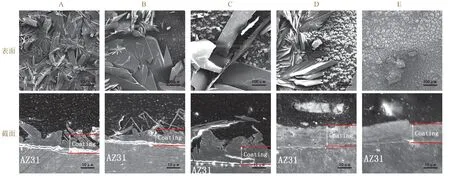
圖1 不同p H 的轉化液所制轉化膜的SEM 照片 Figure 1 SEM images of conversion films prepared at different pHs
2.2 轉化膜的成分
2.2.1 能譜分析
使用能譜儀分別對不同形貌的膜層進行微區掃描和點掃描,對膜層整體做面掃描,各組試樣均得到類似的結果,如圖2 和圖3 所示。轉化膜主要由Ca、P 和O 元素構成,3 種元素均勻地分布于膜層的不同區域,而H 元素由于原子序數低而無法檢出,片狀結構(區域1、點1)中的鈣磷比約為1∶1,符合CaHPO4的元素構成。其中球狀結構的膜層(區域2)除Ca、P、O 以外,還檢出了少量Mg 元素,猜測這部分Mg 元素來源于轉化初期形成的Mg(OH)2。
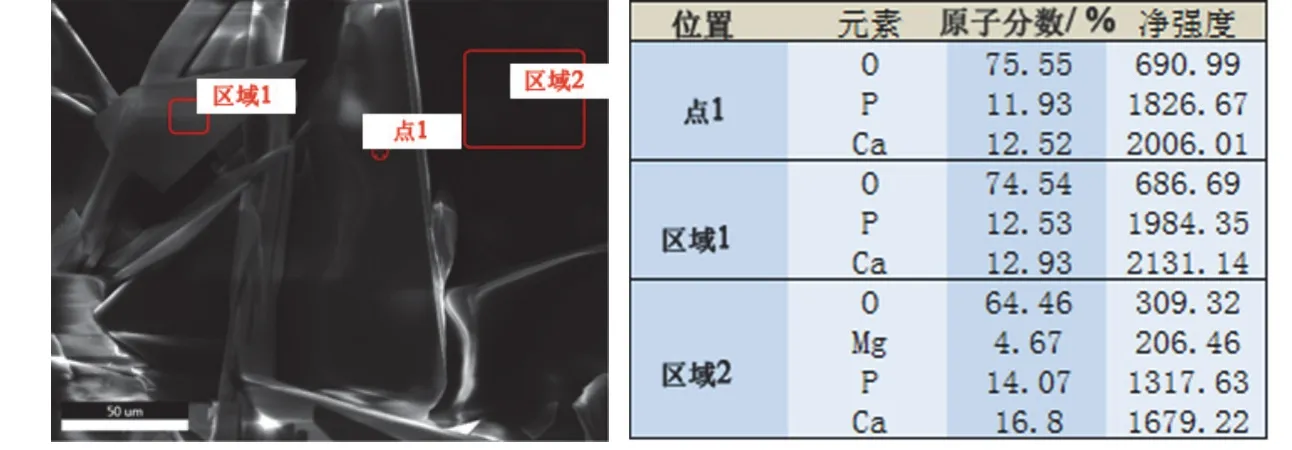
圖2 轉化膜不同位置的能譜分析 Figure 2 EDS analysis at different positions of conversion film
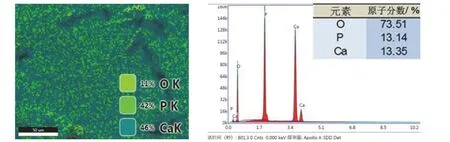
圖3 轉化膜的EDS 面掃描結果 Figure 3 EDS plane scan result of conversion film
2.2.2 XRD
從圖4 可知,轉化膜的衍射峰主要有11.6°、20.94°、29.28°、34.44°、47.92°、72.7°等,分別對應CaHPO4·H2O 和CaPO3(OH)·H2O。
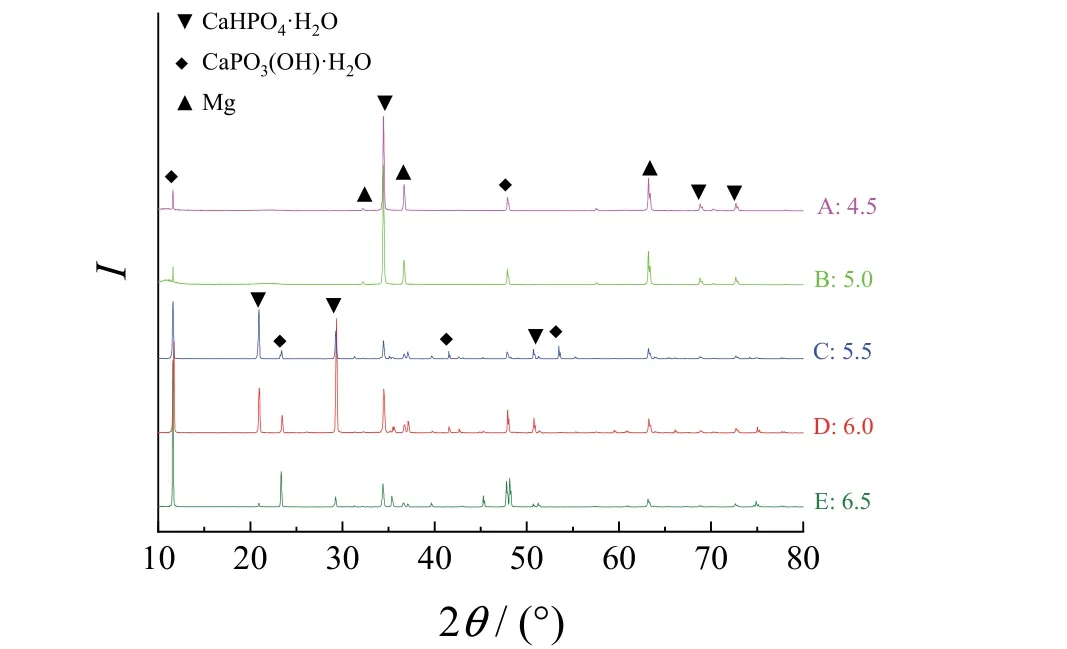
圖4 不同pH 下所制轉化膜的XRD 譜圖 Figure 4 XRD patterns of conversion films prepared with different p H
為了探究膜層的生長過程,分析Mg 元素在轉化膜中的存在形式,設計了如表2 所示的試驗組:將9 組共18 個試樣在不同pH 的轉化液中浸泡一定時間后取出,用1000 號SiC 砂紙輕輕磨掉一部分轉化膜。重復上述浸泡與磨的過程3 次,之后用XRD 分析轉化膜的成分。

表2 探究轉化膜生長過程的試驗設置 Table 2 Conditions of experiments for exploring the growth of conversion film
18 個試樣中有16 個檢出了Mg(OH)2峰(18.527°、37.983°、50.785°和72.069°),圖5 顯示了其中較為典型的3 組(pH 6.0,轉化時間1 h)、5 組(pH 5.5,轉化時間2 h)和7 組(pH 5.0,轉化時間4 h)樣品的XRD 圖譜,其中pH 較高的試樣更容易檢出Mg(OH)2,部分試樣未檢出Mg(OH)2的主要原因是打磨時力度稍大就會導致膜層過薄甚至暴露基體。據此有理由推測不同pH 條件下膜層生長初期均有Mg(OH)2形成。結合EDS 結果可知,成膜初期少量Mg 被氧化后以Mg(OH)2的形式與CaHPO4·H2O 一同附著在鎂合金表面,二者共同組成了球狀結構的轉化膜。
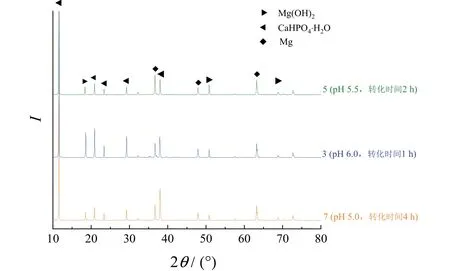
圖5 生長過程中所得膜層的XRD 譜圖 Figure 5 XRD patterns of conversion films obtained during the growth process
2.3 轉化膜的耐蝕性
氯離子極性很強,易吸附在鎂合金表面,令微小的局部區域內離子濃度過高,腐蝕產物形成一個疏松微小的包套,使其中的基體快速腐蝕[8]。磷酸鹽膜層能將金屬基材表面的活性降低到很小的程度,從而減弱后續的腐蝕反應。膜層還給金屬表面各處提供了一個同等的電化學電位,抑制了局部的陰極反應和陽極“點蝕”,從而減少了電化學腐蝕[9]。
2.3.1 電化學測量
從圖6 可知:C 組的阻抗譜曲線半徑最大,其次為D 組,其余組的阻抗譜曲線半徑相近。從表3 可知:C 組腐蝕電位(φcorr)最正,腐蝕電流密度( jcorr)也最低,B 組和D 組次之。這說明pH 為5.5 時形成的轉化膜耐蝕性最好。
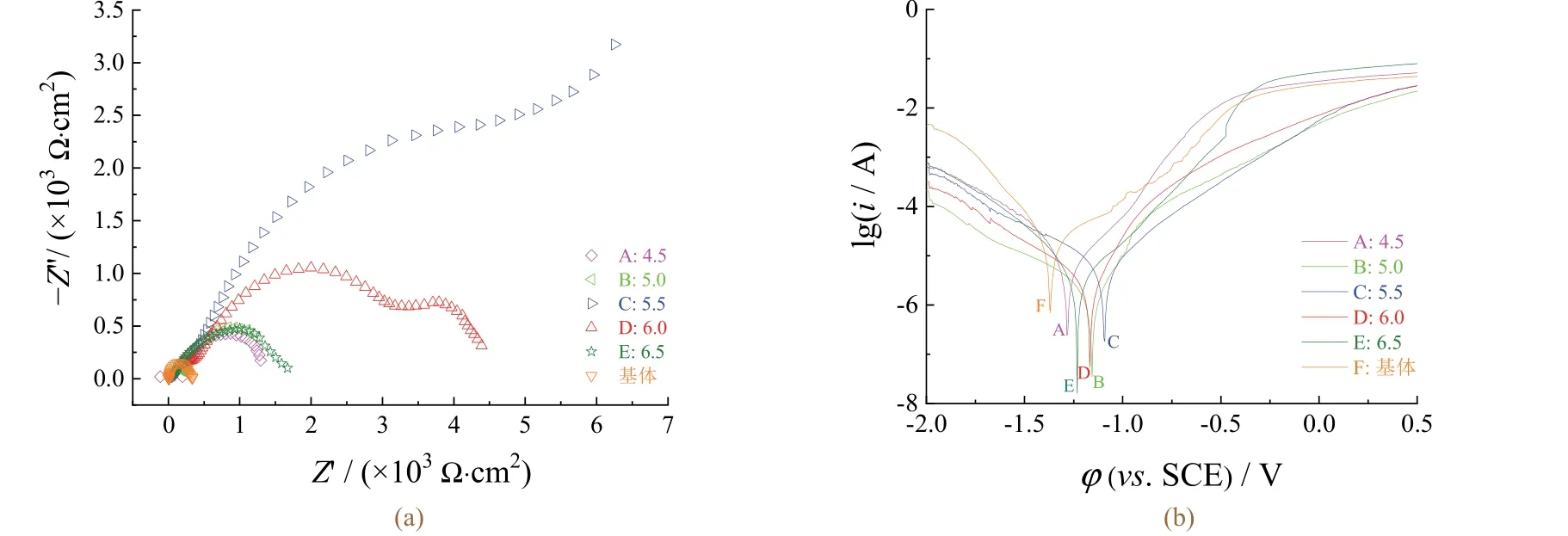
圖6 基體與不同p H 下所得轉化膜的電化學阻抗譜(a)和極化曲線(b) Figure 6 EIS plots (a) and Tafel curves (b) of substrate and conversion films obtained at different pHs
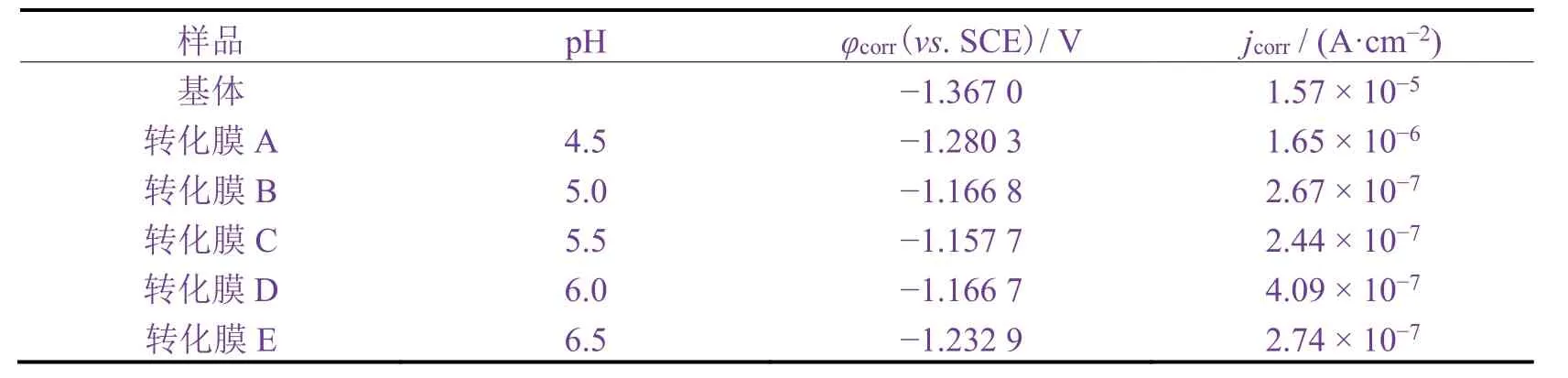
表3 基體與不同p H 下所得轉化膜的腐蝕電位和腐蝕電流密度 Table 3 Corrosion potentials and corrosion current densities of substrate and conversion films obtained at different p Hs
2.3.2 人體仿生液浸泡試驗
轉化膜浸泡后的模擬體液依舊澄清且無沉淀生成。基體被嚴重腐蝕,表面可見大量點蝕坑。轉化膜表面雖有明顯的腐蝕痕跡,主要體現在表面較浸泡前更暗并失去光澤,但依舊完整,未出現大規模的開裂或脫落。使用掃描電鏡進一步觀察試樣不同位置的腐蝕情況(見圖7)時發現,膜層裂縫相較于浸泡前有擴大的跡象,轉化膜受到一定程度的破壞,這導致了膜層表面失去光澤,但膜層整體依然完好,未暴露鎂合金基體,同時在部分膜層表面觀察到再結晶的趨勢,說明膜層在人體仿生液中有一定的自愈合能力。這證明所制Ca-P 轉化膜能夠在一定程度上保護處于人體體液環境中的鎂合金,減緩其腐蝕速率。

圖7 在人體仿生液中浸泡168 h 后基體(a)與膜層不同位置(b、c、d)的形貌 Figure 7 Morphologies of substrate (a) and different positions (b, c, d) of conversion film after being immersed in simulated body fluid for 168 h
2.4 成膜機理
在磷化液中膜層形成的熱力學動力是由金屬基體的異質性和磷酸二氫銨的水解平衡運動引起的。鎂合金浸入到Ca-P 轉化液中后,首先由鎂合金基體作為陰極發生析氫反應[2],如式(1)和式(2)所示。
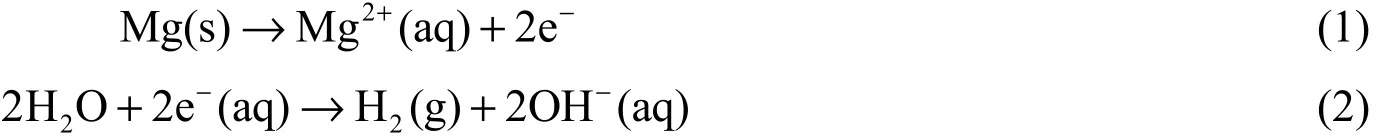
在析氫反應中,Mg 很快就形成了Mg2+,隨著H+的消耗、Mg2+的生成,鎂合金附近局部pH 升高,OH-濃度增加,反應生成的OH-參與式(3)和式(4)所示的反應。
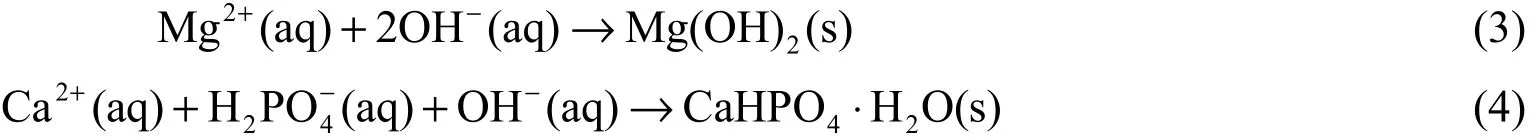
析氫反應開始之初,少量Mg(OH)2迅速附著于鎂合金基體表面,形成一層1 ~ 2 μm 厚的薄膜[8]并阻止析氫反應進一步進行,反應(3)放緩,反應(4)逐漸占據主導地位,此時Mg(OH)2和CaHPO4一同附著在基體上形成球狀轉化膜。最終,沉淀與溶液處于反應(4)的動態平衡中。
鎂合金基體加入轉化液前,溶液中有少量CaHPO4·H2O 沉淀,pH 越高則沉淀量越多,因此不同pH 的轉化液均為CaHPO4的過飽和溶液。成膜初期形成的球狀膜為CaHPO4·H2O 的結晶和生長提供了良好的形核點,促進沉淀于燒杯底部的CaHPO4·H2O 溶解并在試樣表面重新結晶[9],形成片狀的膜層。片狀膜層的形成會阻礙球狀膜層的生長,而pH 越高,沉淀于燒杯底部的CaHPO4·H2O 越穩定,不利于CaHPO4·H2O在試樣表面重新結晶。所以pH 較高(> 5.5)時更有利于球狀結構的生長,反之則有利于片狀結構的生長。
轉化液pH 較低(< 5.0)時,H+在鎂合金基體附近被迅速還原成H2,鎂合金基體表面產生大量氣泡,鎂合金腐蝕速率過快,轉化膜生長速率過快,而且對已形成的轉化膜產生腐蝕作用,導致膜層疏松多孔且不均勻;pH 較高(> 6.0)時,溶液中大量的Ca2+和 H2PO?4提前沉淀于燒杯底部,溶液中離子濃度較低,不利于膜層形成。pH 適中(5.5)時生成的轉化膜最為致密均勻,制得的膜層能更好地保護鎂合金基體。
3 結論
以Ca(NO3)2和NH4H2PO4為原料,通過液相沉積法在鎂合金表面制備Ca-P 轉化膜,所制膜層由高純度的CaHPO4和少量Mg(OH)2構成,可以顯著提高AZ31 鎂合金在人體環境中的耐蝕性。
Ca-P 轉化膜由片狀和球狀兩種形貌的結構組成:球狀結構在成膜初期形成,主要由CaHPO4·H2O 和少量Mg(OH)2構成;片狀結構完全由CaHPO4構成。pH 較高(> 5.5)時更有利于球狀結構的生長,反之則有利于片狀結構的生長。

